| |
| Med Sci (Paris). 2012 January; 28(1): 31–33. Published online 2012 January 27. doi: 10.1051/medsci/2012281011.L’ADN du soi, allié du système immunitaire pour la fonction adjuvante de l’alun Thomas Marichal,1* Fabrice Bureau,1** and Christophe J. Desmet1*** 1Laboratoire de physiologie cellulaire et moléculaire, GIGA-recherche, université de Liège, avenue de l’Hôpital 1, B-4000Liège, Belgique MeSH keywords: Adjuvants immunologiques, Alun, Animaux, ADN, immunologie, Immunité innée, Immunoglobuline E, biosynthèse, Immunoglobuline G, Facteur-3 de régulation d'interféron, Souris, Modèles immunologiques, Lymphocytes auxiliaires Th2, Vaccination |
La vaccination constitue l’une des principales armes de la médecine moderne dans la lutte contre les maladies infectieuses. Les préparations vaccinales sont le plus souvent constituées d’organismes pathogènes tués ou atténués ou d’extraits de ceux-ci. De nombreux composants issus du pathogène, par exemple des acides nucléiques ou des molécules d’enveloppe, peuvent être reconnus par le système immunitaire inné et entraîner son activation [
1]. Lors de l’administration de nombreuses préparations vaccinales, l’activation de l’immunité innée fournit ainsi une aide indispensable au développement des réponses immunes adaptatives [
2]. Dans certains cas cependant, les réponses induites par les préparations vaccinales seules sont trop faibles pour conférer une immunisation suffisante. On ajoute alors à ces vaccins un adjuvant, qui augmentera l’immunogénicité des préparations. |
L’ADN extracellulaire libéré lors d’une injection d’alun est un immunostimulant puissant À l’heure actuelle, les adjuvants approuvés pour la vaccination humaine les plus fréquemment utilisés sont les sels d’aluminium (appelés plus communément alun). L’alun a été introduit il y a presque un siècle, de manière relativement empirique, et il a longtemps été considéré comme immunologiquement inerte [
3]. Ce n’est que très récemment qu’on assiste à un regain d’intérêt pour les mécanismes d’action de l’alun. Il a ainsi été montré que l’alun active certains récepteurs de l’immunité innée [
4] ainsi que la libération de signaux endogènes tels que de l’acide urique [
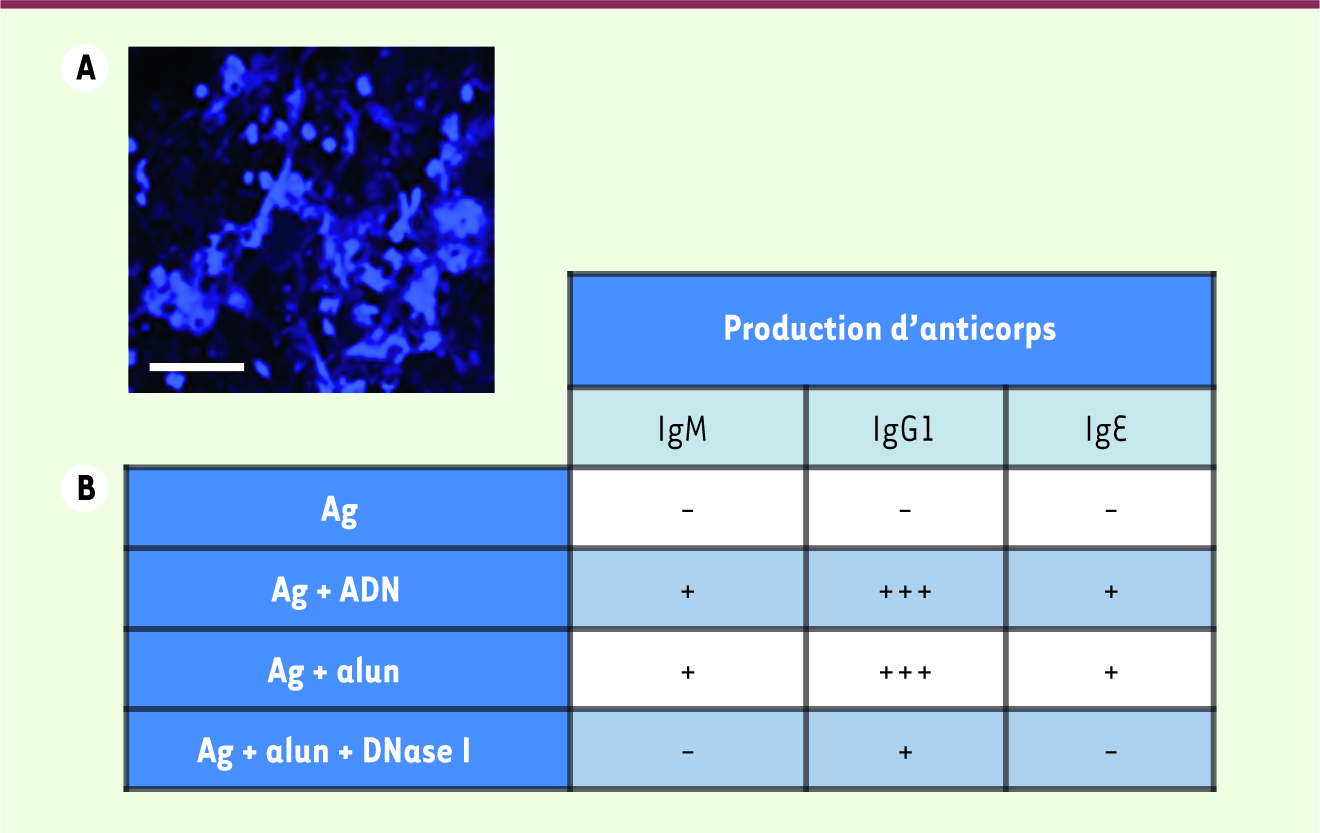
5]. L’alun est donc loin d’être immunologiquement inerte, et on peut même envisager que, comme pour les autres molécules adjuvantes connues [2], il agisse via l’activation de l’immunité innée. Nous nous sommes intéressés, chez la souris, à la composition des dépôts d’alun qui se forment rapidement localement après injection. Nous avons observé que la surface de ces dépôts est couverte de noyaux de cellules mourantes et de fibres de chromatine (Figure 1A) et que le liquide interstitiel au site d’injection contient des quantités significatives d’ADN extracellulaire [
6]. La mortalité cellulaire et la libération d’ADN sont la conséquence d’une certaine cytotoxicité connue de l’alun. Cet ADN, parce qu’il est extracellulaire, peut être reconnu par le système immunitaire inné et l’activer [
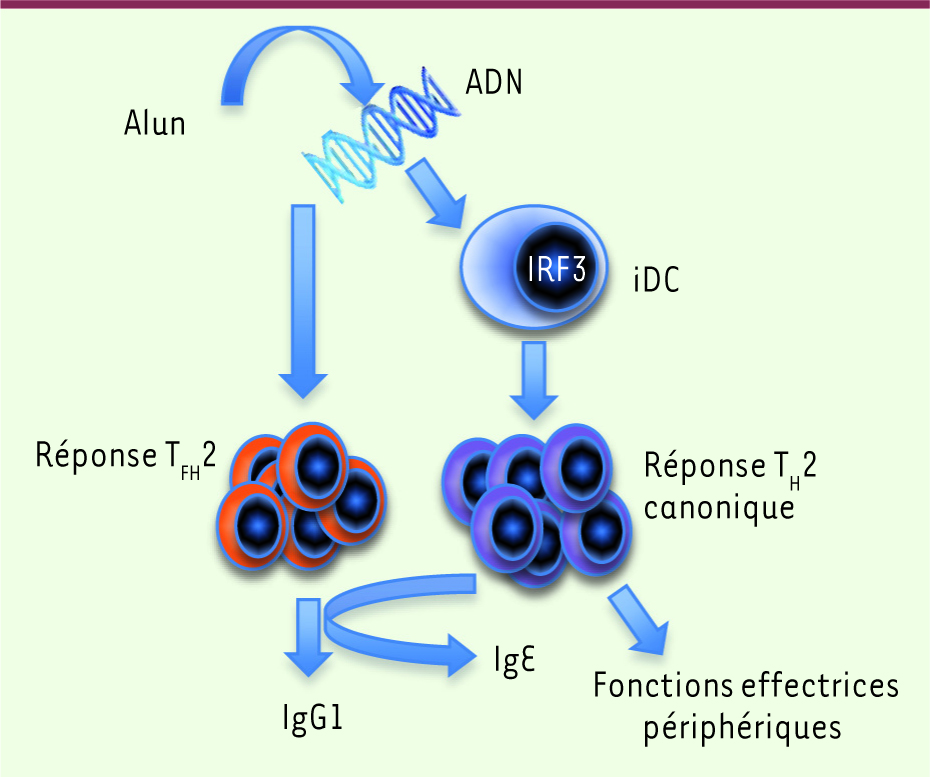
7]. Nous avons dès lors étudié l’implication potentielle de la libération d’ADN des cellules mortes dans les fonctions adjuvantes de l’alun. Nous avons observé que l’ADN de souris, purifié et injecté en quantités similaires à celles que l’on mesure au site d’injection de l’alun, peut, à lui seul, promouvoir aussi efficacement que l’alun la production d’anticorps de type IgG1 et IgE, les isotypes principalement induits lors d’une immunisation à l’alun (Figure 1B). De plus, l’élimination de l’ADN extracellulaire au site d’injection par un traitement à la DNase I permet d’inhiber la production d’IgG1 et d’IgE induite par l’alun. Ces résultats suggèrent donc que, lors d’une vaccination contenant de l’alun, l’ADN de l’hôte lui-même, libéré dans le milieu extracellulaire, agit comme un signal immunostimulant endogène capable de promouvoir la production d’anticorps.
 | Figure 1.
L’induction de la libération d’ADN de l’hôte est impliquée dans l’activité adjuvante de l’alun. A. Photographie en microscopie confocale de la surface d’un dépôt d’alun. L’ADN est coloré en bleu par un agent intercalaire capable de se lier à l’ADN extracellulaire ou à l’ADN du noyau de cellules mortes. (Barre d’échelle, 50 µm) B. Tableau récapitulatif des effets adjuvants de l’alun (Ag + alun) et de l’ADN du soi (Ag + ADN) sur la production d’anticorps de type IgM, IgG1 et IgE comparés à une immunisation avec un antigène (Ag) en l’absence d’adjuvant. Les effets de la digestion de l’ADN extracellulaire sont également illustrés (Ag + alun + DNase I). |
|
Les réponses IgG1 et IgE induites lors de l’immmunisation par l’alun mettent en jeu des voies T H2 différentes L’ADN eucaryote est capable d’activer différentes voies de signalisation de l’immunité innée [
8]. Afin d’étudier la contribution potentielle de ces voies dans l’activité adjuvante de l’alun, nous avons utilisé différentes lignées de souris, chacune déficiente pour un des gènes impliqués dans les voies de détection de l’ADN. Nous avons pu ainsi mettre en évidence un rôle essentiel de l’interferon response factor-3 (Irf3) dans la production d’IgE induite par l’immunisation à l’alun. L’invalidation d’Irf3 n’affectait pas en revanche la production d’IgG1, l’isotype protecteur majeur induit par l’alun. Nous n’avons pas pu, dans cette étude, identifier quel acteur était impliqué dans la reconnaissance de l’ADN conduisant à la production d’IgG1. Il est généralement admis que la production d’IgG1 et d’IgE lors de l’immunisation à l’alun dépend de l’induction de réponses T auxiliaires de type 2 (TH2). Il apparaît cependant de plus en plus clairement que les réponses TH2 induites par l’alun n’impliquent pas qu’un seul type de lymphocytes TH2 [
9]. Nous avons observé que les souris déficientes Irf3
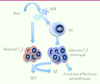
−/− développent des réponses TH2 dont l’intensité est atténuée. De plus, elles sont totalement protégées du développement d’allergies respiratoires dans un modèle expérimental murin classique utilisant l’alun comme adjuvant pro-TH2, tout en conservant une production d’IgG1 comparable à celle de souris de type sauvage. Dès lors, nous proposons que l’ADN de l’hôte libéré par l’action de l’alun stimule deux réponses TH2 qualitativement différentes (Figure 2) : (1) la première, dépendante d’Irf3, ferait intervenir des lymphocytes TH2 « canoniques », qui interviennent essentiellement dans les tissus périphériques, par exemple dans des réponses de type allergique. Cette première réponse promouvrait également la production d’IgE mais n’aurait aucun impact sur la production d’IgG1. (2) La seconde réponse, indépendante d’Irf3, ferait intervenir des lymphocytes T auxiliaires folliculaires de type 2 (TFH2), lesquels stimuleraient la production d’IgG1 en fournissant l’aide nécessaire aux plasmocytes producteurs d’anticorps.
 | Figure 2.
Modèle proposé du mécanisme de l’activité adjuvante de l’ADN de l’hôte dans la vaccination à l’alun. L’alun induit la libération d’ADN de l’hôte au site d’injection ; l’ADN active le système immunitaire inné et promeut ainsi les réponses adaptatives. Cette réponse comprendrait deux composantes : l’une dépendante d’Irf3, l’autre indépendante d’Irf3. Dans la voie indépendante d’Irf3, l’ADN entraîne l’activation de cellules T ayant une fonction auxiliaire folliculaire (TFH2) apportant aux lymphocytes B l’aide nécessaire à la production d’IgG1. Dans la voie dépendante d’Irf3, l’ADN libéré induit la migration de cellules dendritiques inflammatoires (iDC) dans les ganglions drainants. Ces iDC induisent une réponse TH2 canonique, incapable de stimuler la production d’anticorps de manière autonome, mais responsable de fonctions effectrices périphériques et de la production d’IgE à partir de réponses B induites indépendamment. |
Du point de vue mécanistique, nous avons montré qu’Irf3 est requis pour la migration de cellules dendritiques inflammatoires depuis le site d’injection de l’alun vers les ganglions drainants. Ces cellules dendritiques inflammatoires induisent à leur tour la différenciation de lymphocytes TH2 canoniques impliqués dans la production d’IgE et des fonctions effectrices périphériques, mais incapables d’induire une réponse humorale de manière autonome (Figure 2). |
Cette étude montre que la libération d’ADN chez l’hôte lors d’une vaccination est un signal immunostimulant endogène impliqué dans l’activité adjuvante de l’alun. Nos résultats indiquent en outre que l’ADN libéré par l’alun induit la production d’IgE et d’IgG1 par des mécanismes dépendants et indépendants d’Irf3, respectivement. Nous pensons que cette étude contribuera à une meilleure compréhension du fonctionnement des adjuvants actuels. D’autre part, la caractérisation fine des mécanismes de réponse à l’ADN pourrait contribuer à terme au développement de nouveaux adjuvants induisant spécifiquement la production d’IgG1 et dépourvus du « biais » TH2 induit par l’alun. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Takeuchi
O
,
Akira
S
. Pattern recognition receptors and inflammation . Cell.
2010; ; 140 : :805.–820. 2.
Coffman
RL
,
Sher
A
,
Seder
RA
. Vaccine adjuvants : putting innate immunity to work . Immunity.
2010; ; 33 : :492.–503. 3.
Marrack
P
,
McKee
AS
,
Munks
MW
. Towards an understanding of the adjuvant action of aluminium . Nat Rev Immunol.
2009; ; 9 : :287.–293. 4.
Eisenbarth
SC
,
Colegio
OR
,
O’Connor
W
, et al.
Crucial role for the Nalp3 inflammasome in the immunostimulatory properties of aluminium adjuvants . Nature.
2008; ; 453 : :1122.–1126. 5.
Kool
M
,
Willart
MA
,
van Nimwegen
M
, et al.
An unexpected role for uric acid as an inducer of T helper 2 cell immunity to inhaled antigens and inflammatory mediator of allergic asthma . Immunity.
2011; ; 34 : :527.–540. 6.
Marichal
T
,
Ohata
K
,
Bedoret
D
, et al.
DNA released from dying host cells mediates aluminum adjuvant activity . Nat Med.
2011; ; 17 : :996.–1002. 7.
Kono
H
,
Rock
KL
. How dying cells alert the immune system to danger . Nat Rev Immunol.
2008; ; 8 : :279.–289. 8.
Takeshita
F
,
Ishii
KJ
. Intracellular DNA sensors in immunity . Curr Opin Immunol.
2008; ; 20 : :383.–388. 9.
Fazilleau
N
,
McHeyzer-Williams
LJ
,
Rosen
H
,
McHeyzer-Williams
MG
. The function of follicular helper T cells is regulated by the strength of T cell antigen receptor binding . Nat Immunol.
2009; ; 10 : :375.–384. |