| |
| Med Sci (Paris). 2012 January; 28(1): 82–88. Published online 2012 January 27. doi: 10.1051/medsci/2012281021.La prédiction de l’immunogénicité des protéines thérapeutiques Bernard Maillère,1* Stéphanie Delluc,2** and Gilles Ravot3 1CEA, Institut de biologie et de technologies de Saclay, SIMOPRO, 91191Gif sur Yvette, France 2Indicia Biotechnology, 33, avenue de la Californie, 69600Oullins, France 3Protéus, 70, allée Graham Bell, parc Georges Besse, Nîmes, F-30000, France |
Même humanisée, une protéine est potentiellement immunogène chez l’homme Selon la réglementation, les risques d’immunogénicité d’un nouveau produit thérapeutique, c’est-à-dire sa capacité à induire une réponse immunitaire, doivent être évalués chez l’animal puis chez l’homme lors des phases cliniques [
1]. La réponse immunitaire induite par les vaccins et les adjuvants est évaluée chez l’animal afin de s’assurer de son potentiel protecteur et son innocuité. Les molécules organiques induisent en général peu de réponses immunitaires si bien que l’absence de signes d’immunogénicité chez l’animal se confirme généralement chez l’homme lors des phases cliniques. L’apparition des protéines thérapeutiques a toutefois perturbé ce schéma de développement, car les animaux ne suffisent plus pour prédire la réponse immunitaire que l’homme développe contre ces molécules. Ces modèles animaux aident à évaluer la capacité de neutralisation des anticorps produits et à analyser les effets de la présence d’anticorps sur la pharmacocinétique de la molécule, ou l’apparition de symptômes. Toutefois, il n’est pas rare qu’une protéine immunogénique chez l’animal ne le soit pas chez l’homme et réciproquement [
2]. Les insulines porcine et bovine ont été retirées du marché en raison des réponses immunitaires qu’elles provoquaient. Le premier anticorps monoclonal ayant reçu l’autorisation de mise sur le marché était d’origine murine (muromonab, dirigé contre l’antigène CD3), mais les essais thérapeutiques effectués dans les années 1980 avec des anticorps monoclonaux de souris ont bien failli condamner l’avenir des anticorps thérapeutiques en raison de leur immunogénicité [
31]. L’humanisation des séquences a permis de diminuer considérablement les réponses immunitaires induites par les protéines thérapeutiques et a favorisé le développement de très nombreux produits [
3,
32]. Toutefois, l’analyse des observations cliniques effectuées depuis le début des années 2000 montre clairement que l’humanisation ne garantit pas l’absence de réponse immunitaire. Ces réponses ont des conséquences très variables. Les anticorps induits peuvent être apparemment sans conséquence clinique ou au contraire diminuer l’efficacité de la protéine injectée. Par exemple, environ 30 % des patients hémophiles A sévères développent des anticorps neutralisant le facteur VIII thérapeutique qui leur est injecté. Chez les patients atteints de sclérose en plaques, l’interféron bêta peut être neutralisé par les anticorps induits par la répétition des injections [
4]. Les résistances aux anticorps anti-TNFa (tumor necrosis factor), qu’ils soient chimériques ou humains [
33], peuvent être associées à la présence d’anticorps neutralisants [
5]. Lorsque la protéine injectée est également produite par l’organisme, les anticorps induits peuvent provoquer des symptômes auto-immuns et mettre en danger la vie du patient. L’exemple le plus connu est celui de l’érythropoïétine (EPO). À la fin des années 1990, un changement de formulation d’une EPO recombinante l’a rendue bizarrement plus immunogène chez un nombre heureusement limité de patients [
6,
34]. Les anticorps produits neutralisaient non seulement l’activité thérapeutique de l’EPO recombinante, mais également celle de l’EPO naturelle produite par les patients. Ils provoquaient une érythroblastopénie qui se caractérise par une diminution des précurseurs érythroblastiques de la moelle osseuse responsables du renouvellement des globules rouges. Les protéines thérapeutiques représenteront bientôt une classe majeure de médicaments. Plus de trois cents anticorps thérapeutiques sont en cours d’étude clinique et le développement des biosimilaires va accroître la diversité des produits sur le marché. Sachant que les animaux sont de très mauvais modèles prédictifs de la réponse immunitaire chez l’homme, la question se pose de savoir avec quels moyens pouvons-nous prédire au mieux les réponses en anticorps dirigées contre les protéines thérapeutiques afin de s’assurer de l’innocuité de ces nouveaux produits. |
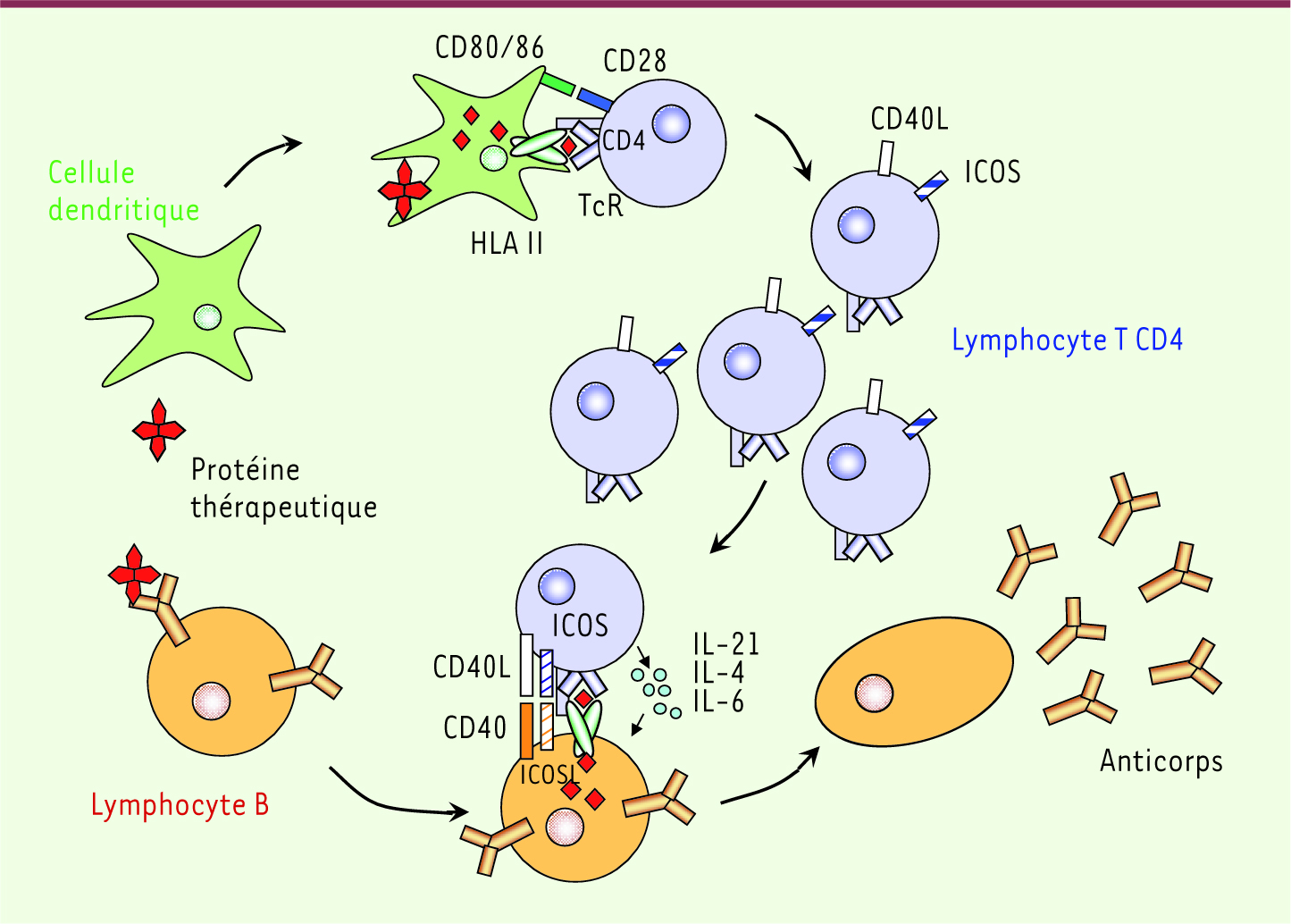
Les méthodes de prédiction de l’immunogénicité d’une protéine : analyse de la réponse des lymphocytes T CD4 spécifiques Rôle des lymphocytes T CD4 dans la réponse immune aux protéines thérapeutiques Face au problème que pose la barrière d’espèce de l’immunogénicité, des modèles de souris humanisées ont été développés (Tableau I). Il existe des souris transgéniques qui expriment la protéine thérapeutique d’origine humaine [
7] ou qui expriment des molécules HLA de classe II [
8]. Il existe également des souris immunodéficientes dont le système hématopoïétique peut être reconstitué avec des cellules souches hématopoïétiques humaines [
9,
35] ( →). Toutefois, ces modèles demeurent imparfaits en raison principalement d’une reconstitution insuffisante du répertoire des lymphocytes, et nécessitent donc d’être améliorés. Les approches prédictives de l’immunogénicité les plus avancées reposent en fait sur l’évaluation de la capacité des protéines thérapeutiques à stimuler les lymphocytes T CD4 humains. Les lymphocytes T CD4 exercent un rôle majeur dans l’apparition des anticorps, car ils fournissent l’aide nécessaire au développement des lymphocytes B en plasmocytes sécréteurs d’anticorps (fonction helper) (Figure 1). Les réponses immunes contre les protéines thérapeutiques sont dépendantes des lymphocytes T CD4 comme l’attestent des observations faites principalement chez les patients hémophiles : les anticorps inhibiteurs sont des IgG et contiennent des mutations somatiques (reflétant la génération d’IgG de haute affinité), deux caractéristiques qui dépendent des lymphocytes T CD4 [
10]. Chez des patients hémophiles avec un taux établi d’anticorps anti-facteur VIII (FVIII), l’infection par le VIH (virus de l’immunodéficience humaine), par la diminution du taux de lymphocytes T CD4 qu’elle entraîne, peut provoquer la disparition des anticorps spécifiques [
11]. Des lymphocytes T CD4 spécifiques du FVIII ont été identifiés chez certains de ces patients porteurs d’anticorps inhibiteurs [ 10]. Chez l’animal, l’absence d’activation des lymphocytes T CD4 est suffisante pour empêcher le déclenchement d’une réponse immunitaire, par exemple contre l’interféron bêta [
12].
 | Figure 1.
La coopération cellulaire dans la réponse humorale dirigée contre les protéines thérapeutiques. La réponse humorale vis-à-vis d’une protéine thérapeutique fait intervenir au moins trois types cellulaires. Les cellules dendritiques immatures captent la protéine et la dégradent en peptides. Parmi les peptides générés, certains possèdent des résidus d’ancrage appropriés pour lier les molécules HLA de classe II et être présentés aux lymphocytes T CD4. Sous l’effet de facteurs inflammatoires pouvant résulter de l’injection, les cellules dendritiques immatures se différencient en cellules dendritiques matures et deviennent aptes à stimuler des lymphocytes T naïfs. Elles migrent dans les ganglions lymphatiques et activent des lymphocytes T CD4 spécifiques des peptides de la protéine présentés par les molécules HLA de classe II. Ces lymphocytes T acquièrent des molécules de costimulation (CD40L, ICOS). La protéine parvient également aux lymphocytes B. Les lymphocytes B possédant une immunoglobuline de surface spécifique de la protéine l’internalisent, la dégradent et génèrent des peptides. Selon un processus similaire à celui décrit dans les cellules dendritiques, des peptides sont présentés aux lymphocytes T CD4 spécifiques et les activent. Leur activation fournit l’aide nécessaire à la différenciation des lymphocytes B en plasmocytes sécréteurs d’IgG spécifiques de la protéine via les molécules de costimulation et les cytokines sécrétées (IL-4, IL-6, IL-21). Ces anticorps produits contre la protéine thérapeutique peuvent neutraliser son activité et modifier sa pharmacologie. |
Tableau I.
| Type de méthodes |
Nature |
Principe |
Avantages/inconvénients |
| Modèle animal |
Souris transgénique pour la protéine thérapeutique |
Recherche d’anticorps |
Reproduit la présence de la protéine d’origine humaine |
| Niveau de tolérance possiblement différent chez l’homme |
| Pas d’éducation des cellules T sur les molécules HLA |
|
|
Souris transgénique pour une molécule HLA de classe II |
Recherche d’anticorps |
Prend en compte la spécificité de la molécule HLA |
| Nombre de modèles limité |
| Protéine non présente dans le « soi » de l’animal |
|
|
Souris immunodéficiente reconstituée avec des cellules souches hématopoïétiques humaines |
Recherche d’anticorps |
Système immunitaire humain |
| Éducation des cellules T humaines sur des molécules HLA non systématique |
| Réponse immunitaire partielle |
| Prise en compte de la diversité humaine possible |
|
| Prédiction in silico
|
Programmes informatiques |
Prédiction de la liaison aux molécules HLA de classe II |
Facile à faire (site internet) |
| Faux positifs |
| Ne renseigne pas sur l’amplitude de la réponse |
|
| Tests biochimiques |
Tests de liaison aux molécules HLA de classe II |
Mesure de l’affinité des peptides pour les molécules HLA de classe II |
Données expérimentales |
| Nécessite des molécules HLA de classe II purifiées |
| Faux positifs |
| Ne renseigne pas sur l’amplitude de la réponse |
|
| Tests prédictifs d’activation des lymphocytes T |
Tests cellulaires in vitro basés sur des cultures de lymphocytes T |
Détection de lymphocytes T spécifiques chez des sujets naïfs |
Reproduit l’activation des lymphocytes T |
| Évaluation de l’intensité et de la fréquence des répondeurs |
| Mesure relative ou absolue (nombre de cellules spécifiques) |
Les différentes approches utilisées pour prédire l’immunogénicité des protéines thérapeutiques.
|
(→) Voir l’article de A. Cachat et al., page 63 de ce numéro
Méthodes d’évaluation de la réponse des lymphocytes T Les lymphocytes T CD4 reconnaissent leurs antigènes sous la forme de peptides, appelés épitopes T, que leur présentent les molécules HLA de classe II. En raison du polymorphisme des molécules HLA, les épitopes T varient d’un individu à un autre, mais certains peuvent également être communs à plusieurs individus. Les méthodes d’évaluation de la réponse des lymphocytes T tiennent compte de ce polymorphisme et se répartissent en tests in silico, biochimiques et cellulaires.
• Les méthodes in silico reposent sur des programmes informatiques qui identifient des peptides susceptibles de se lier aux molécules HLA de classe II [
13]. Elles se fondent sur le constat que la plupart des épitopes T sont des peptides de forte affinité pour les molécules HLA de classe II. Ces méthodes recherchent la présence de motifs spécifiques aux molécules HLA de classe II, établissent des scores de prédiction à partir de matrices reflétant l’influence des différents acides aminés sur la liaison, ou se basent sur des systèmes experts [13].
• Les tests biochimiques de liaison aux molécules HLA de classe II permettent de mesurer l’affinité des peptides et d’identifier les meilleurs ligands par une approche expérimentale et non de modélisation [
14]. L’une et l’autre de ces méthodes ont permis effectivement d’identifier de nombreux épitopes T. Toutefois, elles souffrent d’un handicap commun qui est que tous les peptides liant les molécules HLA de classe II n’induisent pas systématiquement l’activation des lymphocytes T CD4 [
15]. Elles génèrent donc un nombre élevé de faux positifs [13] ce qui impose de vérifier que les peptides identifiés sont effectivement capables de stimuler les lymphocytes T CD4.
• Les tests prédictifs d’activation des lymphocytes T CD4 humains sont les plus informatifs pour prédire l’immunogénicité des protéines [
16,
17]. Leur principe consiste à détecter, dans le sang de sujets normaux possédant des HLA différents, la présence de lymphocytes T CD4 spécifiques des protéines thérapeutiques. Les donneurs n’ayant jamais été a priori en contact avec ces protéines, ces tests tentent de reproduire in vitro l’activation du système immunitaire qui peut avoir lieu lors de l’injection de la protéine thérapeutique chez des patients. Une conséquence de l’absence de contact préalable avec les protéines thérapeutiques est que les lymphocytes T CD4 qui leur sont spécifiques sont naïfs et en très faibles nombres. Les quelques estimations existantes de la taille du répertoire en lymphocytes T naïfs rapportent des valeurs autour de 1 cellule T spécifique d’un épitope T donné pour 1 à 10 millions de cellules [
18]. Pour des protéines immunogènes comme la KLH (Keyhole limpet haemocyanin) la valeur observée est autour de 30 cellules pour 1 million de cellules [17,
19]. Cette faible fréquence nécessite d’amplifier les cellules T in vitro, puis de les activer spécifiquement pour les mettre en évidence. Ces tests sont donc très différents des tests d’immunomonitorage réalisés lors des essais vaccinaux : dans ce cas, les fréquences de lymphocytes T spécifiques des antigènes sont beaucoup plus élevées. Ils partagent toutefois des techniques communes d’immunologie cellulaire, telles que l’Elispot, le marquage intracellulaire des cytokines ou la mesure de prolifération. La justification de l’utilisation des tests prédictifs d’activation des lymphocytes T comme source d’information sur l’immunogénicité des protéines vient de ce que la taille des répertoires des lymphocytes T CD4 naïfs contrôle en partie l’amplitude de la réponse des lymphocytes T CD4 : plus le nombre de lymphocytes T naïfs spécifiques d’une protéine est élevé, plus la réponse sera importante [18]. Le répertoire des lymphocytes T CD4 naïfs est principalement défini par la sélection positive et négative des lymphocytes T CD4 dans le thymus par les peptides du soi [
20]. Les lymphocytes T autoréactifs, qui reconnaissent des peptides du soi, sont en partie éliminés de l’organisme par cette sélection. L’humanisation des séquences des protéines thérapeutiques réduit donc le nombre de lymphocytes T spécifiques des protéines thérapeutiques. Toutefois, toutes les protéines humaines ne sont pas exprimées dans le thymus. Il est donc possible que des lymphocytes T dirigés contre des séquences humaines persistent dans l’organisme. Tant qu’ils ne sont pas activés, ces lymphocytes T autoréactifs sont inoffensifs et ignorent les antigènes du soi [
21]. En revanche, leur activation peut être déclenchée par l’injection des protéines thérapeutiques et le processus inflammatoire qu’elle peut provoquer. Cette activation déclenche l’apparition d’anticorps spécifiques de la protéine injectée et de symptômes autoimmuns. Les tests prédictifs d’activation des lymphocytes T ont donc pour but de détecter et de quantifier ces lymphocytes T CD4. Ils permettent d’identifier les molécules présentant un risque d’immunogénicité et de mieux comprendre les mécanismes impliqués dans cette immunogénicité. |
Immunogénicité des anticorps thérapeutiques L’humanisation des séquences des anticorps thérapeutiques est sans conteste l’avancée scientifique majeure qui a permis l’explosion de leur développement [3]. L’humanisation peut être plus ou moins prononcée. On distingue les anticorps chimériques, qui sont humanisés sur leur partie constante, les parties variables restant d’origine murine ; les anticorps humanisés, qui ont subi une conversion de l’ensemble de leur séquence d’origine animale en séquences les plus proches possibles des séquences humaines ; les anticorps « humains », qui sont produits à partir de la recombinaison in vitro de gènes d’immunoglobulines humains (phage display) ou de l’immunisation de souris transgéniques humanisées pour les gènes d’immunoglobulines [
36]. Il est communément considéré que plus l’humanisation est élevée, plus les risques de réponse immunitaire sont faibles. Des anticorps chimériques comme le rituximab (reconnaissant l’antigène CD20) [
22] et l’infliximab (anti-TNFα) [
23] induisent chez une partie des patients une réponse humorale alors que des anticorps humanisés tels que le bévacizumab (anti-VEGF [vascular endothelial growth factor]) [
24] et le trastuzumab (herceptine®, anti-HER2/neu receptor) [
25] sont bien tolérés. Pourtant, des anticorps entièrement humains peuvent être immunogènes : c’est le cas de l’adalimumab [
26], un anticorps spécifique du TNFα produit par phage display. Nous avons récemment quantifié le nombre de lymphocytes T CD4 spécifiques de ces anticorps dans le sang de sujets sains possédant des molécules HLA différentes, via une stratégie d’amplification in vitro [17] (Figure 2). Alors que la taille du répertoire de lymphocytes T CD4 spécifiques de la KLH ou d’un anticorps monoclonal de souris est respectivement de 20 et 3 cellules par million de cellules T, ce répertoire est plus restreint pour les anticorps thérapeutiques. Pour les anticorps connus comme pouvant être immunogènes (adalimumab, infliximab, rituximab), le nombre de lymphocytes T CD4 spécifiques est compris entre 0,1 et 1 cellule par million de cellules T. En revanche, ces fréquences sont très inférieures pour les lymphocytes T CD4 spécifiques d’anticorps considérés comme peu immunogènes (trastuzumab [25] et étanercept, qui est une protéine de fusion entre une partie du récepteur du TNFα et la partie Fc d’une IgG1 humaine [
27]). Une exception est le bévacizumab puisque le répertoire des lymphocytes T CD4 spécifiques est au-dessus du seuil de 0,1 cellule par million de cellules alors que le produit est bien toléré [24]. Toutefois, cet anti-VEGF est essentiellement prescrit dans le traitement de tumeurs et donc chez des patients qui peuvent être immunodéprimés. Le rituximab est par exemple très bien toléré chez les patients atteints de lymphome non hodgkinien alors qu’il est souvent immunogène chez des patients traités pour des maladies auto-immunes comme le lupus érythémateux [
28] ou la polyarthrite rhumatoïde [
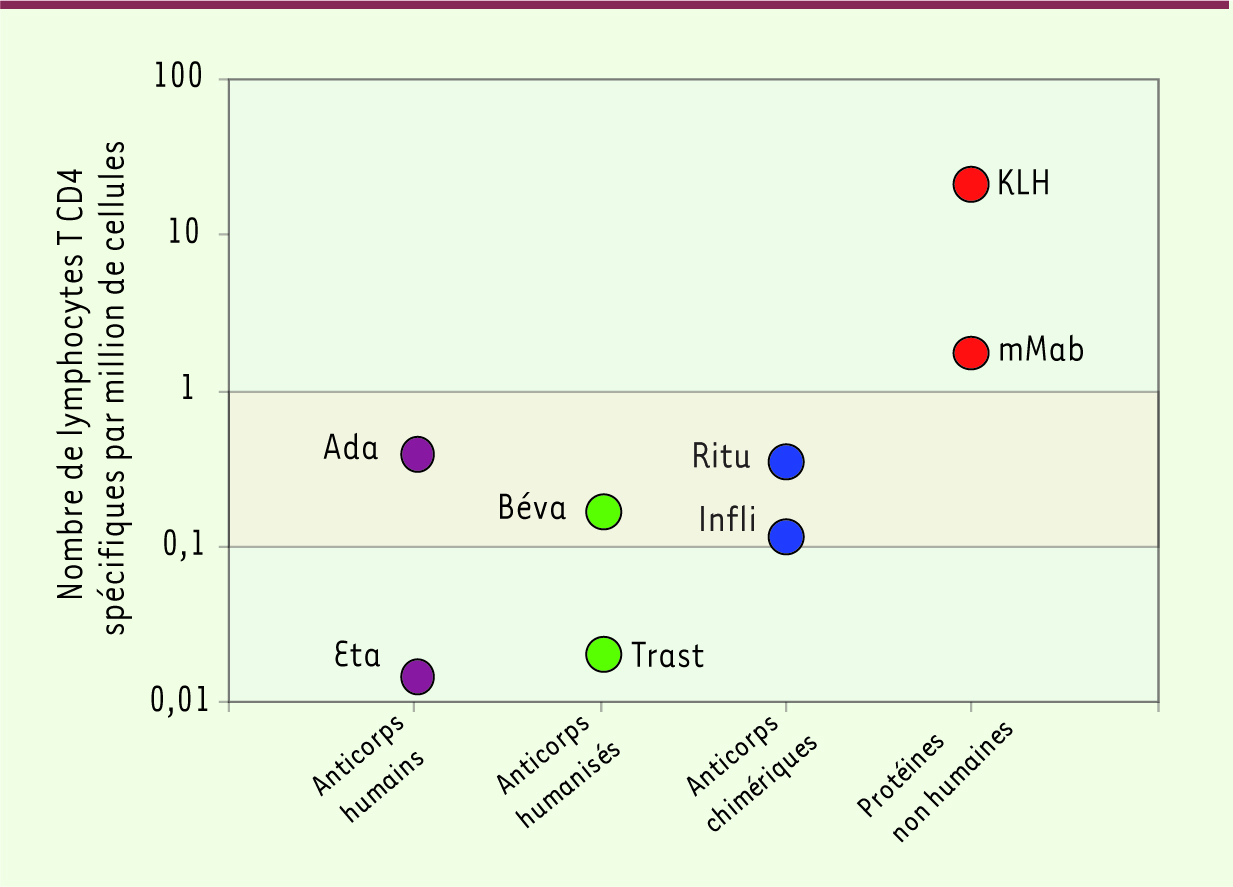
29]. Ces résultats mettent en évidence la présence de lymphocytes T CD4 spécifiques de ces anticorps, y compris s’il s’agit d’anticorps humains ou humanisés, ce qui peut expliquer l’existence de réponses immunitaires contre ces anticorps. De plus, une hiérarchie peut être établie entre ces anticorps en fonction du nombre de cellules T préexistantes dans le sang qui leur sont spécifiques. On comprend l’intérêt de ces approches pour guider le choix des protéines thérapeutiques ayant le moins de risque d’induire une réponse immunitaire, ou pour concevoir de nouvelles protéines dénuées de réponses indésirables.
 | Figure 2.
Quantification du nombre de lymphocytes T CD4 spécifiques d’anticorps thérapeutiques. Les lymphocytes T CD4 spécifiques d’anticorps thérapeutiques de 9 à 15 donneurs sains et typés pour leurs molécules HLA de classe II ont été amplifiés par des cycles de stimulation in vitro. Leur spécificité a été testée par Elispot. Les fréquences de lymphocytes T ont été calculées à partir de la fréquence des puits de culture contenant des lymphocytes T spécifiques. mMAb : Ac monoclonal murin ; Ritu : rituximab ; Infli : infliximab ; Béva : bévacizumab ; Trast : trastuzumab ; Ada : adalimumab ; Eta : étanercept. |
|
Comment comprendre la réponse immunitaire contre l’érythropoïétine recombinante ? Un deuxième exemple de réponse immunitaire que nous avons récemment étudié par ces tests de quantification des lymphocytes T CD4 spécifiques est celui de l’EPO. L’EPO est un facteur de croissance qui intervient dans le renouvellement des globules rouges et qui est utilisé en clinique pour corriger les anémies, en particulier chez les patients insuffisants rénaux. À la fin des années 1990, une augmentation brutale de cas d’érythroblastopénies - une maladie grave caractérisée par une diminution des progéniteurs des globules rouges - a été attribuée à certains lots d’EPO recombinante [6]. Les lots incriminés pouvaient induire une réponse immune humorale qui neutralisait l’activité thérapeutique de l’EPO recombinante et celle de l’EPO naturelle produite par le patient, provoquant l’érythroblastopénie. Les principales investigations réalisées sur ces lots ont proposé que leur immunogénicité était due à la présence de micelles, d’agrégats ou de produits de dégradation issus du caoutchouc des seringues préremplies [
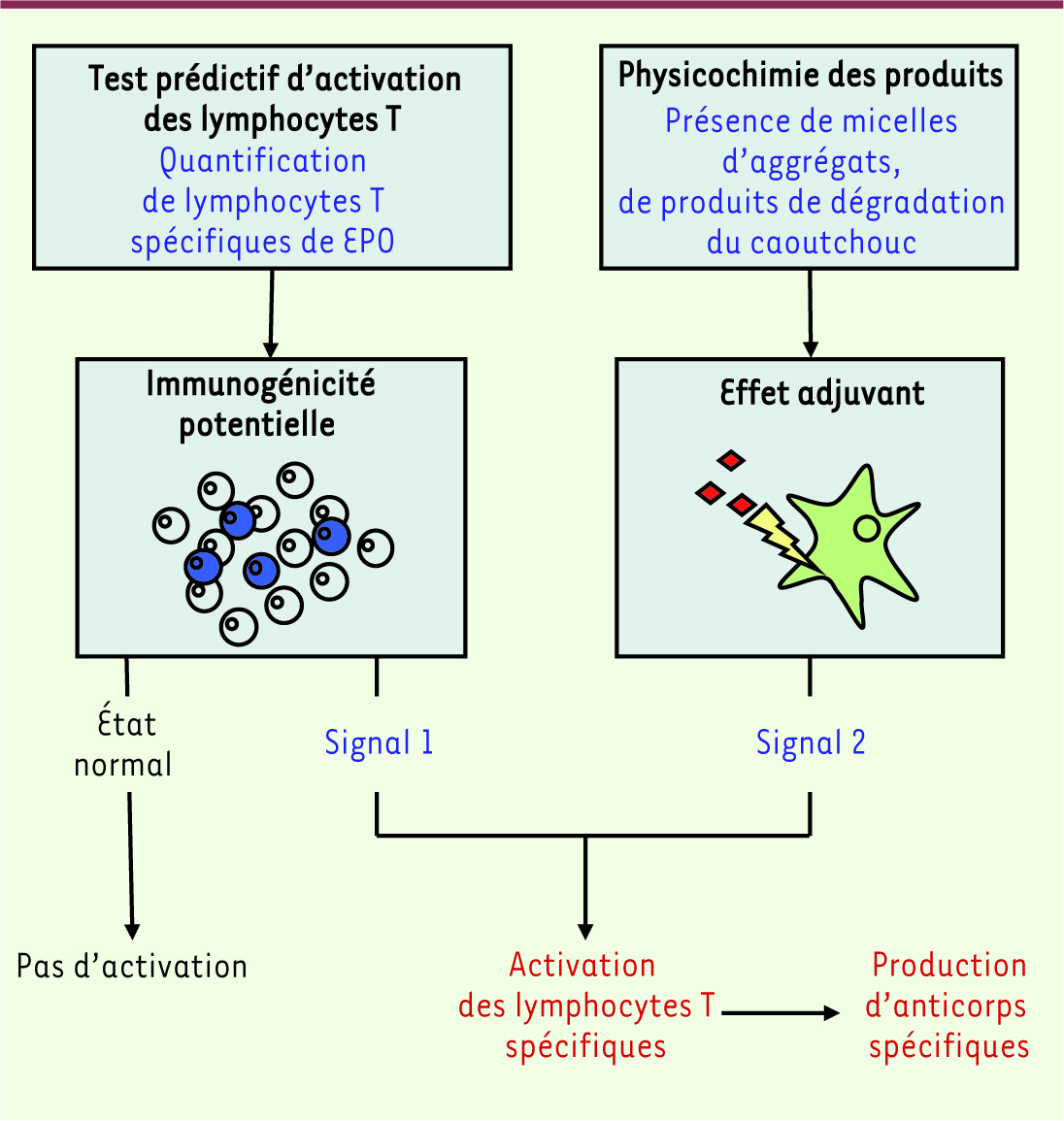
30]. De fait, les mesures prises pour éviter l’altération des lots d’EPO, telles que l’enrobage du caoutchouc des seringues et le respect de la chaîne du froid, ont permis de revenir aux taux initiaux d’érythroblastopénie. Sachant que la réponse humorale dirigée contre l’EPO est dépendante de lymphocytes T CD4, nous avons étudié le répertoire de lymphocytes T CD4 préexistants spécifiques de l’EPO chez des sujets normaux en utilisant la technique d’amplification de ces cellules in vitro [16]. Nous avons observé que ce répertoire était relativement important chez près de la moitié des donneurs sains étudiés. Cette observation nous a permis de proposer un modèle permettant de comprendre les réponses humorales contre l’EPO (Figure 3). Celles-ci résulteraient de l’existence de deux facteurs indépendants : un répertoire de lymphocytes T spécifiques de l’EPO et des conditions favorables à leur activation. Dans des conditions normales, les lymphocytes T CD4 spécifiques de l’EPO ne sont pas activés par l’EPO endogène car il n’y a pas de conditions favorables à leur stimulation. En revanche, l’apport des micelles, agrégats ou produits de dégradation issus du caoutchouc pourrait favoriser la maturation et la migration des cellules dendritiques et ainsi activer les lymphocytes T naïfs. Tant qu’aucun effet adjuvant de ce type n’est apporté par la formulation, l’EPO recombinante est bien tolérée. Mais il est aussi vrai que l’effet adjuvant de la formulation n’aurait pas ces conséquences si le répertoire de lymphocytes T CD4 spécifiques de l’EPO n’était pas aussi important. L’évaluation du nombre de lymphocytes T CD4 présents dans le sang des sujets sains permet donc de définir un potentiel d’immunogénicité et, mieux encore, d’identifier les protéines thérapeutiques ayant un risque d’être immunogènes. La réalisation de ces tests aurait permis d’anticiper le risque d’immunogénicité de l’EPO.
 | Figure 3.
Modèle de compréhension de la réponse immunitaire contre l’érythropoïétine humaine. La réponse immunitaire contre l’EPO dépend de deux signaux distincts : la capacité de la molécule à être reconnue par les lymphocytes T et sa capacité à fournir un effet adjuvant. Ce dernier effet dépend de sa formulation. |
|
L’immunologie prédictive est naissante. Elle va bénéficier à la fois des progrès effectués en recherche fondamentale sur les mécanismes de l’immunogénicité, des observations cliniques et de la caractérisation des produits faite par les industriels. Pour le moment, elle a surtout bénéficié des avancées majeures de ces vingt dernières années dans la compréhension de la réponse immunitaire et des technologies qui en découlent. Le dialogue entre pharmacologues, biologistes, biostatisticiens, investigateurs, sponsors d’études cliniques et immunologistes sera donc au cœur des progrès futurs. Un autre dialogue se développe de plus en plus avec les autorités règlementaires qui, comme en témoignent les récentes directives, surveillent les avancées dans ce domaine. Tous attendent de l’immunologie prédictive les moyens de mieux maîtriser les effets indésirables de l’immunogénicité afin de pouvoir produire des médicaments sûrs et sans effets secondaires. |
Bernard Maillère déclare participer ou avoir participé à des interventions ponctuelles (contrat de collaboration et activité de conseil) pour l’entreprise Protéus. Stéphanie Delluc déclare avoir des liens durables ou permanents (contrat de travail) avec l’entreprise Indicia. Gilles Ravot déclare avoir des liens durables ou permanents (contrat de travail) avec l’entreprise Protéus.
|
1.
Guideline on immunogenicity assessment of biotechnology-derived therapeutic proteins .
EMEA/CHMP/BMWP/14327/2006 2006.
2.
Schellekens
H
. Immunogenicity of therapeutic proteins: clinical implications and future prospects . Clin Ther.
2002; ; 24 : :1720.–1740. 3.
Hwang
WY
,
Foote
J
. Immunogenicity of engineered antibodies . Methods.
2005; ; 36 : :3.–10. 4.
Bertolotto
A
. Neutralizing antibodies to interferon beta: implications for the management of multiple sclerosis . Curr Opin Neurol.
2004; ; 17 : :241.–246. 5.
Emi Aikawa
N
,
de Carvalho
JF
,
Artur Almeida Silva
C
,
Bonfa
E
. Immunogenicity of Anti-TNF-alpha agents in autoimmune diseases . Clin Rev Allergy Immunol.
2010; ; 38 : :82.–89. 6.
Casadevall
N
,
Nataf
J
,
Viron
B
, et al.
Pure red-cell aplasia and antierythropoietin antibodies in patients treated with recombinant erythropoietin . N Engl J Med.
2002; ; 346 : :469.–475. 7.
Hermeling
S
,
Jiskoot
W
,
Crommelin
D
, et al.
Development of a transgenic mouse model immune tolerant for human interferon Beta . Pharm Res.
2005; ; 22 : :847.–851. 8.
Reipert
BM
,
Steinitz
KN
,
van Helden
PM
, et al.
Opportunities and limitations of mouse models humanized for HLA class II antigens . J Thromb Haemost.
2009; ; 7 ((suppl 1)) : :92.–97. 9.
Becker
PD
,
Legrand
N
,
van Geelen
CM
, et al.
Generation of human antigen-specific monoclonal IgM antibodies using vaccinated “human immune system” mice . PLoS One.
2010; ; 5. 10.
Jacquemin
M
,
Vantomme
V
,
Buhot
C
, et al.
CD4+ T-cell clones specific for wild-type factor VIII: a molecular mechanism responsible for a higher incidence of inhibitor formation in mild/moderate hemophilia A . Blood.
2003; ; 101 : :1351.–1358. 11.
Bray
GL
,
Kroner
BL
,
Arkin
S
, et al.
Loss of high-responder inhibitors in patients with severe hemophilia A and human immunodeficiency virus type 1 infection: a report from the Multi-center hemophilia cohort study . Am J Hematol.
1993; ; 42 : :375.–379. 12.
Yeung
VP
,
Chang
J
,
Miller
J
, et al.
Elimination of an immunodominant CD4+ T cell epitope in human IFN-beta does not result in an in vivo response directed at the subdominant epitope . J Immunol.
2004; ; 172 : :6658.–6665. 13.
Wang
P
,
Sidney
J
,
Dow
C
, et al.
A systematic assessment of MHC class II peptide binding predictions and evaluation of a consensus approach . PLoS Comput Biol.
2008; ; 4 : :e1000048.. 14.
Southwood
S
,
Sidney
J
,
Kondo
A
, et al.
Several common HLA-DR types share largely overlapping peptide binding repertoires . J Immunol.
1998; ; 160 : :3363.–3373. 15.
Castelli
FA
,
Leleu
M
,
Pouvelle-Moratille
S
, et al.
Differential capacity of T cell priming in naive donors of promiscuous CD4+ T cell epitopes of HCV NS3 and core proteins . Eur J Immunol.
2007; ; 37 : :1513.–1523. 16.
Delluc
S
,
Ravot
G
,
Maillere
B
. Quantification of the preexisting CD4 T-cell repertoire specific for human erythropoietin reveals its immunogenicity potential . Blood.
2010; ; 116 : :4542.–4545. 17.
Delluc
S
,
Ravot
G
,
Maillere
B
. Quantitative analysis of the CD4 T-cell repertoire specific to therapeutic antibodies in healthy donors . Faseb J.
2011; ; 25 : :2040.–2048. 18.
Moon
JJ
,
Chu
HH
,
Pepper
M
, et al.
Naive CD4+ T cell frequency varies for different epitopes and predicts repertoire diversity and response magnitude . Immunity.
2007; ; 27 : :203.–213. 19.
Geiger
R
,
Duhen
T
,
Lanzavecchia
A
,
Sallusto
F
. Human naive and memory CD4+ T cell repertoires specific for naturally processed antigens analyzed using libraries of amplified T cells . J Exp Med.
2009; ; 206 : :1525.–1534. 20.
Jenkins
MK
,
Chu
HH
,
McLachlan
JB
,
Moon
JJ
. On the composition of the preimmune repertoire of T cells specific for peptide-major histocompatibility complex ligands . Annu Rev Immunol.
2010; ; 28 : :275.–294. 21.
Ohashi
PS
,
Oehen
S
,
Buerki
K
, et al.
Ablation of “tolerance” and induction of diabetes by virus infection in viral antigen transgenic mice . Cell.
1991; ; 65 : :305.–317. 22.
Pijpe
J
,
van Imhoff
GW
,
Spijkervet
FK
, et al.
Rituximab treatment in patients with primary Sjogren’s syndrome: an open-label phase II study . Arthritis Rheum.
2005; ; 52 : :2740.–2750. 23.
Baert
F
,
Noman
M
,
Vermeire
S
, et al.
Influence of immunogenicity on the long-term efficacy of infliximab in Crohn’s disease . N Engl J Med.
2003; ; 348 : :601.–608. 24.
Gordon
MS
,
Margolin
K
,
Talpaz
M
, et al.
Phase I safety and pharmacokinetic study of recombinant human anti-vascular endothelial growth factor in patients with advanced cancer . J Clin Oncol.
2001; ; 19 : :843.–850. 25.
Van Walle
I
,
Gansemans
Y
,
Parren
PW
, et al.
Immunogenicity screening in protein drug development . Expert Opin Biol Ther.
2007; ; 7 : :405.–418. 26.
Bartelds
GM
,
Wijbrandts
CA
,
Nurmohamed
MT
, et al.
Clinical response to adalimumab: relationship to anti-adalimumab antibodies and serum adalimumab concentrations in rheumatoid arthritis . Ann Rheum Dis.
2007; ; 66 : :921.–926. 27.
Dore
RK
,
Mathews
S
,
Schechtman
J
, et al.
The immunogenicity, safety, and efficacy of etanercept liquid administered once weekly in patients with rheumatoid arthritis . Clin Exp Rheumatol.
2007; ; 25 : :40.–46. 28.
Looney
RJ
,
Anolik
JH
,
Campbell
D
, et al.
B cell depletion as a novel treatment for systemic lupus erythematosus: a phase I/II dose-escalation trial of rituximab . Arthritis Rheum.
2004; ; 50 : :2580.–2589. 29.
Thurlings
RM
,
Teng
O
,
Vos
K
, et al.
Clinical response, pharmacokinetics, development of human anti-chimeric antibodies, and synovial tissue response to rituximab treatment in patients with rheumatoid arthritis . Ann Rheum Dis.
2010; ; 69 : :409.–412. 30.
Schellekens
H
,
Jiskoot
W
. Erythropoietin-associated PRCA: Still an unsolved mystery . J Immunotoxicol.
2006; ; 3 : :123.–130. 31.
Stas
P
,
Lasters
I
. Immunogénicité de protéines d’intérêt thérapeutique : les anticorps monoclonaux thérapeutiques . Med Sci (Paris).
2009; ; 25 : :1070.–1077. 32.
Cogné
M
,
Duchez
S
,
Pascal
V
. Transgenèse animale et humanisation des anticorps : des souris pour des hommes . Med Sci (Paris).
2009; ; 25 : :1149.–1154. 33.
Sibilia
J
. Protéine de fusion ou anticorps monoclonal : quel biomédicament choisir dans une maladie inflammatoire ?
Med Sci (Paris).
2009; ; 25 : :1033.–1038. 34.
Casadevall
N
,
Mayeux
P
. Anticorps anti-érythropoïétine chez des patients insuffisants rénaux traités par l’hormone recombinante . Med Sci (Paris).
2002; ; 18 : :542.–543. 35.
Cachat
A
,
Duc Dodon
M
,
Gazzolo
L
,
Rigal
D
,
Villaudy
J
. Les souris ne sont pas des hommes, et pourtant… Ce que les souris humanisées nous apprennent sur les maladies infectieuses . Med Sci (Paris).
2012; ; 28 : :63.–68. 36.
Abès
R
,
Dutertre
CA
,
Teillaud
JL
. Les anticorps : mieux les connaître pour mieux s’en servir . Med Sci (Paris).
2009; ; 25 : :1011.–1019. |