| |
| Med Sci (Paris). 2012 January; 28(1): 96–102. Published online 2012 January 27. doi: 10.1051/medsci/2012281023.Le récepteur Toll-like 8 Un TLR pas comme les autres Lena Alexopoulou,1,2,3* Benoit Desnues,1,2,3** and Olivier Demaria1,2,3*** 1Centre d’immunologie de Marseille-Luminy, Aix-Marseille université, case 906, 13288Marseille Cedex 9, France 2Inserm U631, 13288Marseille, France 3CNRS UMR6102, 13288Marseille, France |
Le système immunitaire est capable de détecter et d’éliminer les micro-organismes pathogènes en discriminant le soi du non-soi. La détection des agents pathogènes est assurée par des récepteurs dits pattern-recognition receptors (PRR), qui reconnaissent des produits (ou motifs moléculaires) conservés et partagés par les agents microbiens et que l’on désigne par le terme PAMP (pathogen-associated molecular patterns, PAMP) [
1]. L’activation des PRR déclenche des voies de signalisation essentielles pour l’élimination des agents infectieux par l’immunité innée. Parallèlement, les voies de signalisation des PRR induisent l’activation des cellules dendritiques, qui sont responsables de l’induction de l’immunité adaptative. Parmi les PRR, les récepteurs Toll-like (TLR) ont été les premiers identifiés et sont les mieux caractérisés. Ils reconnaissent un large spectre de PAMP et jouent un rôle important dans l’orchestration des immunités innée et adaptative [
2–
5], comme en témoigne l’attribution du prix Nobel 2011 à B. Beutler et J. Hoffman [
39].  | Figure 1
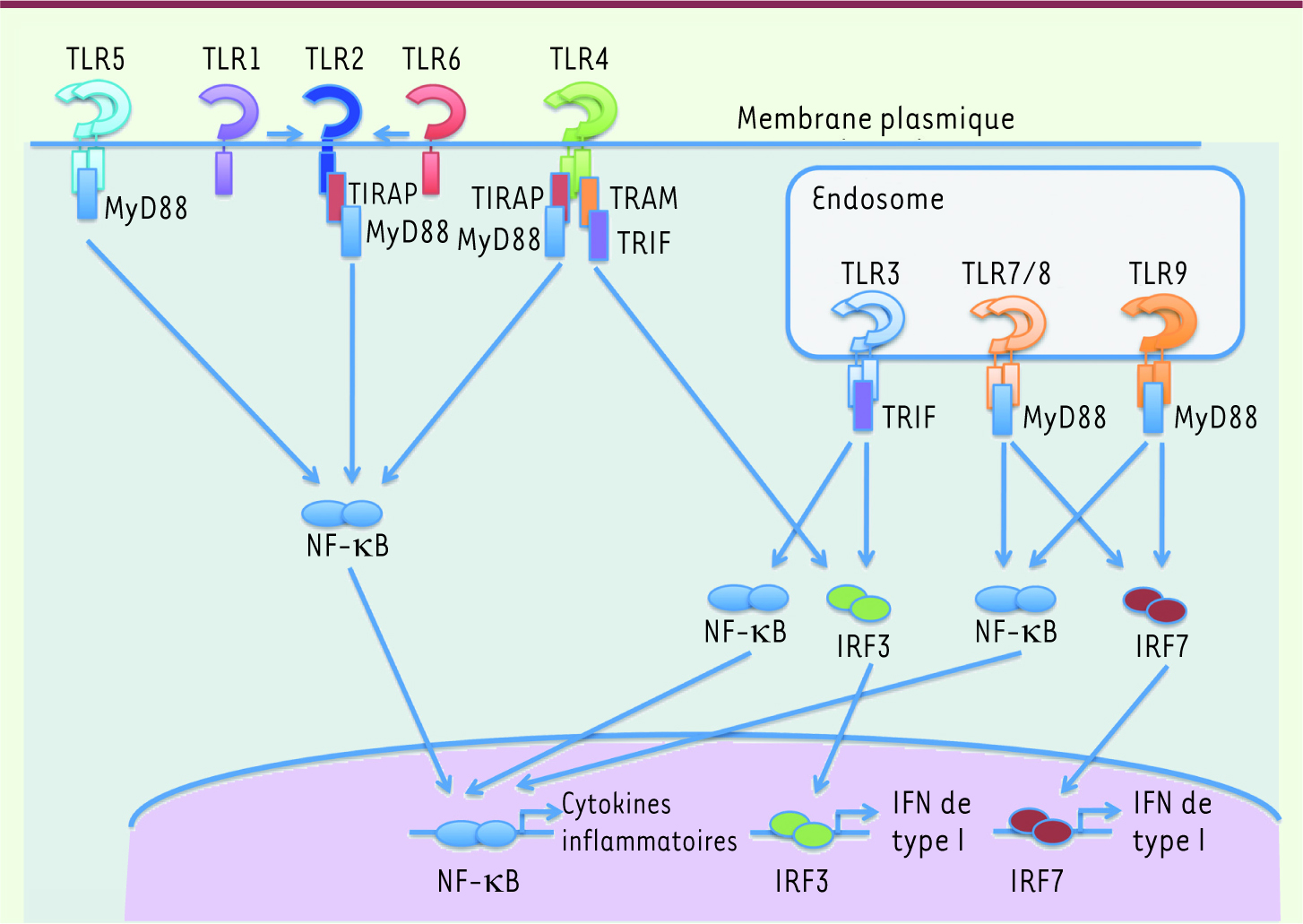
Signalisation par les TLR. Chacun des TLR déclenche des voies de signalisation redondantes et distinctes. L’engagement par les PAMP induit un changement de conformation des TLR permettant une interaction homo- ou hétérotypique des TLR et le recrutement de molécules adaptatrices telles que MyD88, TRAM, TRIF ou TIRAP. TLR5 recrute MyD88 pour activer NF-κB et induire l’expression de cytokines pro-inflammatoires. Les hétérodimères TLR1-TLR2 et TLR6-TLR2 induisent également l’activation de NF-κB après recrutement de TIRAP et de MyD88. TLR4 active NF-κB à partir de la membrane plasmique via le recrutement de TIRAP et MyD88 ; parallèlement, TRAM et TRIF sont recrutées pour activer IRF3 et l’expression d’IFN de type I. Parmi les TLR endolysosomaux (TLR3, TLR7, TLR8 et TLR9), TLR3 recrute de manière exclusive TRIF pour activer IRF3 et NF-κB alors que TLR7, TLR8 (chez l’homme) et TLR9 recrutent MyD88 pour activer NF-κB et IRF7, responsable de l’expression d’IFN de type I. |
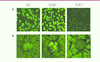 | Figure 2
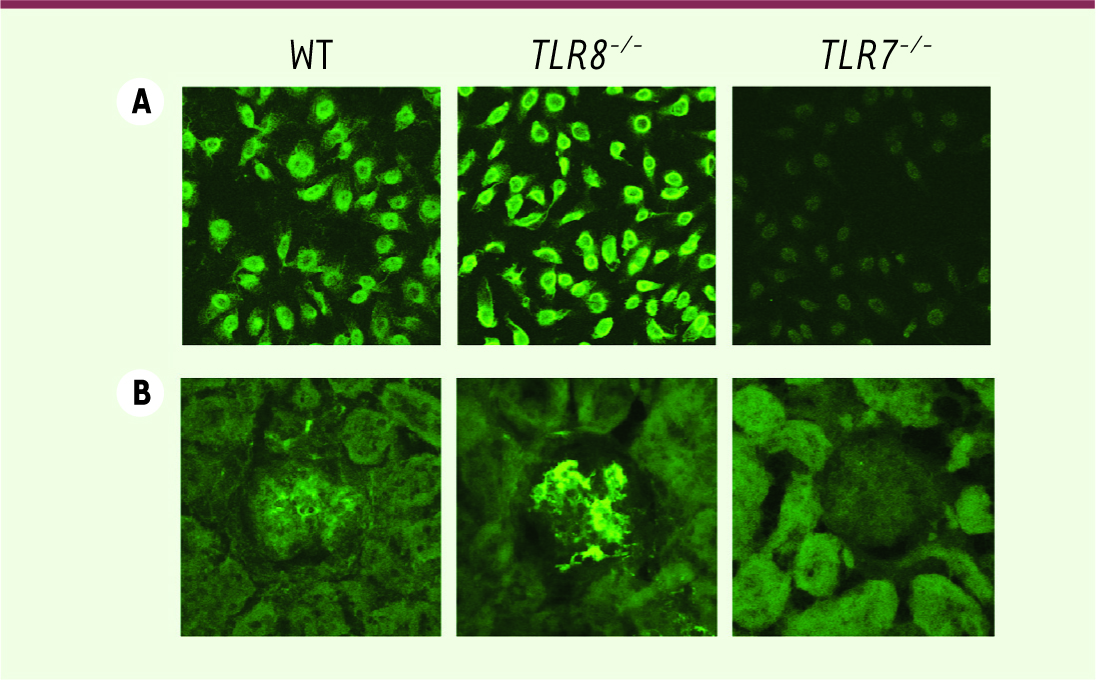
TLR8 contrôle le développement d’auto-immunité spontanée chez la souris. A. Le test ANA (antinuclear antibody test) révèle un taux d’autoanticorps excessif dans les sérums de souris TLR8
−/−
comparés aux souris sauvages, les souris TLR7
−/−
étant protégées. B. Visualisation de dépôts accrus d’immuno-complexes au niveau des glomérules du rein des souris TLR8
−/−
, absents chez les souris TLR7
−/−
. |
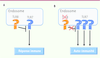 | Figure 3
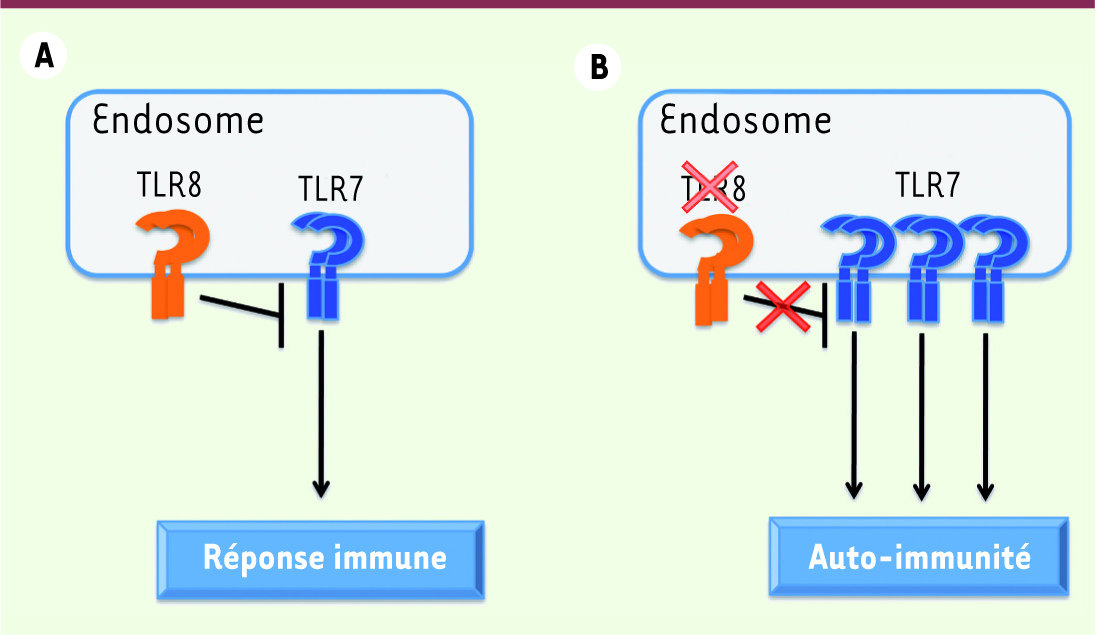
Conséquences de l’interaction entre TLR7 et TLR8. A. TLR8 contrôle la fonction et la signalisation de TLR7 pour établir une réponse immune efficace. B. Chez la souris, la déficience en TLR8 conduit au développement d’une auto-immunité en réponse à la dérégulation de l’expression de TLR7 et de ses voies de signalisation. |
Tableau I.
| TLR |
Ligand |
Position chromosomique |
|
TLR3
|
| Homme |
ARNdb |
Chr 4 ; 4q35 |
| Souris |
ARNdb |
Chr 8 ; 25,31 cM |
|
TLR7
|
| Homme |
ARNsb |
Chr X ; Xp22.3 |
| Souris |
ARNsb |
Chr X ; 78,31 cM |
|
TLR8
|
| Homme |
ARNsb |
Chr X ; Xp22 |
| Souris |
? |
Chr X ; 78,29 cM |
|
TLR9
|
| Homme |
ADN CpG |
Chr 3 ; 3p21.3 |
| Souris |
ADN CpG |
Chr 9 ; 57,46 cM |
Ligands et position chromosomique des TLR endosomaux. |
Tableau II.
| Cellules |
|
TLR7 |
TLR8 |
|
mCD
|
Homme |
+ |
+ |
| Souris |
+ |
+ |
|
pCD
|
Homme |
+++ |
− |
| Souris |
++ |
+ |
|
Monocytes
|
Homme |
++ |
+++ |
| Souris |
++ |
+++ |
|
NK
|
Homme |
+ |
+ |
| Souris |
+ |
+ |
|
B
|
Homme |
++ |
+ |
| Souris |
+ |
+ |
|
T
|
Homme |
+ |
+ |
| Souris |
+ |
+ |
Expression de TLR7 et TLR8 dans différents types cellulaires humains et murins. mCD : CD myéloïdes ; pCD : CD plasmacytoïdes ; NK : natural killer ; − : pas d’expression ; + : expression faible ; ++ : expression intermédiaire ; +++ : forte expression. |
Tableau III
| Cible des agonistes |
Nom |
Compagnie |
Indication |
Statut de l’essai |
| TLR8 |
VTX-1463 |
VantiRX Pharmaceuticals Inc. |
Rhinite allergique |
Phase I |
| TLR8 |
VTX-2337 |
VantiRX Pharmaceuticals Inc. |
Cancer |
Phase I |
| TLR7, TLR8 et TLR9 |
CPG 52364 |
Pfizer |
Lupus érythémateux disséminé |
Phase I |
| TLR7 et TLR8 |
Resiquimod |
3M Pharmaceuticals |
Hépatite C, herpès |
Suspendu en phase III |
| TLR7 et TLR8 |
IMO-4020 |
Idera Pharmaceuticals |
Lymphome |
Préclinique |
| TLR7, TLR8 et TLR9 |
Adjuvant vaccinal |
Idera Pharmaceuticals |
Maladies infectieuses, cancer, maladie d’Alzheimer |
Préclinique |
| TLR7 et TLR8 |
VTX-463 |
Array BioPharma |
Allergie |
Préclinique |
| TLR8 |
VTX-763 |
VantiRX Pharmaceuticals Inc. |
Inflammation auto-immune |
Préclinique |
| TLR7 et TLR8 |
IPH 3201 |
Innate Pharma |
Adjuvant vaccinal |
Préclinique |
Composés agonistes en cours de développement ciblant TLR8. |
Le rôle des récepteurs Toll dans l’immunité innée a été décrit pour la première fois chez la drosophile. Initialement, Toll a été identifié comme un récepteur transmembranaire nécessaire à l’établissement de la polarité dorso-ventrale au cours du développement de l’embryon [
6]. Son implication dans l’immunité antifongique a été établie quelques années plus tard quand B. Lemaitre a montré que la délétion de Toll ou de molécules en aval de sa voie de signalisation entraînait une surmortalité des mouches par un défaut de synthèse de peptides antimicrobiens [6]. Ces conclusions ont ensuite été renforcées par la découverte chez l’homme d’un récepteur homologue au Toll de la drosophile, connu aujourd’hui comme étant TLR4 [
7]. Les TLR sont des protéines transmembranaires de type I, avec un domaine extracellulaire composé de répétitions de motifs riches en leucine (LRR, leucine-rich repeats) assurant la reconnaissance, un domaine transmembranaire et un domaine intracellulaire globulaire présentant de fortes homologies avec la portion cytoplasmique du récepteur de l’interleukine (IL)-1 (TIR, Toll-IL-1 receptor) et nécessaire à la transduction du signal [6]. À ce jour, 10 TLR fonctionnels ont été identifiés chez l’homme et 12 chez la souris, les TLR 1 à 9 étant conservés dans les deux espèces. TLR10 murin est non fonctionnel en raison d’une insertion rétrovirale dans le gène correspondant alors que les gènes codant pour TLR11, TLR12 et TLR13 ont été perdus du génome humain. En réponse aux agents microbiens, à certaines cytokines et facteurs environnementaux, les TLR sont exprimés de manière dynamique par de nombreux types cellulaires aussi bien immunitaires (macrophages, cellules dendritiques, cellules B et certains sous-types de cellules T) que non immunitaires (fibroblastes et cellules épithéliales). Chaque TLR détecte des composants microbiens distincts provenant de bactéries, de virus, de champignons ou de parasites. TLR1, TLR2, TLR4, TLR5, TLR6 sont localisés à la surface cellulaire et reconnaissent principalement des composants de la membrane microbienne alors que TLR3, TLR7, TLR8 et TLR9 sont exprimés dans des vésicules intracellulaires et reconnaissent des acides nucléiques [2, 39] (Figure 1).
Un nombre croissant et convergeant de données montre que les TLR reconnaissent également des molécules endogènes libérées par les tissus lésés ou des cellules mortes, jouant ainsi un rôle important dans l’induction de l’inflammation en l’absence d’agent pathogène (inflammation stérile) [
8]. Ces voies de signalisation TLR activées par des ligands endogènes sont impliquées dans des conditions physiopathologiques telles que les maladies auto-immunes, la tumorigenèse ou des lésions tissulaires. Les ligands endogènes potentiels des TLR sont constitués de protéines et autres peptides, d’acides nucléiques, de polysaccharides et protéoglycanes ou encore de phospholipides [8]. Une fois leur ligand reconnu, les TLR recrutent une série de molécules adaptatrices contenant un domaine TIR, telles que MyD88, TRIF, TIRAP (toll-interleukin 1 receptor [TIR] domain containing adaptor protein) et TRAM (Trif-related adaptator molécule). Il en résulte l’activation des cascades de signalisation et la production de cytokines et de chimiokines [2,
3]. |
Les récepteurs Toll- like intracellulaires Les TLR intracellulaires sont tous impliqués dans la reconnaissance des acides nucléiques (Tableau I), et leur activation conduit à la production de cytokines pro-inflammatoires et d’interféron (IFN) de type I [2, 3]. TLR3 reconnaît les ARN double-brin (ARNdb) produits par de nombreux virus au cours de leur cycle réplicatif et un analogue synthétique d’ARNdb, l’acide polyinosinique-polycytidylique (poly(I:C)) [
9]. Chez la souris, TLR3 reconnaît de nombreux virus, notamment le virus West Nile [
40], le virus respiratoire syncytial, le virus influenza, le virus herpes simplex et le cytomégalovirus murin (MCMV) [2]. Chez l’homme, un allèle dominant négatif de TLR3 est associé à l’encéphalite provoquée par le virus de l’herpes simplex 1 (VHS-1) chez des enfants en bonne santé par ailleurs [
10]. Les gènes codant pour TLR7 et TLR8 présentent une forte homologie entre eux et tous deux sont localisés sur le chromosome X. Les TLR7 humain et murin, et TLR8 humain, initialement identifiés comme reconnaissant des dérivés imidazoquinoline, tels que le resiquimod et l’imiquimod, ou des analogues de guanine tels que la loxoribine, reconnaissent les ARN simple-brin (ARNsb) des virus à ARN [
11]. C’est ainsi que TLR7 reconnaît les ARNsb du virus de la stomatite vésiculaire (VSV), du virus influenza A ou encore du virus de l’immunodéficience humaine (VIH) [
12]. D’autre part, TLR7 est également capable de reconnaître les ARN bactériens, tels que ceux du streptocoque de groupe B [
13]. Enfin, bien que TLR7 et TLR8 soient exprimés chez la souris, TLR8 murin semble non fonctionnel puisque contrairement à des souris déficientes pour TLR7, des souris ou des cellules déficientes pour TLR8 répondent normalement aux imidazoquinolines et à l’ARNsb [11] ; ceci suggère l’existence de fonctions spécifiques d’espèce pour TLR8. Néanmoins, une étude récente a montré que l’inhibition par des siARN de l’expression de TLR8 dans des cellules dendritiques plasmacytoïdes murines abolit la production d’interféron de type I induite par le virus vaccinia dans ces cellules [
14]. Ces résultats ont cependant été contredits par une autre équipe [
15]. TLR9 reconnaît des motifs d’ADN non méthylés 2’-désoxyribo(cytidine-phosphate-guanosine) (CpG), qui sont fréquemment retrouvés chez les bactéries et les virus et beaucoup plus rarement dans les cellules de mammifères. L’administration d’ADN CpG synthétique protège les souris contre les infections par des agents pathogènes intracellulaires, tels que Leishmania major ou Listeria monocytogenes [
16,
17]. TLR9 joue également un rôle de senseur des infections par des virus à ADN, tels que le MCMV, VHS-1 ou VHS-2 [12]. Des ligands endogènes des TLR intracellulaires ont également été identifiés. Il s’agit des ARNm pour TLR3, des ARN et petits ARN interférents pour TLR7, de la myosine cardiaque humaine et de petits ARN interférents pour TLR8 et enfin de l’ADN et la protéine HMGB1 (high-mobility group protein B1) pour TLR9 [8]. Les ligands des TLR intracellulaires sont conceptuellement distincts de ceux des autres TLR, car ils sont présents aussi bien chez les agents pathogènes potentiels que chez l’hôte, ce qui pourrait résulter en une reconnaissance du soi. Ainsi, contrairement aux autres membres de la famille des TLR, la capacité à distinguer les acides nucléiques du soi et du non-soi n’est pas simplement fondée sur une reconnaissance moléculaire. En effet, la capacité à reconnaître les acides nucléiques est également couplée à une localisation et un système de régulation uniques [
18]. Les TLR intracellulaires ne sont localisés et ne signalent que dans les compartiments endolysosomaux. D’autre part, contrairement aux autres TLR, un pool de molécules réside dans le réticulum endoplasmique et leur sortie de ce dernier est contrôlée par Unc93B1 [
19]. Enfin, une fois dans le compartiment endolysosomal, l’activité des TLR est encore régulée puisqu’un certain nombre de travaux ont montré qu’ils sont pris en charge par des protéases résidentes afin de générer un récepteur fonctionnel [
20,
21]. |
Contribution de TLR8 au développement d’une auto-immunité chez la souris TLR8 murin protège du développement d’un lupus érythémateux disséminé Notre connaissance actuelle de la fonction de TLR8 est relativement limitée par rapport à celle des autres TLR endosomaux (TLR3, TLR7 et TLR9). Ceci s’explique en partie par le fait que la plupart des études ont porté sur le TLR8 humain, le TLR8 murin ayant longtemps été considéré comme non fonctionnel. Néanmoins, nous avons récemment montré un rôle important et jusqu’alors inconnu pour le TLR8 murin au cours du lupus érythémateux disséminé (LED) [
22]. Nous avons généré et étudié des souris déficientes pour TLR8 et des cellules dérivées de ces souris, et montré que la perte de TLR8 dans les cellules dendritiques (CD) murines s’accompagne d’une réponse excessive à de nombreux ligands TLR7, d’une activation plus rapide et soutenue de NF-κB en réponse à la surexpression de TLR7 [ 22]. De manière surprenante, ce phénotype est restreint aux cellules dendritiques puisque des macrophages ou des cellules B déficientes pour TLR8 répondent de manière normale à une stimulation TLR7, ce qui suggère que l’effet de TLR8 sur TLR7 est spécifique du type cellulaire. D’autre part, la déficience en TLR8 de souris de fonds génétique C57/BL6 conduit à un tableau associant : une splénomégalie, une diminution du nombre des cellules B de la zone marginale et des cellules B1, une auto-immunité systémique avec augmentation des anticorps anti-ADNdb et anti-Sm/RNP (ribonucléoprotéines) et un dépôt rénal glomérulaire d’IgM et d’IgG (Figure 2) [ 22]. Par ailleurs, les souris doublement déficientes pour TLR7 et TLR8 ne présentent aucun de ces phénotypes. Ainsi, le TLR8 murin joue un rôle central dans le développement du lupus en contrôlant l’activité de TLR7 (Figure 3). Nos données sont en accord avec de nombreuses études réalisées dans différents modèles murins de LED démontrant l’implication critique du TLR7 dans le développement d’auto-anticorps et de néphropathie lupique [
23]. Un mécanisme encore hypothétique Bien que le mécanisme précis d’inhibition de TLR7 par TLR8 n’ait pas été élucidé, nous pensons que TLR8 et TLR7 interagissent physiquement (directement ou indirectement) pour résulter en l’inhibition de TLR7. Pour être fonctionnels, les TLR se structurent en homodimères ou hétérodimères. L’interaction TLR7-TLR8 pourrait ainsi aboutir à la formation d’un dimère non fonctionnel parce qu’il est incapable de reconnaître son ligand l’ARNsb ou inapte à la signalisation. En effet, Wang et al. ont montré in vitro que les TLR8 humains et murins interagissent physiquement avec le TLR7 et induisent son inhibition [
24], suggérant ainsi que ce mécanisme de contrôle de TLR7 par TLR8 serait partagé entre les espèces. Le TLR8 humain étant fonctionnel, il semblerait aussi que le mécanisme d’inhibition de TLR8 sur TLR7 influence plutôt la capacité de l’hétérodimère à déclencher correctement la cascade de signalisation. Cependant, on ne peut exclure l’hypothèse d’une signalisation intrinsèque à TLR8 contrôlant TLR7. La découverte d’un ligand du TLR8 murin aidera à tester cette possibilité. Les TLR endosomaux sont retenus dans le réticulum endoplasmique et, suite à une activation de la cellule et grâce à des molécules chaperonnes, ils migrent vers les endosomes où ils acquièrent leur fonctionnalité. L’interaction physique entre les TLR7 et TLR8 murins a été observée dans des cellules dendritiques dans lesquelles TLR7 et TLR8 s’associent avec Unc93B1, une protéine membranaire du réticulum endoplasmique [
25] qui sert à leur transport vers les endosomes. Un autre mécanisme de régulation envisageable pourrait ainsi passer par une compétition entre TLR7 et TLR8 pour l’accès à UNC93B1 et leur export vers les endosomes, comme dans le cas de TLR7 et TLR9 [25]. |
TLR7 et TLR8 humains : profil d’expression et réponses cellulaires Chez l’homme, TLR7 et TLR8 sont exprimés par de nombreuses cellules immunitaires. TLR8 est exprimé par les monocytes, les cellules dendritiques myéloïdes et les lymphocytes B [
26] (Tableau II). TLR7 comme TLR8 reconnaissent des motifs ARNsb ainsi que certains composés synthétiques. Les agonistes de TLR8 sont plus efficaces que ceux de TLR7 dans l’induction de cytokines et de chimiokines pro-inflammatoires (TNFα [ tumor necrosis factor], IL-12 et MIP-1α [ macrophage inflammatory protein 1]) alors que les agonistes sélectifs de TLR7 induisent une plus forte expression d’IFN-α et de chimiokines régulées par l’IFN telles que I-TAC ( interferon-inducible T cell α-chemoattractant) et IP-10 ( interferon inducible protein 10) que les agonistes de TLR8 [
27]. Ainsi, chez l’homme, les agonistes TLR7 et TLR8 diffèrent à la fois en termes de cellules cibles et de profil d’induction de cytokines. Intérêt chez l’homme des agonistes des TLR7 et TLR8 pour leur rôle adjuvant L’intérêt scientifique et clinique de TLR8 et de TLR7 vient des composés d’imidazoquinolines. Ces modulateurs de la réponse immune de faibles poids moléculaire présentent une puissante activité antitumorale et antivirale et constituent en fait des agonistes de TLR7 et/ou TLR8 [ 3,
28,
29]. Le mode d’action antitumorale principal repose sur l’activation par TLR7/TLR8 du facteur de transcription NF-kB, conduisant à l’induction de cytokines pro-inflammatoires et autres médiateurs. L’imiquimod (Aldara, R-837, S-26308) est le composé d’imidazoquinoline le mieux caractérisé et le plus utilisé. Il active préférentiellement TLR7, alors que son activité agoniste de TLR8 semble plus faible. Par rapport à l’imiquimod, le resiquimod (R-848), qui agit à la fois sur TLR7 et TLR8, induit une plus forte sécrétion de cytokines, une plus forte activation des macrophages et une augmentation de l’immunité à médiation cellulaire. L’imiquimod est très efficace dans le traitement du carcinome de cellules basales, du carcinome intraépithélial, des verrues génitales externes, du sarcome de Kaposi, de la kératose actinique et de l’hépatite C chronique. D’autre part, l’application locale d’imiquimod induit la maturation fonctionnelle des cellules de Langerhans de l’épiderme et stimule leur migration vers les ganglions dans lesquels elles activent une réponse immune cellulaire antitumorale Th1. L’imiquimod active aussi d’autres types cellulaires tels que les cellules natural killer (NK), les macrophages et les lymphocytes B. Il est important de noter que des études in vitro réalisées avec différents types de cellules cancéreuses ont montré que l’imiquimod induit la surexpression du récepteur de l’ opioid growth factor (OGFr) et que via cet axe OGF-OGFr, il inhibe la prolifération cellulaire indépendamment des fonctions immunes et des TLR [
30]. À ce jour, l’expression et la fonction de TLR8 ont été impliquées dans de nombreuses maladies auto-immunes humaines, notamment dans les LED [
31,
32], l’arthrite rhumatoïde [
33] et la maladie inflammatoire de l’intestin [
34]. Son implication dans l’auto-immunité pourrait être directe puisqu’il intervient dans la reconnaissance des séquences ARN du soi [32] et de la myosine cardiaque [
35], ou indirecte puisque comme nous l’avons montré chez la souris, le TLR8 humain peut inhiber les voies de signalisation de TLR7 [22, 24]. Bien que TLR8 et TLR7 reconnaissent l’ARNsb viral et aient été associés à la réponse immune contre le VIH-1, une étude récente suggère que le VIH-1 active sélectivement TLR8, et pas TLR7, pour favoriser sa réplication [
36]. En effet, dans les cellules dendritiques, il active NF-κB via TLR8 pour initier la transcription du provirus intégré par l’ARN polymérase II. TLR8 pourrait alors constituer une cible pour prévenir l’infection et la dissémination du VIH-1 [36]. Ainsi, il y a aujourd’hui une forte demande pour le développement d’adjuvants servant à la fabrication de nouveaux vaccins utilisés en thérapie anticancéreuse ou dans la prévention de maladies infectieuses. Bien que différents agonistes synthétiques de TLR possèdent un potentiel d’adjuvant, peu d’entre eux ont été homologués pour un usage chez l’homme [
37]. De manière intéressante et en contraste marqué avec les faibles réponses induites par la plupart des agonistes de TLR chez les nouveau-nés, les agonistes de TLR8 sont particulièrement efficaces dans l’activation de réponses de costimulation par des cellules présentatrices d’antigène du nourrisson [
38]. Ces propriétés suggèrent que les agonistes de TLR8 peuvent remplir un rôle unique comme adjuvants potentiels pour induire une réponse immunitaire chez les nouveau-nés. Les connaissances du rôle et du fonctionnement des TLR ont permis un transfert vers des problématiques cliniques [37]. De ce fait, l’intérêt pour le développement de nouveaux agonistes ou antagonistes des TLR7 et TLR8 humains a augmenté de manière significative ces dernières années. En effet, ils ont le potentiel d’être utilisés dans le développement de vaccins plus efficaces pour la prévention et/ou le traitement des maladies auto-immunes, de cancers, de maladies infectieuses, inflammatoires ou allergiques. Le Tableau III résume les composés qui ciblent TLR8 et l’état actuel de leur développement. |
Le transfert des données concernant les réponses immunitaires induites par TLR8 entre les modèles murin et humain est compliqué pour deux raisons principales. Premièrement, le TLR8 murin n’est pas considéré comme fonctionnel et de plus il n’est pas activé par les agonistes connus tels que l’ARNsb ou les composés d’imidazoquinolines. Deuxièmement, il existe des différences d’expression de TLR7 et TLR8 entre l’homme et la souris. À titre d’exemple, les cellules dendritiques plasmacytoïdes, fortement productrices d’IFN de type I, expriment TLR7 et TLR8 chez la souris, alors que chez l’homme elles n’expriment que TLR7. Néanmoins, des études à la fois chez les souris et l’homme sont essentielles pour l’avancement de nos connaissances concernant la fonction et l’interaction des TLR7 et TLR8 ainsi que leur contribution à la réponse immunitaire, ce qui, à long terme est essentiel pour la conception de nouveaux médicaments efficaces et sûrs. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Medzhitov
R
. Approaching the asymptote: 20 years later . Immunity.
2009; ; 30 : :766.–775. 2.
Blasius
AL
,
Beutler
B
. Intracellular Toll-like receptors . Immunity.
2010; ; 32 : :305.–315. 3.
Kawai
T
,
Akira
S
. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity . Immunity.
2011; ; 34 : :637.–650. 4.
Delneste
Y
,
Beauvillain
C
,
Jeannin
P
. Immunité naturelle : structure et fonction des Toll-like receptors
. Med Sci (Paris).
2007; ; 23 : :67.–73. 5.
Chatenoud
L
. Immunité innée et immunité adaptative : un flirt bénéfique ?
Med Sci (Paris).
2002; ; 18 : :1183.–1184. 6.
Leulier
F
,
Lemaitre
B
. Toll-like receptors: taking an evolutionary approach . Nat Rev Genet.
2008; ; 9 : :165.–178. 7.
Medzhitov
R
,
Preston-Hurlburt
P
,
Janeway
CA
Jr
. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity . Nature.
1997; ; 388 : :394.–397. 8.
Yu
L
,
Wang
L
,
Chen
S
. Endogenous Toll-like receptor ligands and their biological significance . J Cell Mol Med.
2010; ; 14 : :2592.–2603. 9.
Alexopoulou
L
,
Holt
AC
,
Medzhitov
R
,
Flavell
RA
. Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3 . Nature.
2001; ; 413 : :732.–738. 10.
Zhang
SY
,
Jouanguy
E
,
Ugolini
S
, et al.
TLR3 deficiency in patients with herpes simplex encephalitis . Science.
2007; ; 317 : :1522.–1527. 11.
Heil
F
,
Hemmi
H
,
Hochrein
H
, et al.
Species-specific recognition of single-stranded RNA via toll-like receptor 7 and 8 . Science.
2004; ; 303 : :1526.–1529. 12.
Kawai
T
,
Akira
S
. Innate immune recognition of viral infection . Nat Immunol.
2006; ; 7 : :131.–137. 13.
Mancuso
G
,
Gambuzza
M
,
Midiri
A
, et al.
Bacterial recognition by TLR7 in the lysosomes of conventional dendritic cells . Nat Immunol.
2009; ; 10 : :587.–594. 14.
Martinez
J
,
Huang
X
,
Yang
Y
. Toll-like receptor 8-mediated activation of murine plasmacytoid dendritic cells by vaccinia viral DNA . Proc Natl Acad Sci USA.
2010; ; 107 : :6442.–6447. 15.
Bauer
S
,
Bathke
B
,
Lauterbach
H
, et al.
A major role for TLR8 in the recognition of vaccinia viral DNA by murine pDC?
Proc Natl Acad Sci USA.
2010; ; 107 : :E139.. 40.. 16.
Krieg
AM
,
Love-Homan
L
,
Yi
AK
,
Harty
JT
. CpG DNA induces sustained IL-12 expression in vivo and resistance to Listeria monocytogenes challenge . J Immunol.
1998; ; 161 : :2428.–2434. 17.
Zimmermann
S
,
Egeter
O
,
Hausmann
S
, et al. CpG oligodeoxynucleotides trigger protective and curative Th1 responses in lethal murine leishmaniasis . J Immunol.
1998; ; 160 : :3627.–3630. 18.
Barton
GM
,
Kagan
JC
,
Medzhitov
R
. Intracellular localization of Toll-like receptor 9 prevents recognition of self DNA but facilitates access to viral DNA . Nat Immunol.
2006; ; 7 : :49.–56. 19.
Tabeta
K
,
Hoebe
K
,
Janssen
EM
, et al.
The Unc93b1 mutation 3d disrupts exogenous antigen presentation and signaling via Toll-like receptors 3, 7 and 9 . Nat Immunol.
2006; ; 7 : :156.–164. 20.
Ewald
SE
,
Engel
A
,
Lee
J
, et al.
Nucleic acid recognition by Toll-like receptors is coupled to stepwise processing by cathepsins and asparagine endopeptidase . J Exp Med.
2011; ; 208 : :643.–651. 21.
Sepulveda
FE
,
Maschalidi
S
,
Colisson
R
, et al.
Critical role for asparagine endopeptidase in endocytic Toll-like receptor signaling in dendritic cells . Immunity.
2009; ; 31 : :737.–748. 22.
Demaria
O
,
Pagni
PP
,
Traub
S
, et al.
TLR8 deficiency leads to autoimmunity in mice . J Clin Invest.
2010; ; 120 : :3651.–3662. 23.
Richez
C
,
Blanco
P
,
Rifkin
I
, et al.
Role for Toll-like receptors in autoimmune disease: the example of systemic lupus erythematosus . Joint Bone Spine.
2011; ; 78 : :124.–130. 24.
Wang
J
,
Shao
Y
,
Bennett
TA
, et al.
The functional effects of physical interactions among Toll-like receptors 7, 8, and 9 . J Biol Chem.
2006; ; 281 : :37427.–37434. 25.
Fukui
R
,
Saitoh
S
,
Matsumoto
F
, et al.
Unc93B1 biases Toll-like receptor responses to nucleic acid in dendritic cells toward DNA- but against RNA-sensing . J Exp Med.
2009; ; 206 : :1339.–1350. 26.
Crozat
K
,
Vivier
E
,
Dalod
M
. Crosstalk between components of the innate immune system: promoting anti-microbial defenses and avoiding immunopathologies . Immunol Rev.
2009; ; 227 : :129.–149. 27.
Gorden
KB
,
Gorski
KS
,
Gibson
SJ
, et al.
Synthetic TLR agonists reveal functional differences between human TLR7 and TLR8 . J Immunol.
2005; ; 174 : :1259.–1268. 28.
Schon
MP
,
Schon
M
. TLR7 and TLR8 as targets in cancer therapy . Oncogene.
2008; ; 27 : :190.–199. 29.
Stanley
MA
. Imiquimod and the imidazoquinolones: mechanism of action and therapeutic potential . Clin Exp Dermatol.
2002; ; 27 : :571.–577. 30.
Zagon
IS
,
Donahue
RN
,
Rogosnitzky
M
,
McLaughlin
PJ
. Imiquimod upregulates the opioid growth factor receptor to inhibit cell proliferation independent of immune function . Exp Biol Med (Maywood).
2008; ; 233 : :968.–979. 31.
Krieg
AM
,
Vollmer
J
. Toll-like receptors 7, 8, and 9: linking innate immunity to autoimmunity . Immunol Rev.
2007; ; 220 : :251.–269. 32.
Vollmer
J
,
Tluk
S
,
Schmitz
C
, et al.
Immune stimulation mediated by autoantigen binding sites within small nuclear RNAs involves Toll-like receptors 7 and 8 . J Exp Med.
2005; ; 202 : :1575.–1585. 33.
Sacre
SM
,
Lo
A
,
Gregory
B
, et al.
Inhibitors of TLR8 reduce TNF production from human rheumatoid synovial membrane cultures . J Immunol.
2008; ; 181 : :8002.–8009. 34.
Saruta
M
,
Targan
SR
,
Mei
L
, et al.
High-frequency haplotypes in the X chromosome locus TLR8 are associated with both CD and UC in females . Inflamm Bowel Dis.
2009; ; 15 : :321.–327. 35.
Zhang
P
,
Cox
CJ
,
Alvarez
KM
,
Cunningham
MW
. Cutting edge: cardiac myosin activates innate immune responses through TLRs . J Immunol.
2009; ; 183 : :27.–31. 36.
Gringhuis
SI
,
van der Vlist
M
,
van den Berg
LM
, et al.
HIV-1 exploits innate signaling by TLR8 and DC-SIGN for productive infection of dendritic cells . Nat Immunol.
2010; ; 11 : :419.–426. 37.
Hennessy
EJ
,
Parker
AE
,
O’Neill
LA
. Targeting Toll-like receptors: emerging therapeutics?
Nat Rev Drug Discov.
2010; ; 9 : :293.–307. 38.
Levy
O
,
Suter
EE
,
Miller
RL
,
Wessels
MR
. Unique efficacy of Toll-like receptor 8 agonists in activating human neonatal antigen-presenting cells . Blood.
2006; ; 108 : :1284.–1290. 39.
Imler
JL
,
Ferrandon
D
. Le printemps de l’immunité innée couronné à Stockholm. Prix Nobel de médecine 2011 . Med Sci (Paris).
2011; ; 27 : :1019.–1024. 40.
Lanteri
MC
,
Diamond
MS
,
Norris
PJ
,
Busch
MP
. Infection par le virus West Nile chez l’homme. II. Aspects physiopathologiques et réponses immunitaires . Med Sci (Paris).
2011; ; 27 : :382.–386. |