| |
| Med Sci (Paris). 2012 February; 28(2): 133–135. Published online 2012 February 27. doi: 10.1051/medsci/2012282005.Protèger l’intégrité du réseau vasculaire coronaire Une stratégie efficace pour limiter le no-reflow et la taille de l’infarctus du myocarde Ariane Galaup1,2,3,4* and Stéphane Germain1,2,3,4,5** 1Collège de France, centre interdisciplinaire de recherche en biologie (CIRB), 11, place Marcelin Berthelot, Paris, F-75005, France 2CNRS UMR 7241, Paris, F-75005, France 3Inserm U 1050, Paris, F-75005, France 4MemoLife laboratoire d’excellence Paris Science Lettre, France 5AP-HP-hôpital Saint-Louis, laboratoire de pathologie, Paris, F-75010France MeSH keywords: Angiopoïétines, usage thérapeutique, Agents cardiovasculaires, Vaisseaux coronaires, effets des médicaments et des substances chimiques, anatomopathologie, ultrastructure, Cytoprotection, physiologie, Coeur, Humains, Infarctus du myocarde, thérapie, Lésion de reperfusion myocardique, prévention et contrôle, Myocarde, Protéines recombinantes, Résultat thérapeutique |
D’après l’OMS, les maladies cardiovasculaires demeurent la première cause de décès dans le monde. En 2008, 7,3 millions des 57 millions de personnes décédées ont succombé des suites d’une cardiopathie ischémique et 6,2 millions de celles d’un accident vasculaire cérébral ou d’une autre maladie cérébrovasculaire. En France, l’infarctus du myocarde (IDM) est responsable d’une morbidité importante et de 10 à 12 % de la totalité des décès. |
Le phénomène de no-reflow lors de la reperméabilisation d’une occlusion vasculaire L’IDM est une nécrose du muscle cardiaque consécutive à une ischémie due le plus souvent à une thrombose occlusive située au niveau d’une artère coronaire. Cette occlusion résulte dans la majorité des cas d’une fissuration ou d’une rupture d’une plaque d’athérome. Lorsque l’ischémie se prolonge au-delà de 30 min, la nécrose myocardique devient irréversible. La stratégie thérapeutique de choix dans l’IDM est la reperfusion coronaire, qui doit être la plus précoce possible, réalisée soit par thrombolyse intraveineuse, soit par angioplastie coronaire primaire. Si l’ischémie en aval de l’occlusion est la principale responsable des lésions, il ne faut pas négliger celles qu’entraîne la reperfusion qui suit l’intervention thérapeutique. En effet, la destruction du thrombus génère des débris qui peuvent occlure la microcirculation coronaire. De plus, la reperfusion induit un stress oxydatif, une inflammation et une altération de l’intégrité vasculaire responsables de dégâts cellulaires. Tous ces phénomènes participent au phénomène de non-reperfusion (no-reflow) qui survient dans 20 à 40 % des cas et qui est associé à un mauvais pronostic clinique ainsi qu’à une mortalité accrue à 5 ans (pour revue [1–3]). L’étiologie du no reflow est complexe et multifactorielle, mais une de ses caractéristiques est le développement d’un œdème compressif consécutif à l’augmentation de la perméabilité capillaire et aux lésions vasculaires. L’expression de nombreux facteurs de croissance, dont le VEGF (vascular endothelial growth factor), est induite par l’hypoxie au cours de l’IDM. En plus de son effet proangiogénique que l’on pense bénéfique à long terme, le VEGF, initialement baptisé VPF (vascular permeability factor), possède un effet délétère via l’augmentation de la perméabilité vasculaire dans les premières heures post-ischémie. La détérioration de l’intégrité vasculaire contribue aux dégâts vasculaires, aux hémorragies, à l’œdème, à l’inflammation, qui, tous, participent au no reflow. Il n’existe à ce jour aucun traitement pharmacologique du no-reflow. Disposer d’un antagoniste du VEGF spécifiquement actif sur la phase précoce (bloquant l’effet properméabilisation) pourrait vraisemblablement permettre de limiter ce phénomène et ainsi améliorer la reperfusion du tissu cardiaque ischémié. Une autre stratégie consiste à identifier des modulateurs de la perméabilité vasculaire qui pourraient s’opposer aux effets précoces du VEGF. À ce titre, l’angiopoïétine-like 4 (ANGPTL4), dont l’expression est induite par l’hypoxie au cours des pathologies ischémiques [4, 5], est un candidat intéressant dont les propriétés ont récemment été mises en évidence dans des modèles précliniques d’ischémie-reperfusion myocardique. |
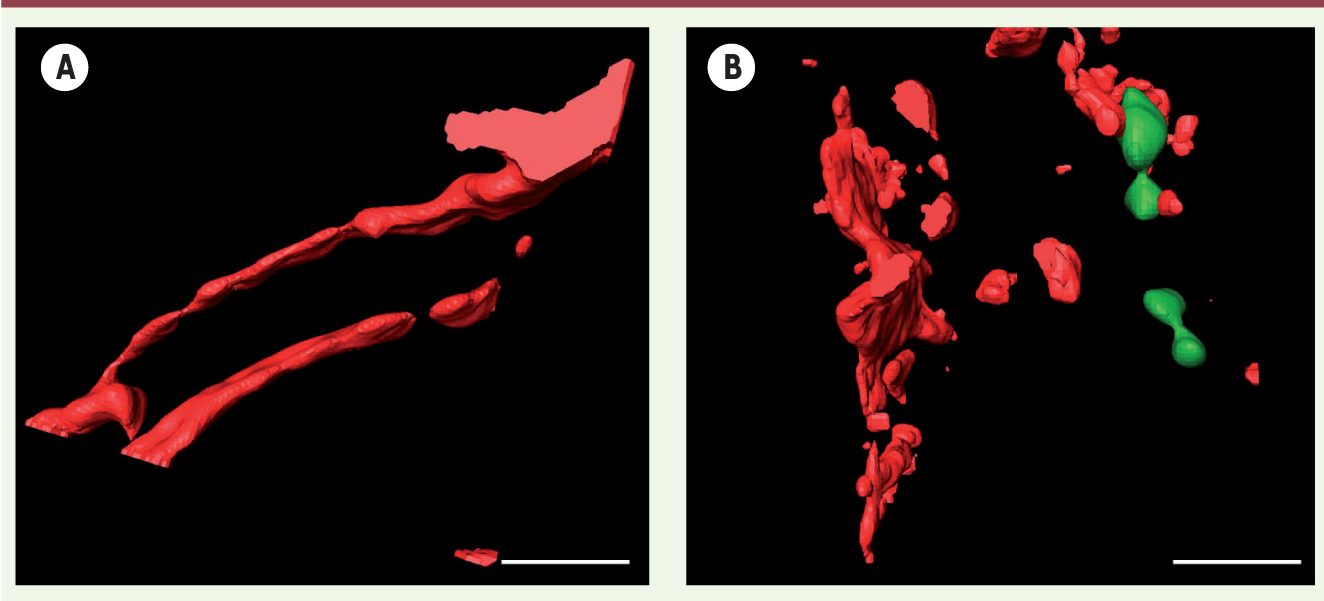
Modulation des effets délétères de l’ischémie-reperfusion par ANGPTL4 Afin d’évaluer les propriétés de modulation de la perméabilité vasculaire par ANGPTL4 au cours de l’infarctus du myocarde, nous avons soumis des souris contrôles et des souris dont le gène angptl4 a été invalidé, à un protocole d’ischémie-reperfusion myocardique [6]. Une augmentation de l’extravasation plasmatique est observée chez les souris invalidées pour angptl4 en comparaison aux souris contrôles. Elle est corrélée à une désorganisation des jonctions adhérentes endothéliales objectivée par la distribution de la VE-cadhérine (composant majeur de ces jonctions adhérentes endothéliales) identifiée par marquage immunohistochimique. Cette perte de l’intégrité vasculaire est très précoce puisqu’elle est observée dès quatre heures après la reperfusion (Figure 1). Sur le plan mécanistique, nous montrons que cette perméabilité vasculaire est provoquée par la dissociation accrue du complexe formé par le récepteur du VEGF (VEGFR2) et la VE-cadhérine à la surface des cellules endothéliales. Il s’ensuit une amplification de la voie de signalisation de la kinase Src chez les souris déficientes pour angptl4 par rapport aux souris contrôles [6].
 | Figure 1. Analyse de l’intégrité vasculaire cardiaque après ischémie-reperfusion. Reconstruction en trois dimensions d’images de microscopie confocale sur cryocoupes de cœur après révélation de la VE-cadhérine (rouge) par immunomarquage. Ces coupes ont été obtenues à partir de souris contrôle (A) ou invalidée pour angptl4 (B) et soumises à une ischémie (45 min)-reperfusion (4 h) puis perfusées avec des billes fluorescentes (vert) permettant l’observation et l’analyse du phénomène de perte d’intégrité vasculaire et d’extravasation (barre d’échelle = 20 μm). |
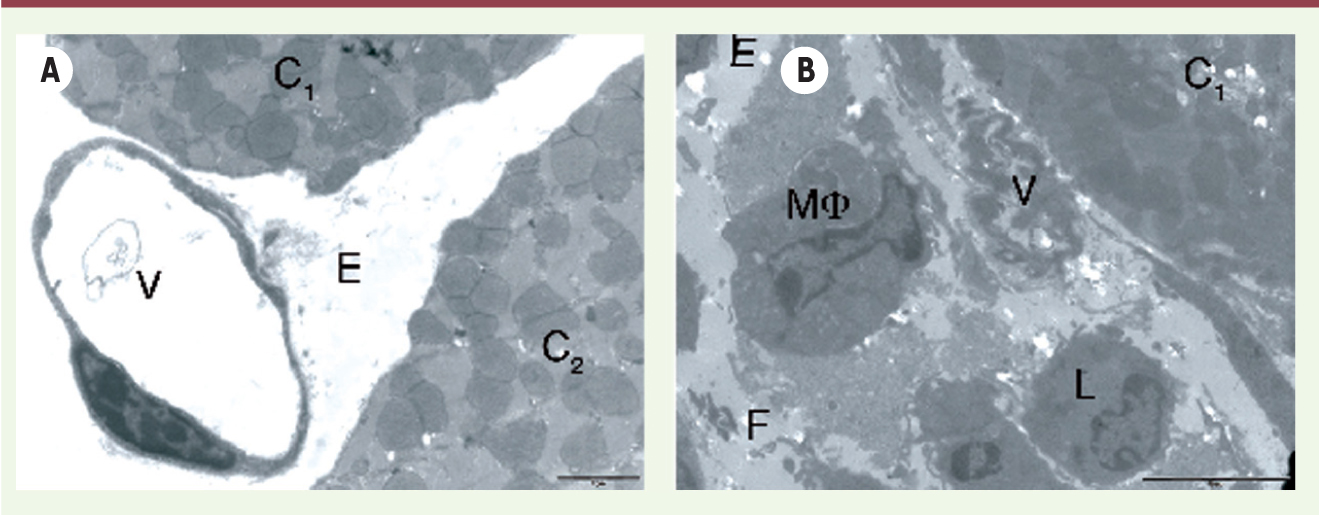
Cette perméabilité vasculaire massive se traduit par une augmentation de la taille de l’aire infarcie et l’importance du no-reflow chez les souris invalidées pour angptl4. La nécrose, une suffusion hémorragique et un infiltrat inflammatoire plus importants sont observés chez ces souris. Au niveau ultrastructural, l’œdème est à la fois plus étendu et plus riche en débris cellulaires et en cellules immunitaires (Figure 2).
 | Figure 2. Étude ultrastructurale du tissu cardiaque après ischémie-reperfusion. Images en microscopie électronique à transmission réalisées sur des coupes de cœur de souris contrôle (A) ou invalidée pour angptl4 (B) soumises à une ischémie (45 min)-reperfusion (48 h). Observation de la zone infarcie montrant des cardiomyocytes (C), des vaisseaux sanguins (V), de l’œdème (E), des dépôts de fibrinogène (F), des macrophages (Mφ) et des lymphocytes (L). Barre d’échelle : 2 mm pour la souris contrôle et 5 μm pour la souris invalidée pour l’angptl4. |
A contrario, les études in vitro réalisées sur des cardiomyocytes isolés de souris contrôles ou invalidées pour angptl4 semblent montrer qu’ANGPTL4 n’agit pas directement sur ces cellules. De même, l’angiogenèse réactionnelle est identique en présence ou en absence d’ANGPTL4. |
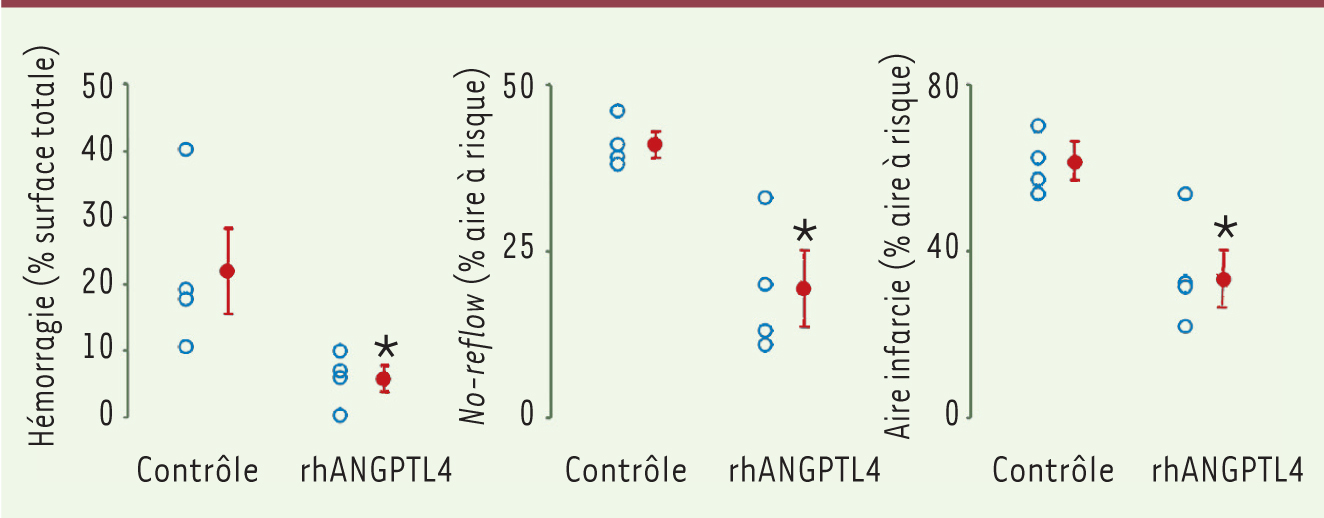
Potentiel thérapeutique de la protéine recombinante humaine ANGPTL4 au cours de l’ischémie-reperfusion La perte d’intégrité vasculaire et une taille d’infarctus augmentée chez les souris déficientes pour angptl4 nous ont incités à évaluer l’efficacité de la protéine ANGPTL4 recombinante dont la forme humaine est produite et purifiée au laboratoire (rhANGPTL4). De fait, la protéine recombinante humaine inhibe le phénomène de no-reflow et réduit la taille de l’infarctus, chez les souris invalidées pour angptl4 soumises à un processus d’ischémie-reperfusion [6]. Le mécanisme d’action a été décrypté in vitro sur des cellules endothéliales primaires : rhANGPTL4 bloque les effets du VEGF en inhibant la signalisation de la kinase Src en aval du VEGFR2 et la dissociation du complexe VEGFR2/VE-cadhérine, ce qui aboutit à la stabilisation des jonctions adhérentes. Le potentiel thérapeutique de la protéine recombinante a été testé et confirmé chez une seconde espèce (non rongeur). L’intégrité vasculaire de lapins traités par rhANGPTL4 et soumis à une ischémiereperfusion est mieux conservée que celle des lapins contrôles, ce dont témoigne une diminution de la suffusion hémorragique. La préservation de l’intégrité de l’endothélium permet une meilleure reperfusion coronarienne avec une diminution du phénomène de no-reflow. Enfin, cet effet protecteur se traduit également par une réduction de la taille de l’infarctus chez les lapins traités par rhANGPTL4 (Figure 3).
 | Figure 3. Modulation de la taille de l’infarctus par l’ANGPTL4. Quantification de la zone hémorragique (gauche), du no-reflow (milieu) et de la taille de l’infarctus (droite) chez des lapins contrôles ou injectés avec rhANGPTL4 (10 µg/kg) soumis à une ischémie (30 min)-reperfusion (4 h). L’astérisque indique une différence statistique significative. |
|
Conclusion et perspectives Ce travail démontre que la préservation de l’intégrité vasculaire au cours de l’ischémie-reperfusion induit une cardioprotection secondaire en limitant les effets délétères provoqués par la reperfusion : inflammation, œdème, hémorragie, phénomène de no-reflow et augmentation de la taille de l’infarctus. Dans ce contexte, nous avons montré qu’ANGPTL4 agit en inhibant la voie d’activation de la kinase Src et en stabilisant le complexe VEGFR2/VE-cadhérine dans les cellules endothéliales, et s’oppose donc aux effets properméabilisants du VEGF. Ceci suggère qu’une stratégie thérapeutique fondée sur l’utilisation de l’ANGPTL4, seule ou combinée à une thrombolyse intraveineuse ou à une angioplastie coronaire primaire, pourrait représenter une approche pharmacologique et thérapeutique dans le traitement de l’infarctus du myocarde chez l’homme. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Ce travail a fait l’objet d’un soutien de l’Agence nationale de la recherche (ANR-06-JCJC-0160), la Fondation de France (R09045JJ-FDF, la fédération française de cardiologie, la Fondation pour la recherche médicale et la Ligue nationale contre le cancer.
|
2. Mercadier JJ, Gaertner R, Logeart D, Michel JB. Remodelage précoce du ventricule gauche après un accident coronarien aigu . Med Sci (Paris). 2004; ; 20 : :643.–650. 3. Niccoli G, Burzotta F, Galiuto L, Crea F. Myocardial no-reflow in humans . J Am Coll Cardiol. 2009; ; 54 : :281.–292. 4. Le Jan S, Amy C, Cazes A, et al. Angiopoietin-like 4 is a proangiogenic factor produced during ischemia and in conventional renal cell carcinoma . Am J Pathol. 2003; ; 162 : :1521.–1528. 5. Cazes A, Galaup A, Chomel C, et al. Extracellular matrix-bound angiopoietin-like 4 inhibits endothelial cell adhesion, migration, and sprouting and alters actin cytoskeleton . Circ Res. 2006; ; 99 : :1207.–1215. 6. Galaup A, Gomez E, Souktani R, et al. Protection against myocardial infarction and no-reflow through preservation of vascular integrity by angiopoietin-like 4 . Circulation. 2012; ; 125 : :140.–149. |