| |
| Med Sci (Paris). 2012 February; 28(2): 141–143. Published online 2012 February 27. doi: 10.1051/medsci/2012282008.Traitement de la détresse respiratoire des prématurés Un agoniste de la voie de signalisation hedgehog prévient les effets néfastes des glucocorticoïdes Amélie Griveau1,2* 1Department of Pediatrics, Division of Neonatology, University of California San Francisco, San Francisco, CA94143, États-Unis 2Howard Hughes Medical Institute, Eli and Edythe Broad Institute for Stem Cell Research and Regeneration Medicine, University of California San Francisco, San Francisco, 35 Medical Center Way - RMB 932D, CA94143, États-Unis MeSH keywords: Animaux, Cervelet, effets des médicaments et des substances chimiques, croissance et développement, Cytoprotection, Synergie des médicaments, Effets secondaires indésirables des médicaments, prévention et contrôle, Glucocorticoïdes, effets indésirables, usage thérapeutique, Protéines Hedgehog, agonistes, métabolisme, physiologie, Humains, Nouveau-né, Souris, Modèles biologiques, Récepteurs couplés aux protéines G, Syndrome de détresse respiratoire du nouveau-né, traitement médicamenteux, Transduction du signal, Récepteur Smoothened |
Administration des glucocorticoïdes chez les prématurés : bénéfice et risques Les glucocorticoïdes (GC) sont des hormones stéroïdes sécrétées en faible quantité par la glande surrénale. Une modification de leur taux peut conduire à des altérations importantes du développement et de la maturation de certains organes tels que les poumons ou le cerveau. Divers GC synthétiques comme la dexaméthasone, la prednisolone, la b-méthasone ou encore l’hydrocortisone, ont été développés et administrés en période anté- ou postnatale afin de prévenir ou de traiter le risque de détresse respiratoire ainsi que d’autres complications souvent rencontrées chez les prématurés [1,10]. Les pathologies pulmonaires sont principalement liées à un défaut de production des protéines du surfactant : cet « enduit alvéolaire » de composition complexe, très riche en phospholipides, empêche les alvéoles de se collaber lors de l’expiration, grâce à ses propriétés tensioactives. L’administration de GC aux femmes à risque ou aux enfants prématurés permet, entre autres, de réduire l’inflammation et de stimuler la synthèse des protéines du surfactant par les pneumocytes de type II. Malgré ces effets bénéfiques, de plus en plus d’études indiquent que l’administration périnatale de GC à des doses supraphysiologiques entraîne des déficits cognitifs ou moteurs à long terme liés à une augmentation de l’incidence des lésions de la substance blanche et de l’infirmité motrice cérébrale, ou encore à des défauts de développement du cervelet [2–4, 10]. |
Antagonisme entre les glucocorticoïdes et la voie Shh pour la croissance du cervelet Le cervelet est impliqué dans la coordination motrice et le relais d’informations vers le cortex cérébral chez l’adulte. Cette structure grossit considérablement pendant la période périnatale via l’expansion des précurseurs des neurones granulaires cérébelleux (PNGC), induite par la voie de signalisation hedgehog [5]. Sonic hedgehog (Shh), une protéine sécrétée par les cellules de Purkinje, en se fixant sur son récepteur transmembranaire Patched (Ptch) présent au niveau des PNGC, entraîne la dérépression de Smoothened (Smo). Il en résulte une activation de la cascade de signalisation intracellulaire, dont en particulier Gli1, une protéine impliquée dans la régulation de gènes codant pour des protéines stimulant la prolifération comme N-myc ou la cycline D (Figure 1A).
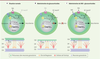 | Figure 1. Contrôle de la prolifération des précurseurs des neurones granulaires cérébelleux. Représentation schématique du mécanisme de prolifération des précurseurs des neurones granulaires cérébelleux en situation normale (A), en présence d’un excès de GC (B) ou en cas d’administration de SAG + GC (C) lors du développement du cervelet. CGE, couche granulaire externe ; CGI, couche granulaire interne ; CM, couche moléculaire ; CCP, couche des cellules de Purkinje ; GC, glucocorticoïde ; Ptch, Patched ; Shh, Sonic hedgehog ; Smo, Smoothened. |
En revanche, l’administration des GC en période néonatale entraîne une réduction de la taille du cervelet, par l’inhibition de la prolifération des PNGC et l’augmentation de la mort cellulaire. Les travaux réalisés par Vivi Heine dans le laboratoire de David Rowitch ont montré qu’il existe une action antagoniste entre les glucocorticoïdes et la voie de signalisation hedgehog sur la prolifération des PNGC [6]. Les GC inactifs se fixent sur leurs récepteurs présents au niveau des PNGC. Leur conversion en GC actifs par l’enzyme 11β-hydroxystéroïde déshydrogénase (11βHSD) de type 1 conduit à une réduction de la concentration de la cycline D et de N-myc, dont l’expression est contrôlée par Gli1 (Figure 1B). Au contraire, la fixation de Shh sur Ptch induit la production de l’enzyme 11βHSD2, qui, elle, est responsable de l’inactivation de certains GC comme l’hydrocortisone ou la prednisolone, et permet donc la prolifération normale des PNGC et la croissance du cervelet (Figure 1A). La mise en évidence de cette dualité entre les GC et la voie hedgehog a en réalité suggéré de nouvelles stratégies de recherche de molécules pouvant concilier les effets bénéfiques sur le développement des poumons sans induire de malformations du cervelet [7]. |
Agoniste synthétique de Smoothened, un protecteur de l’effet néfaste des GC Dans cette optique, dans une récente étude réalisée dans le laboratoire du Dr David Rowitch, nous nous sommes intéressés à l’effet de l’administration d’un agoniste synthétique de Smoothened (SAG) sur le développement du cervelet, en présence ou en l’absence des GC [8]. Nous avons d’abord cultivé des PNGC de souris en présence de Shh ou de SAG avec ou sans ajout de GC : l’administration de SAG entraîne la prolifération des PNGC même en présence des GC. SAG induit une activation robuste de la voie de signalisation hedgehog, contrebalançant ainsi l’action néfaste des GC sur la prolifération des PNGC, et ce de manière plus efficace que Shh. Nous avons ensuite utilisé une lignée de souris permettant de visualiser l’activation de Gli1 après l’injection intrapéritonéale de SAG. Nos résultats montrent que SAG est capable de traverser la barrière hémato-encéphalique pour activer les gènes cibles de la voie de signalisation hedgehog au niveau du cervelet in vivo. Afin d’étudier les possibles effets toxiques de SAG, nous avons administré aux souris deux différentes doses de SAG (une dose « thérapeutique » et une dose forte) pendant la première semaine de vie postnatale qui correspond à la période de traitement des prématurés par les GC. La molécule est bien tolérée par les animaux en période néonatale. L’analyse des animaux à long terme n’a révélé aucune anomalie motrice ni comportementale, et le développement du cerveau, du cervelet ou encore des viscères, s’est déroulé normalement. Compte tenu de l’activation de la voie de signalisation hedgehog lors de la formation de nombreux cancers et en particulier du médulloblastome, un cancer du cervelet [9], nous nous sommes assurés de l’absence de formation de médulloblastome ou d’autres tumeurs, même après administration de fortes doses de SAG. Comme nous l’avons mentionné précédemment, les prématurés souffrent fréquemment d’un syndrome de détresse respiratoire par défaut de production des protéines du surfactant, et les GC sont très efficaces pour contrer ces défauts de maturation pulmonaire. Nous nous sommes assurés que SAG n’interfère pas avec la maturation des poumons. De fait, l’administration transitoire de SAG en présence ou en l’absence de GC n’entraîne pas de modification de la production des protéines du surfactant et aucun signe d’insuffisance respiratoire n’a été observé chez les nouveau-nés, ni chez les adultes. Finalement, nous avons essayé de déterminer si SAG pouvait avoir un effet bénéfique sur les anomalies de développement du cervelet et la diminution de la prolifération des PNGC qui interviennent en présence de GC in vivo [6]. L’administration transitoire de SAG seul chez les nouveau-nés n’induit pas d’augmentation de la prolifération des PNGC, mais en revanche, l’administration de SAG et de prednisolone prévient l’inhibition de prolifération cellulaire dans la couche granulaire externe qui comprend les PNGC, et préserve la taille de cette couche et du cervelet en général (Figure 1C). L’administration transitoire de SAG pendant la période néonatale est donc suffisante pour abolir les effets néfastes causés par les GC sur le développement du cervelet. |
En conclusion, cette étude montre que l’utilisation de l’agoniste synthétique SAG protège contre l’effet délétère des glucocorticoïdes sur le développement du cervelet, sans entraîner pour autant la formation de tumeur ; il ne semble pas interférer avec les effets bénéfiques des glucocorticoïdes sur le développement pulmonaire. Avant d’envisager des études précliniques chez d’autres espèces animales et des essais cliniques chez l’homme, il sera nécessaire de déterminer la dose optimale de SAG et la période optimale de traitement, et de poursuivre l’analyse de toxicité. Finalement, l’administration de cette molécule pourrait aussi se révéler efficace contre d’autres défauts de développement du cervelet observés chez les prématurés n’ayant reçu aucun traitement stéroïde. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
L’auteur remercie Michel Seigneuret pour sa relecture du manuscrit.
|
1. Gupta S, Prasanth K, Chen CM, Yeh TF. Postnatal corticosteroids for prevention, treatment of chronic lung disease in the preterm newborn . Int J Pediatr. 2012; ; 2012 : :315642.. 2. Baud O. Postnatal steroid treatment and brain development . Arch Dis Child Fetal Neonatal Ed. 2004; ; 89 : :F96.–F100. 3. Tam EW, Chau V, Ferriero DM, et al. Preterm cerebellar growth impairment after postnatal exposure to glucocorticoids . Sci Transl Med. 2011; ; 3 : :105ra105.. 4. Volpe JJ. Cerebellum of the premature infant: rapidly developing, vulnerable, clinically important . J Child Neurol. 2009; ; 24 : :1085.–1104. 5. Wechsler-Reya RJ, Scott MP. Control of neuronal precursor proliferation in the cerebellum by Sonic Hedgehog . Neuron. 1999; ; 22 : :103.–114. 6. Heine VM, Rowitch DH. Hedgehog signaling has a protective effect in glucocorticoid-induced mouse neonatal brain injury through an 11betaHSD2-dependent mechanism . J Clin Invest. 2009; ; 119 : :267.–277. 7. Olivier Baud O, Gressens P. Hedgehog rushes to the rescue of the developing cerebellum . Sci Transl Med. 2011; ; 3 : :105ps40.. 8. Heine VM, Griveau A, Chapin C, et al. A small-molecule smoothened agonist prevents glucocorticoid-induced neonatal cerebellar injury . Sci Transl Med. 2011; ; 3 : :105ra104.. 9. Dubuc AM, Northcott PA, Mack S, et al. The genetics of pediatric brain tumors . Curr Neurol Neurosci Rep. 2010; ; 10 : :215.–223. 10. Baud O, Gressens P. Voie de signalisation Sonic Hedgehog et impact des glucocorticoïdes sur le cerveau en développement . Med Sci (Paris). 2009; ; 25 : :713.–717. |