| |
| Med Sci (Paris). 2012 February; 28(2): 193–199. Published online 2012 February 27. doi: 10.1051/medsci/2012282018.Thérapie spécifique d’allèle Suppression de mutations non-sens par des inducteurs de « translecture » Célia Floquet,1,2 Jean-Pierre Rousset,1,2 and Laure Bidou1,2,3* 1Université Paris-Sud, institut de génétique et microbiologie, UMR8621, F-91405Orsay, France 2CNRS, F-91405Orsay, France 3UPMC-université Paris VI, France |
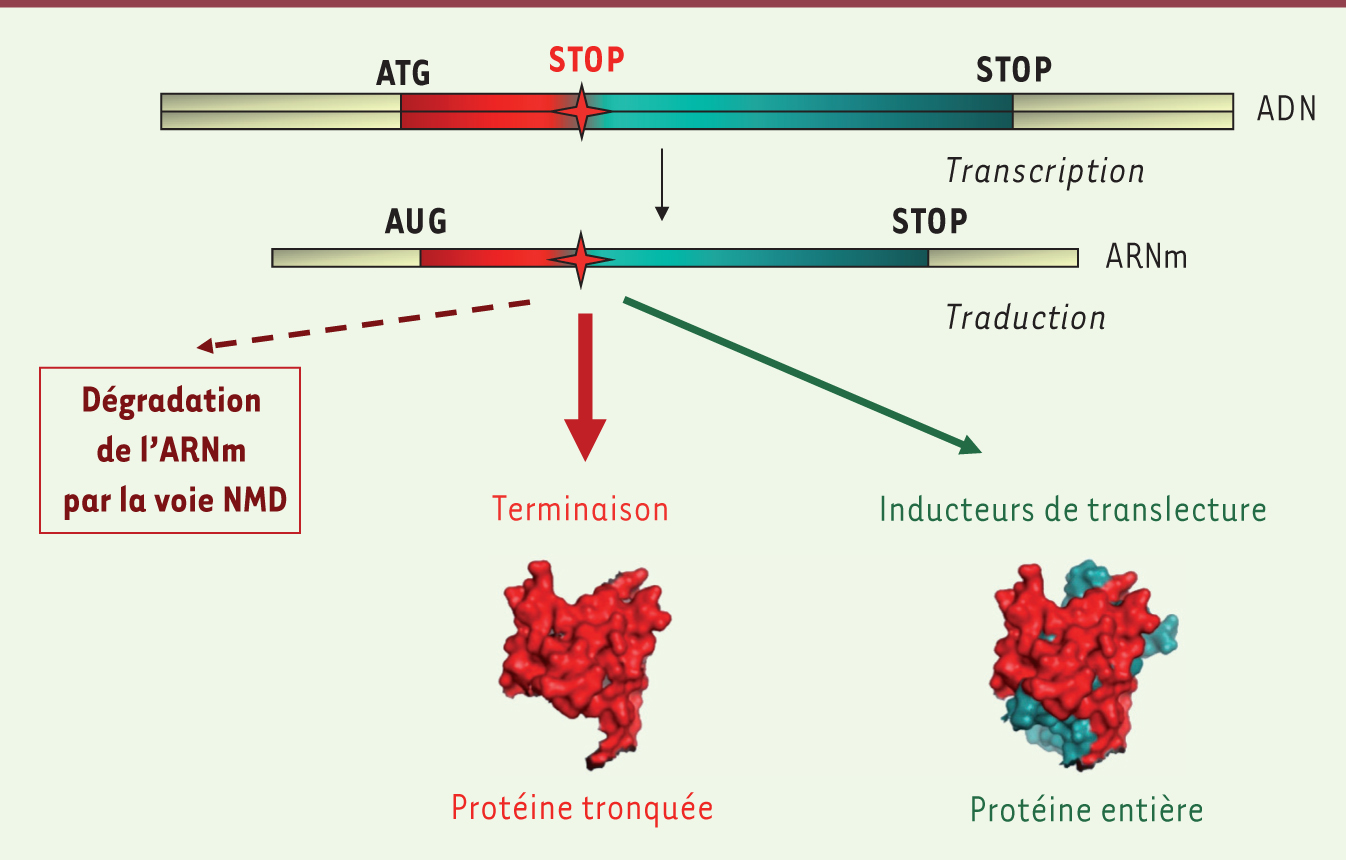
Une mutation non-sens introduit un codon stop (TAA, TAG ou TGA) en phase dans une séquence génique, qui conduit à l’arrêt prématuré de la synthèse protéique. Ce type de mutation a deux conséquences : la production d’une protéine tronquée qui ne parvient plus à assurer sa fonction normale et, éventuellement, la dégradation de l’ARNm par la voie nonsense mediated mRNA decay (NMD) [1, 44]. Les mutations non-sens représentent 10 % des mutations impliquées dans les maladies génétiques [2]. Depuis une dizaine d’années, l’utilisation de molécules favorisant l’entrée d’un ARNt au niveau du codon stop prématuré lors de la traduction (événement appelé translecture) est envisagée comme une nouvelle stratégie thérapeutique (Figure 1). L’utilisation de telles molécules a pour objectif de réexprimer une protéine entière et fonctionnelle à partir d’un gène interrompu par un codon stop, sans modifier la séquence génique (pour revue voir [3, 4]). La mise en place de cette stratégie thérapeutique concerne uniquement les mutations non-sens et nécessite donc de déterminer au préalable la nature de la mutation.
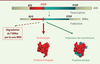 | Figure 1. Stratégie thérapeutique dans les maladies à codons stop. Une mutation non-sens dans un gène (ADN) fait apparaître un codon stop prématuré sur l’ARNm qui sera traduit par le ribosome. Ceci conduit à la synthèse d’une protéine tronquée et potentiellement à la dégradation de cet ARNm par la voie NMD (nonsense mediated mRNA decay) qui reconnaît spécifiquement les ARNm contenant un codon stop prématuré. Certaines molécules, en induisant le passage du codon stop prématuré (événement appelé translecture), permettent la synthèse d’une fraction de protéine entière, ce qui pourrait apporter un bénéfice thérapeutique pour les patients possédant une mutation non-sens. |
Le succès de cette stratégie dépend des spécificités physiopathologiques inhérentes à chaque maladie et de paramètres liés à la mutation non-sens mise en jeu : (1) le taux de translecture de la mutation non-sens qui varie, d’une part selon l’inducteur de translecture utilisé et, d’autre part, selon la nature du codon stop et de son contexte nucléotidique; (2) la stabilité de l’ARNm mutant qui est potentiellement dégradé par la voie NMD; (3) la nature de l’acide aminé incorporé au niveau du codon stop prématuré qui est déterminante pour la fonctionnalité de la protéine. |
Pertinence de l’approche thérapeutique en fonction des différentes maladies dues à une mutations non-sens Dans les années 1980, les antibiotiques de la famille des aminoglycosides (gentamicine, amikacine, G418, etc.) sont les premières molécules pour lesquelles un effet sur la translecture a été mis en évidence sur le ribosome de mammifère [5]. Il faudra ensuite attendre 1996 pour que les aminoglycosides soient utilisés dans le cadre de maladies dues à une mutation non-sens. Une des premières maladies pour laquelle l’effet de cette stratégie a été examiné est la mucoviscidose. C’est une maladie autosomique récessive causée par un dysfonctionnement dans le transport des ions sodium et chlorure résultant de l’inactivation de la protéine transmembranaire CFTR (cystic fibrosis transmembrane conductance regulator). Dans 10 % des cas, ce dysfonctionnement est dû à une mutation non-sens. L’effet du G418 et de la gentamicine a d’abord été testé dans des lignées de cellules humaines [6, 7], puis chez une souris modèle cftr−/− possédant l’ADNc muté humain CFTR G542X (qui résulte en un changement d’un codon glycine en codon stop à la position 542 de la séquence protéique). Ces études ont montré qu’il était possible d’induire la réexpression partielle de la protéine CFTR entière et fonctionnelle [8]. Les essais cliniques réalisés ont abouti à des résultats variables : la réexpression de la protéine entière n’est détectable que chez certains patients [9–11]. Plus récemment, une étude a mis en évidence que le traitement par la gentamicine permettait la réexpression d’une protéine fonctionnelle et une amélioration clinique significative chez des patients possédant la mutation Y122X dans le gène CFTR [12]. Cette mutation non-sens, testée in cellulo grâce à un système rapporteur, présentait le taux de translecture le plus important parmi les mutations testées dans cette étude. La deuxième maladie étudiée dans le cadre du développement de cette approche thérapeutique est la myopathie de Duchenne (DMD). C’est une maladie récessive liée au chromosome X qui aboutit à une perte de la fonction motrice associée à une atteinte cardiaque et respiratoire. Le gène muté est celui qui code la dystrophine, une protéine structurale du muscle. Chez 8 % des patients, cette mutation est une mutation non-sens. La souris mdx est le modèle de prédilection pour la myopathie de Duchenne. Elle possède un codon stop prématuré TAA (Q993X) apparu spontanément dans l’homologue murin du gène codant la dystrophine. Cette souris a apporté la première validation in vivo de la faisabilité d’utiliser des inducteurs de translecture dans un but thérapeutique [13]. Ces travaux ont montré que l’injection de gentamicine permet la réexpression de 10 à 20 % de dystrophine entière, et est associée à une amélioration de l’état du muscle. Néanmoins, l’effet de la gentamicine sur la souris mdx n’a pu être reproduit par d’autres équipes [14]. Pour le gène de la dystrophine, les résultats des tests cliniques sont également nuancés. La protéine dystrophine entière a été détectée chez certains patients et atteignait jusqu’à 15 % du niveau de la protéine sauvage mais sans permettre un bénéfice thérapeutique clair [15–17, 45]. Le succès de cette approche dépend du taux de réexpression de la protéine complète qui est nécessaire pour permettre un bénéfice thérapeutique. D’une manière générale, il apparaît que les pathologies liées à l’absence d’une protéine de structure (ex. : dystrophine) seront plus difficiles à traiter par cette approche que celles, telles les maladies métaboliques, pour lesquelles même un faible taux de réexpression de la protéine complète permet une activité biologique. Un intérêt grandissant pour cette stratégie thérapeutique a conduit de nombreuses équipes à établir de nouveaux modèles animaux, puis à mener des essais cliniques chez l’homme dans diverses pathologies humaines liées à des codons stop prématurés (pour revue voir [18, 19]). Les résultats sont très variables, ils dépendent à la fois des mutations non-sens et de la maladie étudiée. Le bénéfice thérapeutique réel reste encore difficile à estimer, car la gentamicine n’a souvent été administrée que pendant de courtes durées en raison des effets secondaires importants. Récemment, plusieurs études ont exploré la possibilité de réexprimer une protéine entière à partir d’un gène suppresseur de tumeur possédant une mutation non-sens [20–22]. Ce type de mutation participe à la progression tumorale puisque la prolifération cellulaire n’est plus contrôlée. Nous avons montré que le traitement par les aminoglycosides permet de réexprimer une protéine p53 entière et fonctionnelle, capable d’induire l’apoptose (mort cellulaire programmée) dans une lignée tumorale humaine possédant une mutation non-sens dans le gène p53 [21, 46]. Le traitement par des molécules favorisant la translecture pourrait ainsi être également efficace dans le cas de certains cancers. Le cancer est d’ailleurs probablement une cible particulièrement appropriée, car un niveau de toxicité relativement élevé est acceptable pour des traitements anticancéreux qui sont utilisés pour des temps relativement courts, alors que les maladies génétiques nécessitent un traitement pendant toute la vie du patient. |
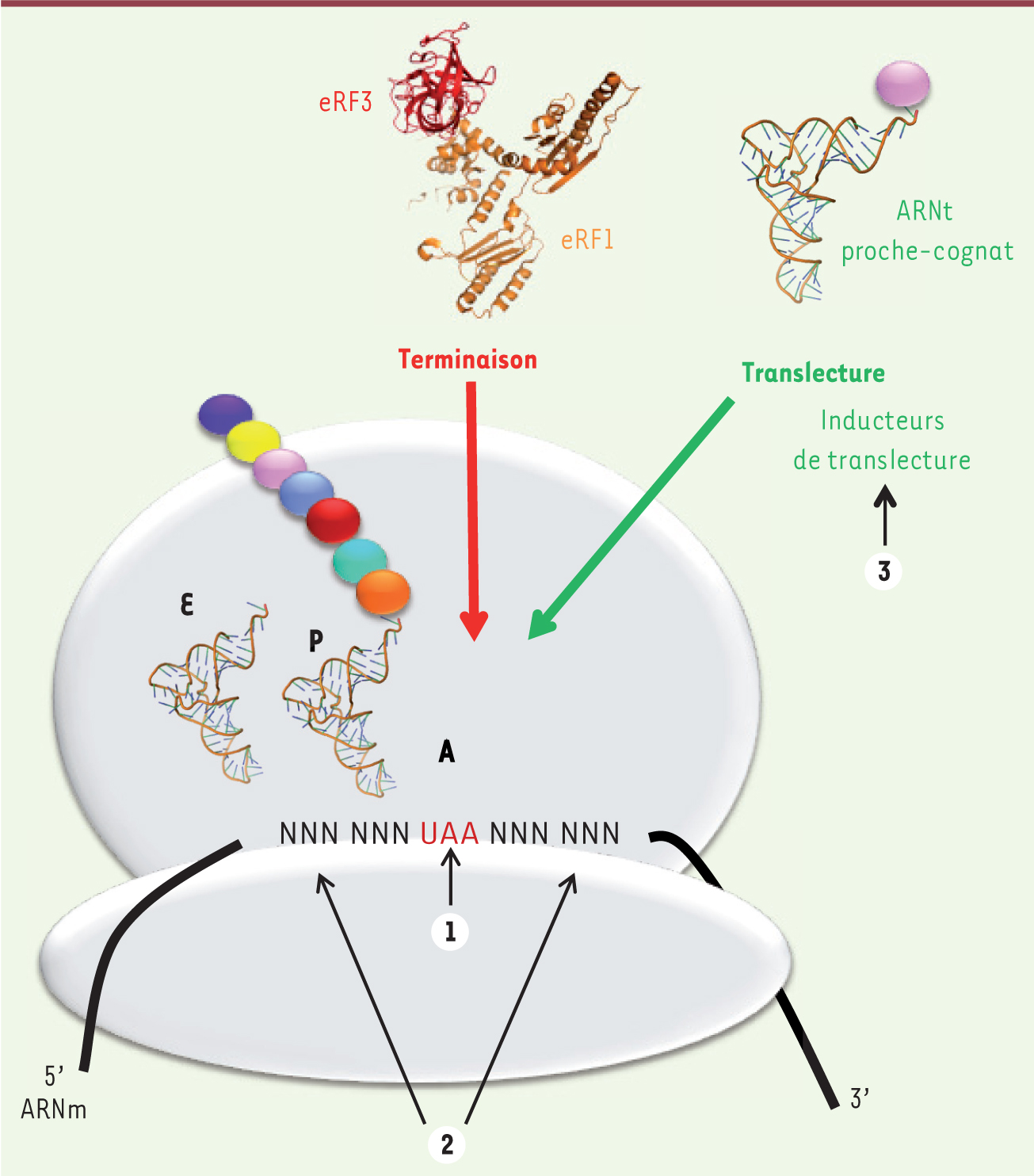
Les inducteurs de translecture La terminaison de la traduction s’effectue lorsque l’un des trois codons stop entre au site A du ribosome. Le facteur de terminaison eRF1 (eukaryotic release factor 1), qui reconnaît chacun des codons stop, s’associe avec la GTPase eRF3 (eukaryotic release factor 3) pour former le complexe de terminaison qui entre dans le ribosome. Le changement conformationnel de eRF1 déclenche alors l’hydrolyse de la liaison entre le peptide et l’aminoacyl-ARNt au site P, permettant la libération du polypeptide. Lorsqu’un codon stop entre au site A du ribosome, il y a toujours une compétition entre la terminaison de la traduction et la translecture. Ce phénomène correspond à l’entrée d’un ARNt « proche-cognat » (traduction littérale de near-cognate; dont l’anticodon présente deux appariements sur trois avec le codon) au niveau du codon stop (Figure 2). Les aminoglycosides, qui ont la capacité de favoriser l’événement de translecture, agissent en se fixant au niveau du site de décodage du ribosome. Des études réalisées chez les procaryotes ont montré que ces molécules provoquaient le basculement des deux adénines très conservées A1492 et A1493 de l’hélice 44 de l’ARNr 16S [23]. Cette fixation favorise l’entrée d’un ARNt proche-cognat et défavorise la reconnaissance du codon de terminaison par le facteur eRF1.
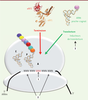 | Figure 2. Compétition entre la terminaison de la traduction et la translecture. Lorsqu’un codon stop sur l’ARNm entre au site A du ribosome, il y a une compétition entre un ARNt proche-cognat, c’est-à-dire possédant deux appariements de base sur trois avec le codon stop (événement de translecture) et le complexe de terminaison eRF1/eRF3 (événement de terminaison). La décision entre terminaison et translecture est influencée par : la nature du codon stop (UAA, UAG ou UGA) (1) ; les nucléotides situés de part et d’autre du codon stop (2) ; certaines molécules (inducteurs de translecture) telles que les antibiotiques aminoglycosides qui se fixent sur le ribosome (3). |
Parmi les aminoglycosides capables d’induire la translecture chez les eucaryotes, les plus efficaces sont le G418 (généticine), la gentamicine, l’amikacine et la paromomycine (Tableau I, Figure 3). La gentamicine, isolée à partir d’une actinobactérie, est un des rares aminoglycosides à être administré (pour ses propriétés antibactériennes) chez l’homme pour des traitements de durée limitée. Néanmoins, ces molécules induisent une cytotoxicité qui ne permet pas d’envisager leur utilisation prolongée. Les aminoglycosides sont chargés positivement et interfèrent avec les phospholipides, les phospholipases et contribuent à la formation de radicaux libres délétères pour la cellule. La gentamicine est toxique pour les cellules rénales et celles de l’oreille interne, ce qui s’explique par la forte affinité de cette molécule pour les récepteurs mégalines, très nombreux à la surface de ces cellules [47]. Le problème de la toxicité est d’autant plus aigu que les patients concernés sont en majorité des enfants dont le traitement devra être prolongé.
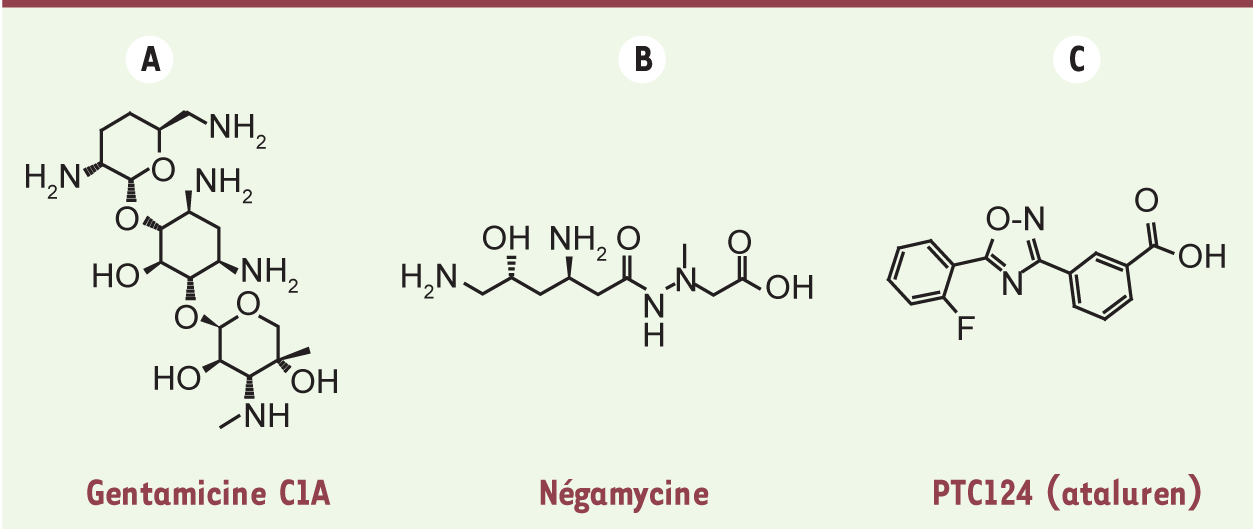
 | Figure 3. Structures des composés inducteurs de translecture. A. La gentamicine est un mélange de 3 composés : C1, C1A et C2. La figure représente le composé C1A. Cette molécule appartient à la famille des antibiotiques aminoglycosides. Sa fixation sur le site A du ribosome, au niveau du centre de décodage (petite sous-unité ribosomique), favorise l’entrée d’un ARNt proche-cognat et défavorise la reconnaissance du codon stop par le complexe de terminaison. B. La négamycine est un antibiotique dipeptide. Son mode d’action n’est pas totalement compris, deux sites de fixation sur le ribosome ont été déterminés : au niveau du centre de décodage et dans le tunnel de sortie du polypeptide (grande sous-unité ribosomique). C. Le PTC124 (ataluren) appartient à la famille des oxadiazoles. Son mode d’action n’est pas encore élucidé puisque la cible moléculaire n’a pas été décrite. |
Tableau I.
|
Utilisation chez l’homme
|
|
Nom |
Cible moléculaire |
Effet antibiotique |
Effets sur la translecture (modèles) |
Pour l’effet antibiotique |
Étude clinique dans les maladies à codons stop |
|
Aminoglycosides
|
|
Amikacine |
Sous-unité 40S du ribosome, ARNr 18S, hélice 44 |
Oui |
In vivo (souris) |
Oui |
Non |
|
G418 (généticine) |
Oui |
In vivo (souris) |
Non |
Non |
|
Gentamicine |
Oui |
In vivo (souris) |
Oui |
Oui |
|
Paromomycine |
Oui |
Culture cellulaire |
Limitée au traitement des parasites intestinaux |
Non |
|
|
Dérivés
|
NB54 |
Supposée identique à celle des aminoglycosides classiques |
Non |
In vivo (souris) |
Non |
Non |
| NB74 |
Non |
Culture cellulaire |
Non |
Non |
| NB84 |
Non |
In vivo (souris) |
Non |
Non |
|
TC007 |
Modéré |
In vivo (souris) |
Non |
Non |
|
| Non apparentés aux aminoglycosides
|
|
Négamycine |
Ribosome : |
Oui |
In vivo (souris) |
Non |
Non |
|
Sous-unité 40S, ARNr 18S, hélice 44 |
|
Sous-unité 60S ARNr 25S |
|
|
|
PTC124 (Ataluren) |
nd |
Non |
In vivo (souris) |
Non |
Oui (phase III) |
|
|
|
RTC 13 |
nd |
nd |
Culture cellulaire |
Non |
Non |
|
RTC 14 |
Molécules testées pour leur activité d’induction de translecture. nd : non déterminé. |
Plusieurs approches sont actuellement envisagées afin de contrer ces effets secondaires, telles que l’administration d’antioxydants, qui permettent de réduire le niveau de radicaux libres [24], ou de polyanions, comme le poly-L-aspartate, qui semblent réduire les effets toxiques de la gentamicine [25]. De manière intéressante, il n’y a pas de corrélation entre la toxicité des aminoglycosides et leur efficacité de translecture. Certains aminoglycosides qui n’induisent pas de translecture sont beaucoup plus toxiques que d’autres qui l’induisent. Ceci suggère que la toxicité des aminoglycosides n’est pas principalement due à la translecture potentielle de codons stop naturels. Les aminoglycosides ont été sélectionnés pour leurs propriétés antibactériennes et non sur leur capacité à induire la translecture chez les eucaryotes. Leur utilisation dans le cadre du traitement de maladies génétiques dues à des mutations non-sens est donc détournée par rapport à l’objectif initial. Plusieurs équipes cherchent actuellement à identifier de nouveaux aminoglycosides qui permettraient une translecture plus forte et présenteraient une toxicité moindre. À partir de la structure minimale de la paromomycine, plusieurs molécules ont été isolées : le composé TC007 qui a été testé dans un modèle d’amyotrophie spinale (SMA, spinal muscular atrophy) [26] et les composés NB54, NB74 et NB84 [27, 28]. Des molécules non apparentées aux aminoglycosides peuvent également être efficaces sur la translecture, c’est le cas de la négamycine (Figure 3), un antibiotique dipeptide issu d’une souche de Streptomyces. Le mode d’action de la négamycine n’est pas totalement élucidé, deux sites de fixation sur le ribosome ont été mis en évidence : au niveau du site A comme les aminoglycosides [29] et au niveau du tunnel de sortie du polypeptide [30]. Différents cribles à grande échelle ont également permis d’isoler de nouveaux composés pour leur capacité à induire la translecture : RTC 13 et RTC 14 [31] et le PTC 124 (ataluren) (Figure 3,Tableau I) [32]. Ce dernier composé, déjà au stade d’essais cliniques de phase 3, présente l’avantage de pouvoir être administré par voie orale et d’être bien toléré par les patients. Des résultats très encourageants ont été obtenus, dont l’amélioration de certains paramètres physiologiques lors d’un essai clinique chez des patients atteints de mucoviscidose [33]. Néanmoins, le mode d’action du PTC124 reste mal caractérisé, en particulier sa cible moléculaire n’a pas encore été décrite. L’ensemble de ces recherches contribue à élargir le spectre d’action des molécules favorisant la translecture et pourrait permettre de proposer un traitement pour les mutations non-sens réfractaires aux aminoglycosides. |
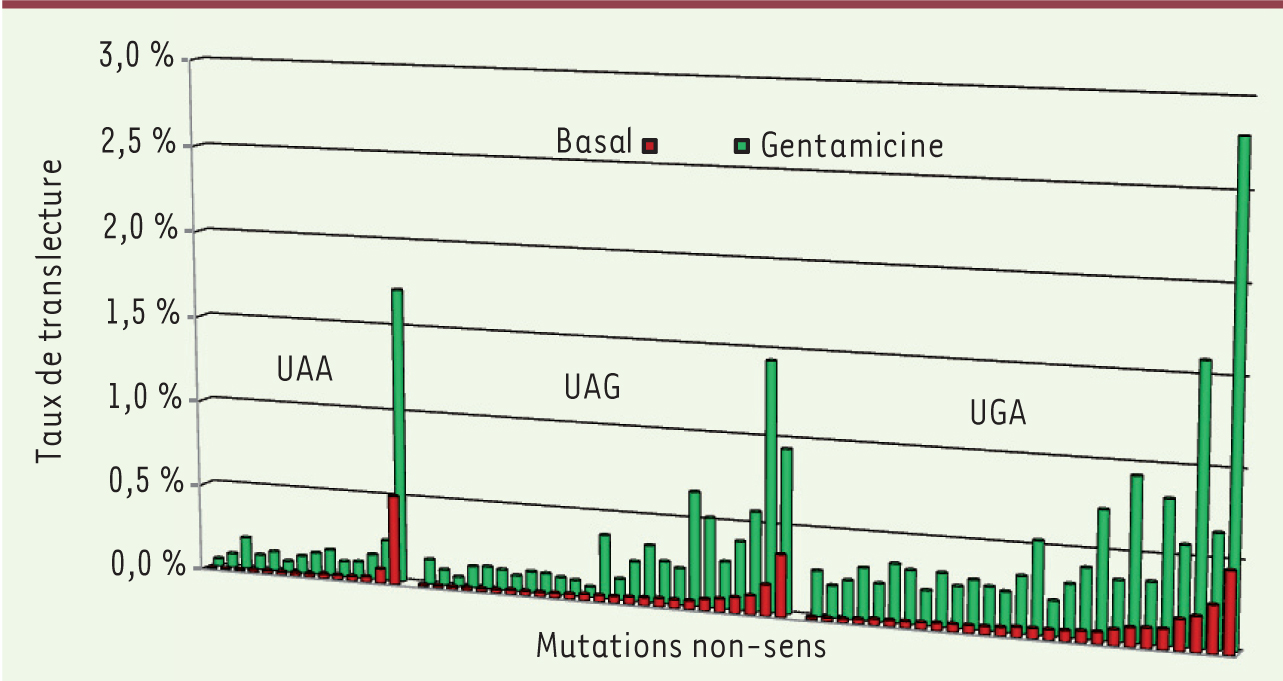
La nature du codon stop et son contexte nucléotidique modulent la translecture L’effet du contexte nucléotidique a été étudié en absence et en présence de différents antibiotiques, en particulier la gentamicine, dans les cellules de mammifères en culture. Il a été montré que les mutations non-sens présentent une très grande variabilité de réponse au traitement [34]. La nature du codon stop est déterminante pour l’efficacité de translecture. Un codon UGA permet généralement une translecture plus efficace qu’un UAG, qui lui-même est plus efficace qu’un UAA (Figure 4). Certains UAA vont néanmoins induire une translecture plus élevée que certains UGA. Cette observation illustre l’effet majeur du contexte nucléotidique environnant le codon stop dans l’efficacité de la terminaison de la traduction. Il n’existe à l’heure actuelle aucune règle prédictive du taux de translecture en fonction de la séquence de la mutation. Néanmoins, différentes études ont mis en évidence qu’un C en position + 4 (nucléotide situé immédiatement derrière le codon stop) permet généralement la translecture la plus efficace dans un contexte donné [35, 36]. Cependant, dans le cas de certaines mutations pour lesquelles d’autres nucléotides sont présents à ces positions, la gentamicine peut induire un taux de translecture suffisamment élevé pour espérer un bénéfice thérapeutique. Le contexte nucléotidique pourrait influencer l’efficacité de la terminaison de la traduction en favorisant un ARNt proche-cognat et/ou en défavorisant le facteur de terminaison pour la fixation au site A du ribosome, mais les mécanismes moléculaires sont encore inconnus. Actuellement, la mesure in cellulo du taux de translecture d’une mutation donnée est le seul indice permettant de prédire si celle-ci va être sensible au traitement [34].
 | Figure 4. Taux de translecture en fonction des différents codons stop et du contexte nucléotidique. Les taux de translecture de différentes mutations non-sens quantifiés dans des cultures cellulaires grâce à un système rapporteur sont représentés en ordonnée. Les séquences testées correspondent au codon stop entouré de 4 codons en 5’ et de 3 codons en 3’. Chaque couple d’histogrammes (vert et rouge) correspond à une mutation non-sens testée. Les mutations ont été classées sur l’axe des abscisses en fonction du codon stop puis en fonction des taux croissants de translecture en absence de traitement (taux basal). Le taux de translecture basal (rouge) et en présence de gentamicine (vert) présentent une grande variabilité d’une mutation non-sens à l’autre. Ceci illustre l’importance de la nature
du codon stop ainsi que du contexte nucléotidique environnant sur le niveau de translecture. |
|
Efficacité de la voie NMD et lien avec la translecture Un taux de translecture élevé est une condition nécessaire mais non suffisante pour espérer un bénéfice thérapeutique. En effet, l’efficacité de la voie NMD, qui dégrade spécifiquement les ARNm contenant un codon stop prématuré, est également à prendre en compte. La voie NMD est un mécanisme de contrôle qualité des ARNm [1]. Elle est impliquée dans la reconnaissance et la dégradation spécifiques des ARNm qui présentent un codon stop prématuré résultant d’une mutation, d’une erreur de transcription ou d’épissage. La voie NMD nécessite la présence des facteurs Upf1p, Upf2p et Upf3p dont les fonctions précises ne sont pas encore élucidées. Chez les mammifères, des complexes protéiques, appelés exon junctions complexes (EJC), sont déposés au niveau des jonctions exons-exons lors de l’épissage. Au cours de la traduction, le ribosome enlève les EJC lors de sa progression. En cas de codon stop prématuré, la présence d’EJC situés entre le ribosome et l’extrémité 3’ de l’ARNm déclenche la dégradation de l’ARN messager. Il a été montré que l’efficacité de la voie NMD varie en fonction du patient, du type cellulaire et de la localisation du codon stop prématuré dans la séquence codante [37, 38]. Les patients dont la voie NMD est particulièrement efficace répondront a priori moins bien au traitement. Cependant, la translecture exerce un effet antagoniste de la dégradation par la voie NMD. Dans les cellules de mammifères, le traitement par des molécules favorisant la translecture, telles que le G418 ou la négamycine, permet de stabiliser les transcrits contenant un codon stop prématuré [6, 21, 39]. L’événement de translecture permet à l’ARNm d’être traduit jusqu’au codon de terminaison naturel, éliminant au passage les complexes EJC nécessaires au NMD. Il est alors probable que ces transcrits ne soient plus considérés comme aberrants et échappent définitivement à la voie NMD [40]. |
La nature de l’acide aminé incorporé au niveau du codon stop Lors de l’événement de translecture, la reconnaissance du codon stop prématuré est assurée par un ARNt proche-cognat. Néanmoins, plusieurs ARNt présentent cette caractéristique. Il est donc impossible de prédire précisément l’acide aminé qui est incorporé, qui peut alors être différent de celui présent dans la protéine sauvage. Or, dans cette stratégie thérapeutique, la nature de l’acide aminé incorporé doit être compatible avec la stabilité et la fonctionnalité de la protéine réexprimée. Jusqu’à présent seules quelques études se sont intéressées à ce point crucial. Dans un système in vitro utilisant des réticulocytes de lapin, Feng et al. ont déterminé que les codons UAG et UAA induisent l’incorporation d’une glutamine alors que le codon UGA permet l’incorporation d’arginine, de cystéine ou de tryptophane [41]. De même, très peu de choses sont connues concernant l’influence des inducteurs de translecture sur la nature de l’acide aminé incorporé au niveau d’un codon stop. Des études chez la levure ont montré que l’ARNt incorporé au niveau du codon stop en présence de paromomycine est aussi un proche-cognat [42, 43]. |
L’utilisation d’inducteurs de translecture capables de supprimer les mutations non-sens impliquées dans différentes pathologies humaines est à la base d’une nouvelle approche thérapeutique très prometteuse. Celle-ci, jusqu’alors mise en œuvre pour des maladies génétiques comme la myopathie de Duchenne ou la mucoviscidose, pourrait être étendue à certains cancers. Le développement de cette stratégie passe par l’approfondissement de nos connaissances des mécanismes moléculaires mis en jeu lors de la translecture. Une meilleure compréhension des paramètres qui régissent l’influence du contexte nucléotidique permettrait d’établir des règles prédictives de réponse au traitement en fonction de la mutation impliquée. Les avancées actuelles en recherche fondamentale, telles que l’élucidation à l’échelle atomique de la structure du ribosome eucaryote [48], devraient donner un nouvel essor à ces travaux, en permettant (entre autres) de rationnaliser la recherche de nouveaux inducteurs de translecture. Il pourrait alors être envisageable de proposer des molécules adaptées aux différents codons stop et à leur contexte nucléotidique, permettant ainsi une approche thérapeutique « allèle-spécifique ». |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Nous remercions pour leur soutien, la Ligue nationale contre le cancer, l’Association pour la recherche sur le cancer et l’Association française contre les myopathies.
|
1. Camier S, Séraphin B. Détruisez ce message (ARN) après l’avoir lu ! Med Sci (Paris). 2007; ; 23 : :850.–856. 2. Mort M, Ivanov D, Cooper DN, Chuzhanova NA. A meta-analysis of nonsense mutations causing human genetic disease . Hum Mutat. 2008; ; 29 : :1037.–1047. 3. Rowe SM, Clancy JP. Pharmaceuticals targeting nonsense mutations in genetic diseases: progress in development . BioDrugs. 2009; ; 23 : :165.–174. 4. Keeling KM, Du M, Bedwell DM. Therapies of nonsense-associated diseases . In : Maquat L, ed. Nonse-mediated mRNA decay . Austin: : Landes Bioscience; , 2006 5. Burke JF, Mogg AE. Suppression of a nonsense mutation in mammalian cells in vivo by the aminoglycoside antibiotics G-418 and paromomycin . Nucleic Acids Res. 1985; ; 13 : :6265.–6272. 6. Howard M, Frizzell RA, Bedwell DM. Aminoglycoside antibiotics restore CFTR function by overcoming premature stop mutations . Nat Med. 1996; ; 2 : :467.–469. 7. Bedwell DM, Kaenjak A, Benos DJ, et al. Suppression of a CFTR premature stop mutation in a bronchial epithelial cell line . Nat Med. 1997; ; 3 : :1280.–1284. 8. Du M, Jones JR, Lanier J, et al. Aminoglycoside suppression of a premature stop mutation in a Cftr−/− mouse carrying a human CFTR-G542X transgene . J Mol Med. 2002; ; 80 : :595.–604. 9. Clancy JP, Bebok Z, Ruiz F, et al. Evidence that systemic gentamicin suppresses premature stop mutations in patients with cystic fibrosis . Am J Respir Crit Care Med. 2001; ; 163 : :1683.–1692. 10. Wilschanski M, Famini C, Blau H, et al. A pilot study of the effect of gentamicin on nasal potential difference measurements in cystic fibrosis patients carrying stop mutations . Am J Respir Crit Care Med. 2000; ; 161 : :860.–865. 11. Wilschanski M, Yahav Y, Yaacov Y, et al. Gentamicin-induced correction of CFTR function in patients with cystic fibrosis and CFTR stop mutations . N Engl J Med. 2003; ; 349 : :1433.–1441. 12. Sermet-Gaudelus I, Renouil M, Fajac A, et al. In vitro prediction of stop-codon suppression by intravenous gentamicin in patients with cystic fibrosis: a pilot study . BMC Med. 2007; ; 5 : :5.. 13. Barton-Davis ER, Cordier L, Shoturma DI, et al. Aminoglycoside antibiotics restore dystrophin function to skeletal muscles of mdx mice . J Clin Invest. 1999; ; 104 : :375.–381. 14. Dunant P, Walter MC, Karpati G, Lochmuller H.. Gentamicin fails to increase dystrophin expression in dystrophin-deficient muscle . Muscle Nerve. 2003; ; 27 : :624.–627. 15. Wagner KR, Hamed S, Hadley DW, et al. Gentamicin treatment of Duchenne and Becker muscular dystrophy due to nonsense mutations . Ann Neurol. 2001; ; 49 : :706.–711. 16. Politano L, Nigro G, Nigro V, et al. Gentamicin administration in Duchenne patients with premature stop codon. Preliminary results . Acta Myol. 2003; ; 22 : :15.–21. 17. Malik V, Rodino-Klapac LR, Viollet L, et al. Gentamicin-induced readthrough of stop codons in Duchenne muscular dystrophy . Ann Neurol. 2010; ; 67 : :771.–780. 18. Zingman LV, Park S, Olson TM, et al. Aminoglycoside-induced translational read-through in disease: overcoming nonsense mutations by pharmacogenetic therapy . Clin Pharmacol Ther. 2007; ; 81 : :99.–103. 19. Linde L, Kerem B. Introducing sense into nonsense in treatments of human genetic diseases . Trends Genet. 2008; ; 24 : :552.–563. 20. Zilberberg A, Lahav L, Rosin-Arbesfeld R. Restoration of APC gene function in colorectal cancer cells by aminoglycoside- and macrolide-induced read-through of premature termination codons . Gut. 2010; ; 59 : :496.–507. 21. Floquet C, Deforges J, Rousset JP, Bidou L. Rescue of non-sense mutated p53 tumor suppressor gene by aminoglycosides . Nucleic Acids Res. 2011; ; 39 : :3350.–3362. 22. Floquet C, Rousset JP, Bidou L. Readthrough of premature termination codons in the adenomatous polyposis coli gene restores its biological activity in human cancer cells . PLoS One. 2011; ; 6 : :e24125.. 23. Carter AP, Clemons WM, Brodersen DE, et al. Functional insights from the structure of the 30S ribosomal subunit and its interactions with antibiotics . Nature. 2000; ; 407 : :340.–348. 24. Mazzon E, Britti D, De Sarro A, et al. Effect of N-acetylcysteine on gentamicin-mediated nephropathy in rats . Eur J Pharmacol. 2001; ; 424 : :75.–83. 25. Du M, Keeling KM, Fan L, et al. Poly-L-aspartic acid enhances and prolongs gentamicin-mediated suppression of the CFTR-G542X mutation in a cystic fibrosis mouse model . J Biol Chem. 2009; ; 284 : :6885.–6892. 26. Mattis VB, Rai R, Wang J, et al. Novel aminoglycosides increase SMN levels in spinal muscular atrophy fibroblasts . Hum Genet. 2006; ; 120 : :589.–601. 27. Nudelman I, Rebibo-Sabbah A, Shallom-Shezifi D, et al. Redesign of aminoglycosides for treatment of human genetic diseases caused by premature stop mutations . Bioorg Med Chem Lett. 2006; ; 16 : :6310.–6315. 28. Nudelman I, Glikin D, Smolkin B, et al. Repairing faulty genes by aminoglycosides: Development of new derivatives of geneticin (G418) with enhanced suppression of diseases-causing nonsense mutations . Bioorg Med Chem. 2010; ; 18 : :3735.–3746. 29. Arakawa M, Shiozuka M, Nakayama Y, et al. Negamycin restores dystrophin expression in skeletal and cardiac muscles of mdx mice . J Biochem. 2003; ; 134 : :751.–758. 30. Schroeder SJ, Blaha G, Moore PB. Negamycin binds to the wall of the nascent chain exit tunnel of the 50S ribosomal subunit . Antimicrob Agents Chemother. 2007; ; 51 : :4462.–4465. 31. Du L, Damoiseaux R, Nahas S, et al. Nonaminoglycoside compounds induce readthrough of nonsense mutations . J Exp Med. 2009; ; 206 : :2285.–2297. 32. Welch EM, Barton ER, Zhuo J, et al. PTC124 targets genetic disorders caused by nonsense mutations . Nature. 2007; ; 447 : :87.–91. 33. Sermet-Gaudelus I, Boeck KD, Casimir GJ, et al. Ataluren (PTC124) induces cystic fibrosis transmembrane conductance regulator protein expression and activity in children with nonsense mutation cystic fibrosis . Am J Respir Crit Care Med. 2010; ; 182 : :1262.–1272. 34. Bidou L, Hatin I, Perez N, et al. Premature stop codons involved in muscular dystrophies show a broad spectrum of readthrough efficiencies in response to gentamicin treatment . Gene Ther. 2004; ; 11 : :619.–627. 35. Manuvakhova M, Keeling K, Bedwell DM. Aminoglycoside antibiotics mediate context-dependent suppression of termination codons in a mammalian translation system . RNA. 2000; ; 6 : :1044.–1055. 36. Cassan M, Rousset JP. UAG readthrough in mammalian cells: effect of upstream and downstream stop codon contexts reveal different signals . BMC Mol Biol. 2001; ; 2 : :3.. 37. Linde L, Boelz S, Neu-Yilik G, et al. The efficiency of nonsense-mediated mRNA decay is an inherent character and varies among different cells . Eur J Hum Genet. 2007; ; 15 : :1156.–1162. 38. Linde L, Boelz S, Nissim-Rafinia M, et al. Nonsense-mediated mRNA decay affects nonsense transcript levels and governs response of cystic fibrosis patients to gentamicin . J Clin Invest. 2007; ; 117 : :683.–692. 39. Allamand V, Bidou L, Arakawa M, et al. Drug-induced readthrough of premature stop codons leads to the stabilization of laminin alpha2 chain mRNA in CMD myotubes . J Gene Med. 2008; ; 10 : :217.–224. 40. Hogg JR, Goff SP. Upf1 senses 3’UTR length to potentiate mRNA decay . Cell. 2010; ; 143 : :379.–389. 41. Feng YX, Copeland TD, Oroszlan S, et al. Identification of amino acids inserted during suppression of UAA and UGA termination codons at the gag-pol junction of Moloney murine leukemia virus . Proc Natl Acad Sci USA. 1990; ; 87 : :8860.–8863. 42. Stansfield I, Jones KM, Herbert P, et al. Missense translation errors in Saccharomyces cerevisiae . J Mol Biol. 1998; ; 282 : :13.–24. 43. Salas-Marco J, Bedwell DM. Discrimination between defects in elongation fidelity and termination efficiency provides mechanistic insights into translational readthrough . J Mol Biol. 2005; ; 348 : :801.–815. 44. Leporé N, Lafontaine DL. « Attrape-moi si tu peux » - Surveillance de l’intégrité structurale et fonctionnelle des ARN cellulaires eucaryotes . Med Sci (Paris). 2010; ; 26 : :259.–266. 45. Kaplan JC. Lost after translation . Med Sci (Paris). 2008; ; 24 : :912.–915. 46. Floquet C, Rousset JP, Bidou L. La réactivation par translecture du gène p53 possédant une mutation non-sens induit l’apoptose de cellules cancéreuses . Med Sci (Paris). 2011; ; 27 : :585.–586. 47. Verroust PJ, Kozyraki R. Cubiline : rôle physiopathologique et relations avec la mégaline . Med Sci (Paris). 2003; ; 19 : :337.–343. 48. Ben-Shem A. Garreau de Loubresse N, Melnikov S, et al. The structure of the eukaryotic ribosome at 3.0 Å resolution . Science. 2011; ; 334 : :1524.–1529. |