| |
| Med Sci (Paris). 2012 May; 28(5): 497–502. Published online 2012 May 30. doi: 10.1051/medsci/2012285014.Génétique de l’infertilité masculine Les nouveaux acteurs Charles Coutton,1,2,3 Véronique Satre,1,2,3 Christophe Arnoult,1,2 and Pierre Ray1,2,4* 1Équipe génétique, infertilité et thérapeutiques, laboratoire AGIM (ageing, imaging and modeling), CNRS FRE3405, La Tronche, 38700, France 2Université Joseph Fourier, Grenoble, 38000, France 3Centre hospitalo-universitaire (CHU) de Grenoble, unité fonctionnelle (UF) de génétique chromosomique, Grenoble, 38000, France 4CHU de Grenoble, UF de biochimie et génétique moléculaire, Grenoble, 38000, France |
Génétique et infertilité masculine : quelques chiffres Selon l’OMS (organisation mondiale de la santé), on définit l’infertilité comme l’incapacité pour un couple de procréer après deux ans de rapports sexuels non protégés [1]. Il est généralement admis qu’environ 15 % des couples sont confrontés à des problèmes d’infertilité. Selon une étude publiée en 2007, la prévalence de l’infertilité serait toutefois plus proche de 9 %, ce qui concerne tout de même près de 70 millions de couples dans le monde [2]. L’infertilité est un problème majeur de santé publique et représente un enjeu médical et scientifique important. Dans environ 50 % des cas, elle implique soit exclusivement l’homme, soit les deux membres du couple. Les causes d’infertilité masculine sont nombreuses et multifactorielles. On distingue des causes sécrétoires, les plus fréquentes, accompagnées d’un défaut de la spermatogenèse, et des causes excrétoires empêchant l’excrétion des spermatozoïdes. Un bilan clinique complet permet d’attribuer environ 30 % des cas d’azoospermies et d’oligozoospermies (respectivement absence totale de spermatozoïdes dans le sperme ou quantité anormalement réduite) à des anomalies chromosomiques ou à des mutations géniques touchant des gènes intervenant dans la production ou la fonction de cellules germinales. Par ailleurs, 30 % des infertilités restent inexpliquées et près de 40 % ont des causes incertaines. Ainsi, l’infertilité masculine d’origine génétique pourrait concerner près de 1 homme sur 40 [3]. Parmi les causes génétiques actuellement bien établies, on trouve les anomalies chromosomiques, les microdélétions du chromosome Y et les mutations du gène CFTR (cystic fibrosis transmembrane conductance regulator). |
Des anomalies du nombre ou de la structure des autosomes, mais surtout des gonosomes, peuvent être impliquées. Chez les patients infertiles, le pourcentage d’anomalies chromosomiques observées sur le caryotype fait à partir de cellules sanguines s’échelonne entre 2 et 8 %. Il peut atteindre 15 % chez les patients azoospermiques, soit 10 à 20 fois la fréquence retrouvée dans la population générale [4]. Le syndrome de Klinefelter (47, XXY) est la cause la plus fréquente d’hypogonadisme et d’infertilité chez l’homme. Sa prévalence est 50 fois plus élevée chez les patients infertiles azoospermiques (14 %) que dans la population générale (0,2 %) [5]. |
Les microdélétions du chromosome Y Les microdélétions du chromosome Y représentent également une cause fréquente d’anomalies génétiques chez les hommes infertiles. Chez les patients présentant une azoospermie non obstructive, leur prévalence est estimée entre 8 et 12 % [6]. Mais leur incidence varie en fonction de l’importance de l’atteinte spermatique et de l’origine ethnique ou géographique des patients étudiés. De plus, dans la littérature, certaines études pourraient présenter un biais de recrutement. Les délétions impliquent les régions AZF (azoospermia factor) du chromosome Y, qui sont subdivisées en trois locus : AZF a, b et c. Ces régions regroupent de nombreux gènes nécessaires à la spermatogenèse dont DAZ1 (deleted in azoospermia) qui fut le premier identifié. Seule la moitié de ces gènes ont une fonction connue [7]. Les délétions de la région AZFc sont les plus fréquentes et sont associées à des phénotypes dont la sévérité est variable. Les délétions des autres régions sont plus rares mais généralement plus sévères [8]. |
L’identification de mutations du gène CFTR chez les patients atteints de mucoviscidose - qui présentent habituellement une agénésie bilatérale des canaux déférents (ABCD) - a permis d’incriminer ce gène dans les agénésies des déférents isolées. Cette malformation est la cause d’environ 2 % des cas d’infertilité masculine et de près de 25 % des azoospermies obstructives [9]. Dans ce contexte, les hommes porteurs de cette malformation ont souvent deux mutations CFTR : une mutation majeure (p.F508del) associée à une mutation mineure (R117H) avec éventuellement un polymorphisme (allèle 5T) qui aggrave son effet [10]. |
Problématiques liées à l’identification de nouvelles mutations Le caryotype et la recherche de microdélétions du chromosome Y et des mutations CFTR permettent d’établir le diagnostic dans moins de 5 % des cas, tous phénotypes confondus [11]. Ce pourcentage démontre clairement l’implication probable d’autres gènes encore inconnus dans les différents phénotypes d’infertilité masculine. On estime qu’entre 1 500 et 2 000 gènes interviennent dans le contrôle de la spermatogenèse, parmi lesquels 300 à 600 sont spécifiquement exprimés dans les cellules germinales masculines. On s’attend donc logiquement à ce que des anomalies de ces gènes perturbent la fertilité masculine [12]. Des processus épigénétiques touchant notamment l’expression des microARN (miARN) sont également en cause dans une part croissante des infertilités [13]. L’augmentation des cas au sein d’une même fratrie et l’étude des modèles animaux ayant un phénotype d’infertilité suggèrent l’implication importante de la composante génétique dans les infertilités inexpliquées. Grâce à l’étude de souris infertiles dont certains gènes ont été invalidés (knock out) et à la fréquence statistiquement plus importante d’un ou plusieurs polymorphismes nucléotidiques (SNP) dans une population d’hommes infertiles par rapport à une population témoin, près de 250 gènes ont été associés de façon plus ou moins forte à l’infertilité [12]. Les effets des polymorphismes étant eux-mêmes modulés par d’autres facteurs génétiques (fond génétique) et/ou environnementaux [14], ces études d’association doivent être considérées avec prudence. L’abondance de gènes candidats complique l’identification des mutations responsables. Cependant, la découverte de nouveaux gènes impliqués dans l’infertilité masculine est primordiale pour une meilleure compréhension de cette pathologie et pour l’identification des acteurs moléculaires intervenant aux différentes étapes de la spermatogenèse. Elle peut conduire à améliorer la prise en charge diagnostique et thérapeutique des patients infertiles. Actuellement, les progrès constants des techniques d’AMP (assistance médicale à la procréation) permettent déjà d’envisager une fécondation avec un sperme déficient mais, dans le même temps, se pose la question de la transmission du facteur génétique causal à la descendance. L’identification de la cause génétique du déficit permettrait d’affiner le pronostic et la prise en charge des patients infertiles évitant dans certains cas des traitements longs, contraignants et couteux. |
Identification de nouveaux gènes Très récemment, l’origine génétique de deux formes de tératozoospermies sévères (anomalies morphologiques du spermatozoïde) a été identifiée : chez les patients atteints, les spermatozoïdes soit sont macrocéphales, soit présentent une tête ronde sans acrosome (globozoospermie) [15–18]. |
Mutations de AURKC et spermatozoïdes macrocéphales Le gène codant pour la kinase C Aurora (AURKC) est à ce jour le seul dont des mutations ont été identifiées chez les individus présentant une infertilité primaire caractérisée par une tératozoospermie avec 100 % de spermatozoïdes macrocéphales [16, 19, 20]. La très grande majorité des spermatozoïdes de ces patients se caractérisent par une augmentation d’un facteur 3 à 4 du volume de la tête et plusieurs flagelles (Figure 1). Ce phénotype, décrit pour la première fois en 1977 par Nistal et al. [21], a été largement étudié depuis [22]. Les analyses par FISH (fluorescent in situ hybridization) et cytométrie en flux révèlent une tétraploïdie constante dans les formes typiques dont 100 % des spermatozoïdes sont macrocéphales [20, 23]. La macrocéphalie est la seule pathologie du spermatozoïde où il existe une corrélation entre le phénotype et le contenu chromosomique du spermatozoïde.
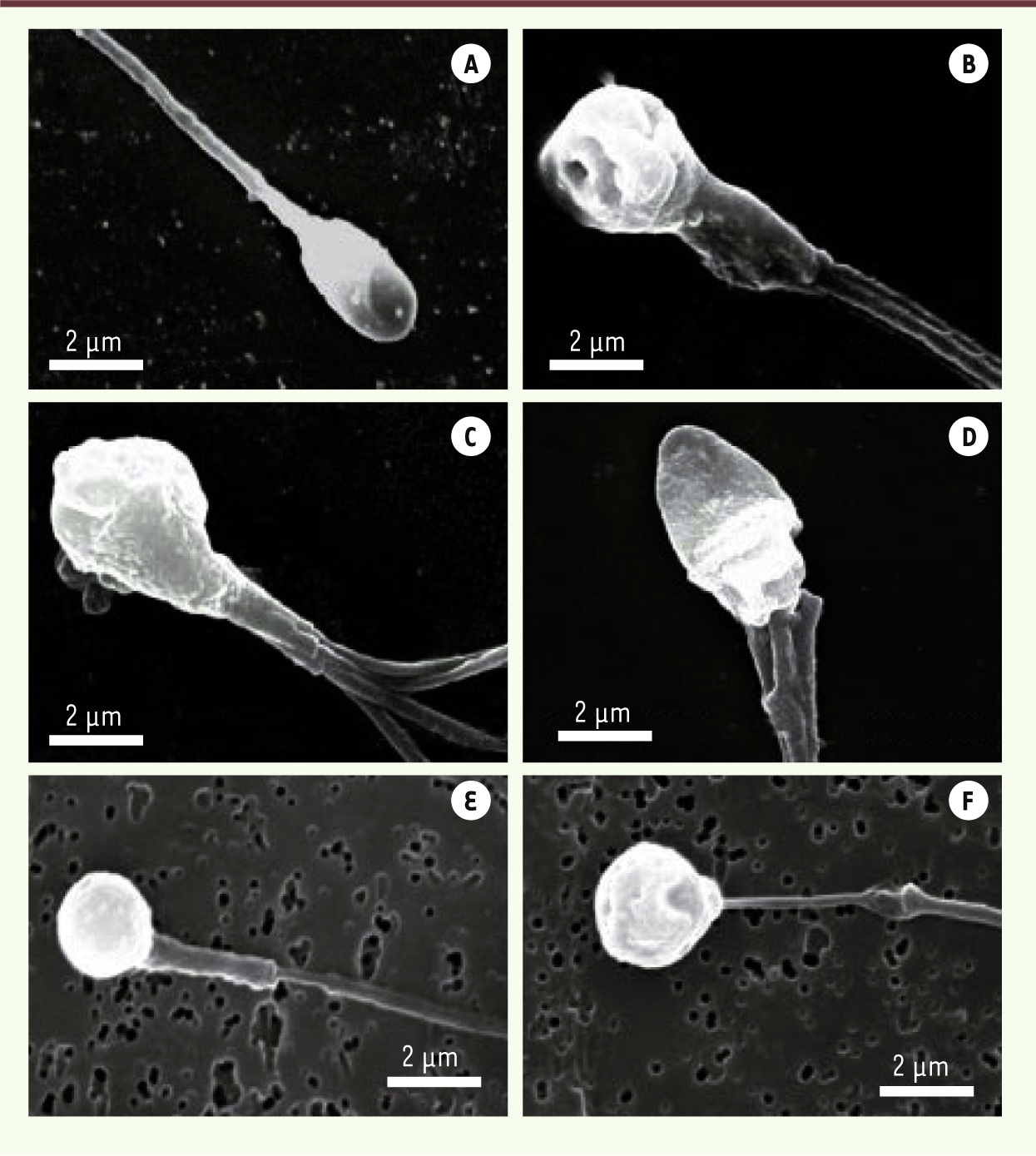
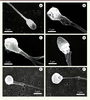 | Figure 1.
Photographies en microscopie électronique à balayage de spermatozoïdes humains présentant des anomalies morphologiques sévères. A. Spermatozoïde témoin provenant d’un individu fertile. B-D. Spermatozoïdes macrocéphales d’un patient avec une mutation homozygote du gène AURKC. E-F. Spermatozoïdes globozoocéphales d’un patient avec une délétion homozygote du gène DPY19L2. |
Dans les pathologies autosomiques récessives, l’approche par cartographie d’homozygotie permet d’identifier les régions d’homozygotie communes à plusieurs patients et de localiser des régions d’intérêt pouvant contenir la mutation responsable. Cette approche positionnelle d’analyse globale des polymorphismes du génome avec des puces à ADN de type SNP (single nucleotide polymorphism) a permis d’identifier une région candidate à l’extrémité du bras long du chromosome 19 en 19q13.43 (Figure 2). Ainsi, une même mutation homozygote sur le gène AURKC (c.144delC) a été identifiée chez 14 patients nord-africains initialement testés [16]. Le gène AURKC code pour une sérine/thréonine kinase appartenant à la famille Aurora, exprimée préférentiellement dans les testicules et impliquée dans la ségrégation des chromosomes et la division cellulaire lors de la méiose. La mutation initiale (c.144delC) dans le domaine kinase induit la production d’une protéine tronquée non fonctionnelle : dans ces conditions il y a un arrêt de la ségrégation des chromosomes durant la méiose et de la cytokinèse (Figure 3). Il en résulte des spermatozoïdes tétraploïdes. L’étude des haplotypes montre que cette mutation a dérivé d’un ancêtre commun apparu il y a environ 15 siècles [16].
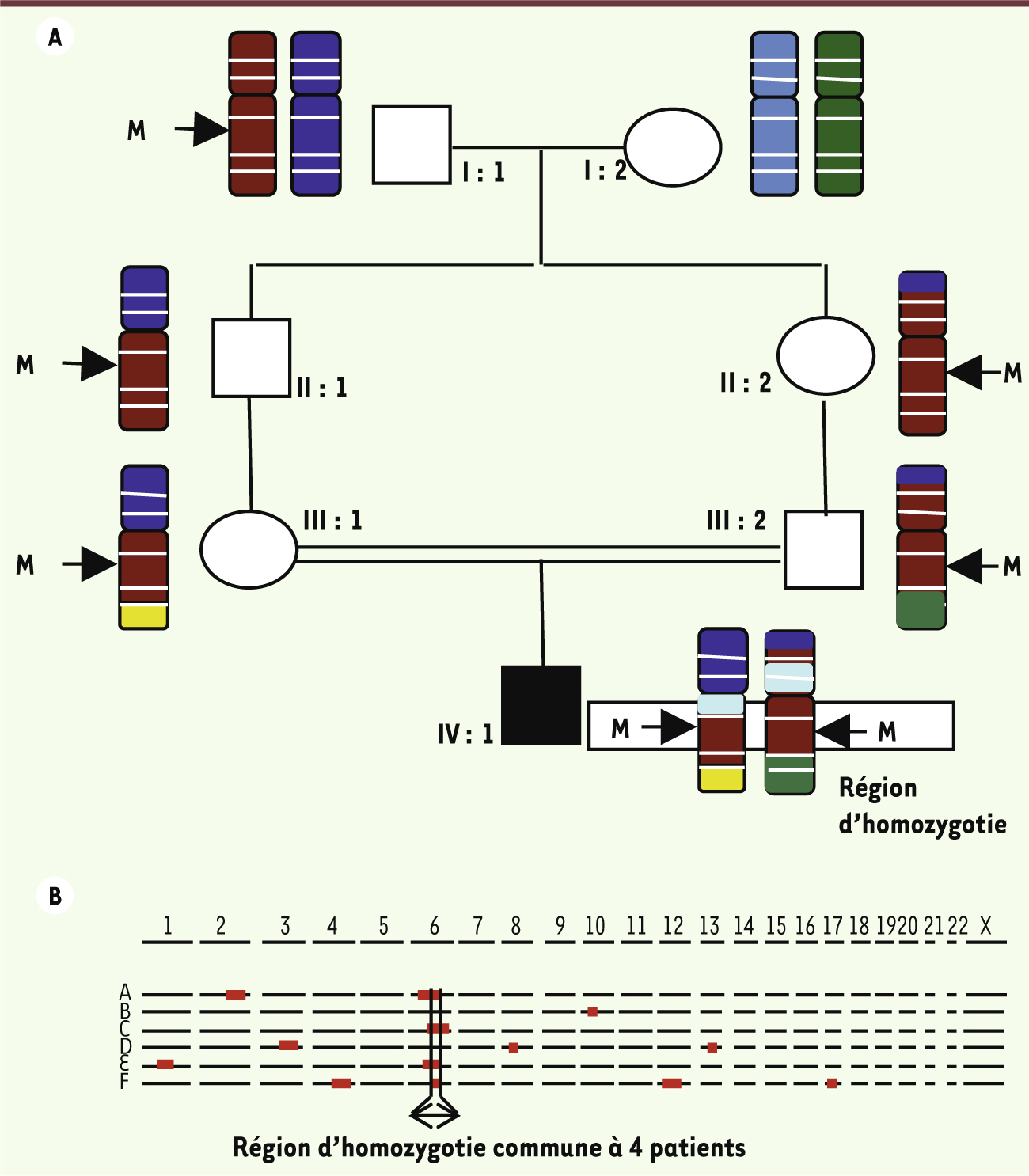
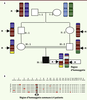 | Figure 2.
Stratégie de localisation d’un gène pathogène par cartographie d’homozygotie. A. Pour les patients atteints d’une maladie génétique rare dont les parents sont apparentés (cousins au 1er ou au 2e degré), on postule que la pathologie ségrége sur un mode autosomique récessif et que les patients ont hérité de deux copies d’une même mutation familiale. Pour simplifier, on ne représente ici qu’un seul des 23 chromosomes, porteur de la mutation d’intérêt. L’arrière grand-père (I : 1) du patient (IV : 1) est porteur d’une seule copie de la mutation M. La mutation est transmise à l’état hétérozygote à ses enfants et à ses petits-enfants avant d’être héritée à l’état homozygote par IV : I. Des recombinaisons entre chromosomes homologues se produisent à chaque méïose, contribuant à la diversité génétique. Deux copies d’une même région chromosomique, plus ou moins grande et entourant la mutation, sont héritées par le patient IV : 1. Cette région, dépourvue des variations génétiques normalement présentes entre chromosomes homologues et qui contribuent à la diversité humaine, est appelée « région d’homozygotie ». B. Une analyse par « puces à ADN » de type SNP (single nucleotide polymorphism) permet d’analyser des variants génétiques répartis sur tout le génome et de repérer les régions d’homozygotie. Cette analyse est réalisée chez plusieurs patients présentant le même phénotype et issus d’une union consanguine. La présence d’une région d’homozygotie commune à plusieurs patients peut indiquer que la mutation causale se trouve dans cette région. Une étude in silico des gènes se trouvant dans la plus petite région d’homozygotie commune est réalisée. Si la fonction et l’expression d’un gène suggèrent qu’il pourrait être un bon candidat, il sera séquencé chez tous les patients. Si une mutation ayant un effet délétère sur la protéine est identifiée chez plusieurs patients, on conclut que ce gène est impliqué dans la genèse des symptômes. |
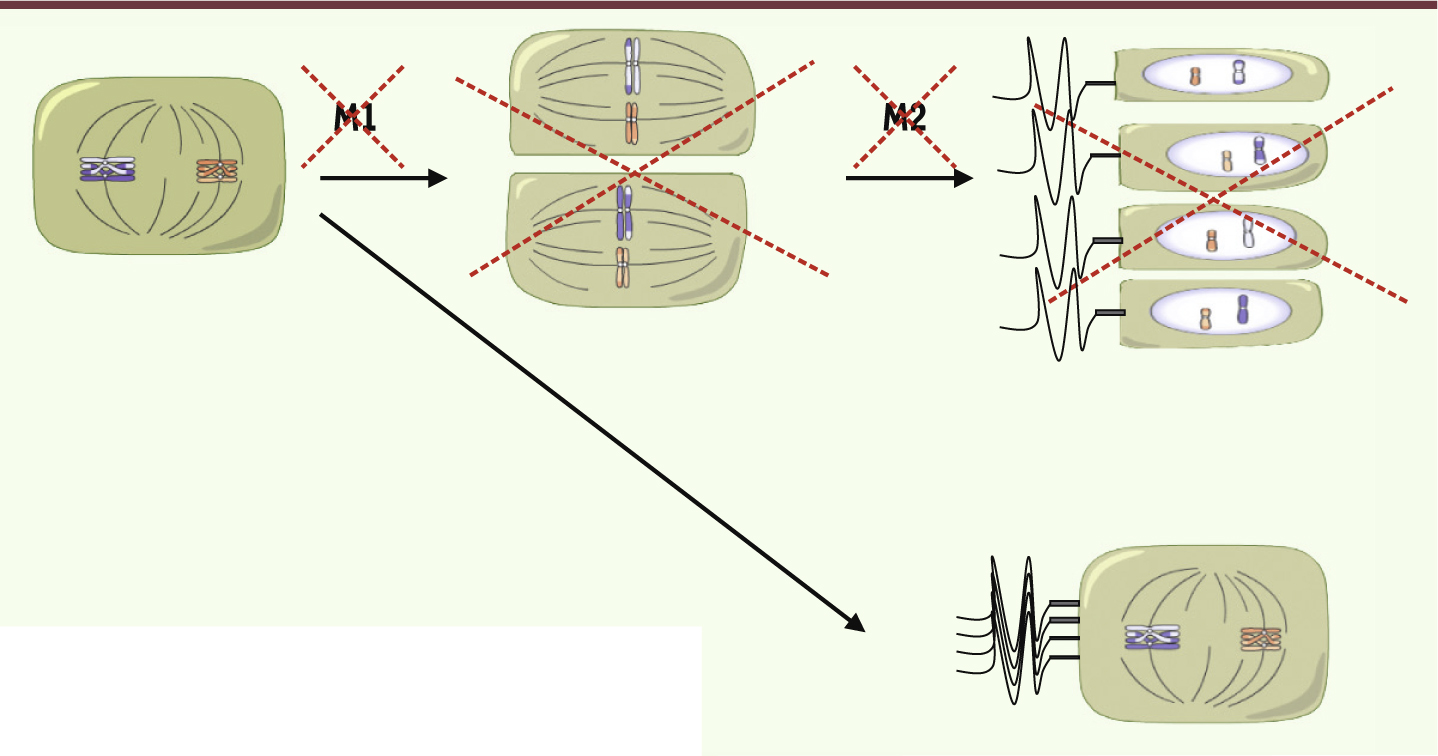
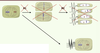 | Figure 3.
L’absence de la protéine AURKC entraîne un blocage des deux divisions méiotiques. Chez l’homme fertile, le spermatocyte (à gauche) va subir deux divisions méiotiques (M1, M2) qui vont permettre de produire quatre gamètes haploïdes (en haut). Le blocage méiotique pourrait se produire après la première division (M1) mais on a observé que les spermatozoïdes macrocéphales étaient tétraploïdes (en bas). On conclut donc que l’absence de la protéine fonctionnelle AURKC entraîne un blocage après la phase S de réplication de l’ADN et avant la première division méiotique. |
La prévalence de la mutation c.144delC dans la population générale nord-africaine est de 1/50, soit une fréquence de la maladie dans la population magrébine de l’ordre de 1/10 000. Cette fréquence est comparable à celle des microdélétions du chromosome Y [22]. Cette mutation n’est pas retrouvée si la proportion de spermatozoïdes macrocéphales est inférieure à 80 % [16, 24]. Elle n’a pas été retrouvée non plus chez des patients d’origine française. Une étude en cours dans notre laboratoire indique qu’une autre mutation récurrente du gène AURKC serait responsable de la majorité des cas observés chez des patients d’origine européenne. Chez les patients porteurs de la mutation du gène AURKC, les techniques d’AMP sont contre-indiquées en raison des échecs liés au contenu polyploïde des spermatozoïdes. Les patients sans mutation du gène AURKC ont une certaine proportion de spermatozoïdes phénotypiquement normaux et un meilleur pronostic d’AMP [25]. Une analyse préalable des spermatozoïdes par FISH permet donc de mieux apprécier les chances de réussite. |
DPY19L2 et spermatozoïdes globozoocéphales Le terme globozoocéphalie désigne des spermatozoïdes dont les têtes sont globuleuses et dépourvues d’acrosome. On distingue différents degrés de globozoocéphalie selon la proportion de spermatozoïdes dépourvus d’acrosome (Figure 1). Des cas de globozoospermies au sein d’une même fratrie ont orienté vers une origine génétique de cette tératozoospermie. Cette hypothèse a pu être rapidement confortée par la description de modèles murins présentant ce phénotype et déficients pour les gènes Csnk2a2, Gopc, Hrb, Pick1, Zpbp1, Ck2α’, Hsp90b1 et Gba2, et plus récemment Hsp90b1 et Vps54 [26]. Pour autant, aucune mutation n’a été trouvée sur les gènes humains orthologues sauf une mutation faux-sens sur le gène PICK1 (Protein interacting with C kinase 1 ou protein interacting with PRKCA 1) dans une famille chinoise [27] mais dont l’implication reste incertaine. Ceci illustre aussi que l’approche gène candidat, même fondée sur des données cliniques solides, reste difficile. Dernièrement, une mutation familiale dans le gène SPATA16 (spermatogenesis associated 16) a été décrite [15]. Cependant, aucune autre mutation de ce gène n’a pu être identifiée dans une large cohorte de patients globozoocéphales. Ces données suggèrent que malgré un phénotype commun, la globozoospermie n’est pas homogène du point de vue génétique. À partir d’une cohorte de patients tunisiens présentant un tableau clinique de globozoocéphalie avec 100 % de spermatozoïdes dépourvus d’acrosome, la stratégie de cartographie d’homozygotie a de nouveau permis d’identifier une région d’intérêt contenant le gène DPY19L2 exprimé principalement dans les testicules. Une délétion totale du gène DPY19L2 était présente chez 15 des 20 patients analysés [17]. L’analyse de la région entourant DPY19L2 a permis d’identifier des séquences dupliquées de type LCR (low copy repeat) situées de part et d’autre du gène. Ces séquences favorisent la survenue d’une délétion par un mécanisme de recombinaison homologue non allélique (NAHR). Ce mécanisme est connu en pathologie humaine [28]. Le résultat de cette recombinaison illégitime est la constitution de deux gamètes mâles, l’un porteur de deux copies du gène DPY19L2 (duplication) et l’autre dépourvu de copie (délétion) (Figure 4).
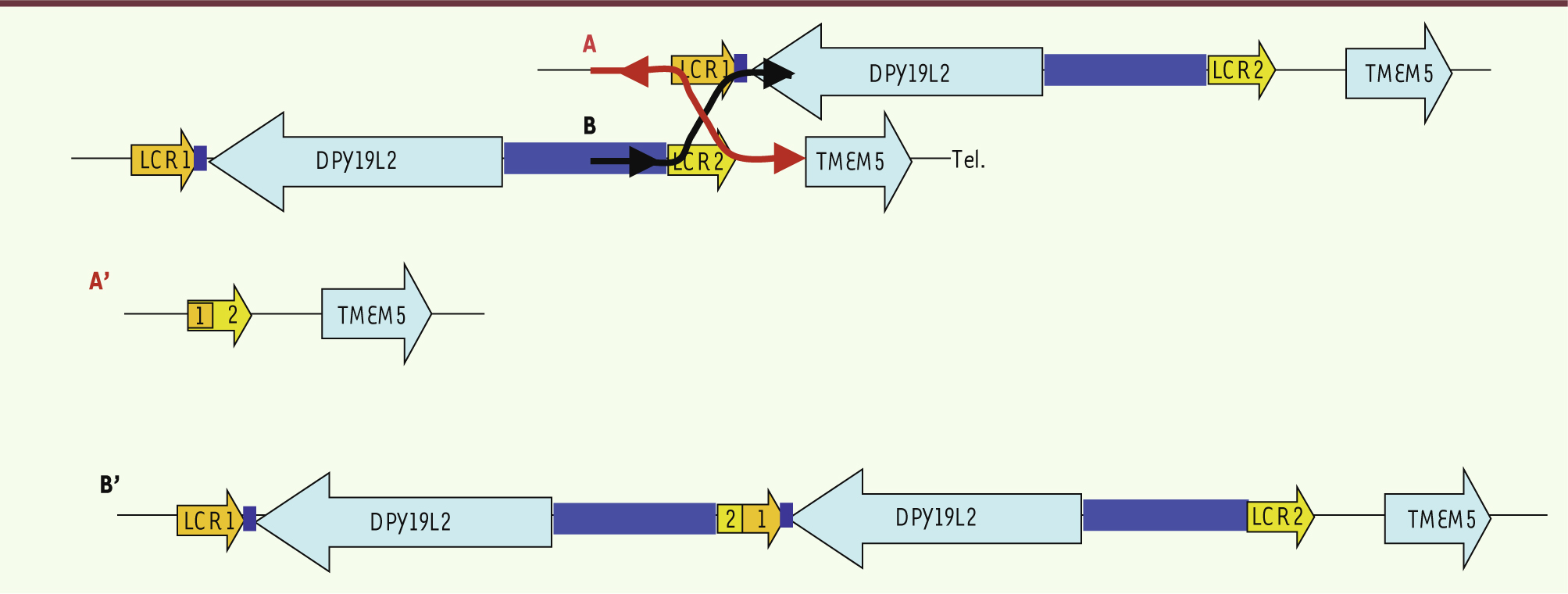
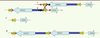 | Figure 4.
Mécanisme de recombinaison homologue non allélique (NAHR) interchromatidien au locus DPY19L2. Au cours de la méiose, du fait de l’homologie de séquences entre les LCR1 et LCR2, un décalage au niveau de l’appariement de ces séquences au locus DPY19L2 peut survenir. Les deux chromatides homologues s’apparient et recombinent pour donner (A, A’) un allèle dépourvu du gène DPY19L2, (B, B’) un allèle dupliqué avec deux copies de DPY19L2. |
La délétion du gène DPY19L2 est aujourd’hui l’anomalie génétique responsable de la très grande majorité des cas de globozoospermie. La fréquence de la délétion hétérozygote est estimée à environ 1/220 dans la population générale, soit une fréquence de la maladie proche de 1/200 000 alors que l’incidence de la globozoospermie est estimée à moins de 1 ‰ chez les hommes infertiles [18]. Il semble donc que d’autres gènes puissent être impliqués dans ce phénotype et, notamment, les différents gènes codant pour des protéines partenaires de DPY19L2. Chez l’homme, la fonction du gène DPY19L2 était jusqu’alors inconnue. Une seule étude avait démontré que DPY19, l’équivalent du gène humain chez le ver Caenorhabditis elegans, était nécessaire à la polarité et à la migration des neuroblastes durant la morphogenèse du nématode [29]. Le spermatozoïde, au même titre que les neurones, est une cellule polarisée. Par homologie, l’absence de la protéine DPY19L2 pourrait rendre compte de l’absence d’acrosome et de l’incapacité des spermatozoïdes des patients globozoocéphales à achever l’élongation de leur tête spermatique. La fécondation in vitro par ICSI (intracytoplasmic sperm injection) n’est pas contre-indiquée chez les patients ayant des spermatozoïdes globozoocéphales. En effet, le taux d’aneuploïdie dans les spermatozoïdes globozoocéphales n’est pas augmenté. Néanmoins, le succès des tentatives d’ICSI qui ont été décrites est très rare du fait du très faible pouvoir fécondant de ces spermatozoïdes. Ce défaut pourrait être lié à l’absence secondaire de phospholipase C zêta (PLCzêta) dans le spermatozoïde (→) ; cette enzyme est nécessaire au déclenchement des oscillations calciques lors de la fécondation, une étape requise pour l’activation ovocytaire. Si cette hypothèse était confirmée, l’utilisation de PLCzêta lors de la fécondation par ICSI représenterait alors une nouvelle possibilité thérapeutique [30, 31]. (→) Voir l’article de C. Arnoult et al., page 512 de ce numéro |
En plus des causes bien caractérisées des pathologies du spermatozoïde, l’utilisation des nouvelles techniques de génotypage pangénomique (puces à ADN de type SNP) a permis d’identifier de nouveaux gènes responsables de phénotypes rares d’infertilité masculine. Ces connaissances améliorent le diagnostic et la prise en charge du patient infertile. Elles permettent surtout de mieux comprendre les mécanismes fondamentaux de la spermatogenèse et pourraient, à terme, permettre des avancées thérapeutiques [32]. On peut donc espérer que les nouvelles technologies qui, actuellement, émergent rapidement, comme le séquençage à haut débit, permettront d’offrir, dans les années à venir, de nouvelles perspectives aussi bien fondamentales que diagnostiques et thérapeutiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1. World Health Organization . WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction . Cambridge: : Cambridge University Press; , 1999 : :138. p. 2. Boivin J, Bunting L, Collins JA, Nygren KG. International estimates of infertility prevalence and treatment-seeking: potential need and demand for infertility medical care . Hum Reprod. 2007; ; 22 : :1506.–1512. 3. Tuttelmann F, Simoni M, Kliesch S, et al. Copy number variants in patients with severe oligozoospermia, Sertoli-cell-only syndrome . PLoS One. 2011; ; 6 : :e19426.. 4. Ravel C, Berthaut I, Bresson JL, Siffroi JP. Prevalence of chromosomal abnormalities in phenotypically normal and fertile adult males: large-scale survey of over 10, 000 sperm donor karyotypes . Hum Reprod. 2006; ; 21 : :1484.–1489. 5. Gekas J, Thepot F, Turleau C, et al. Chromosomal factors of infertility in candidate couples for ICSI: an equal risk of constitutional aberrations in women and men . Hum Reprod. 2001; ; 16 : :82.–90. 6. Reijo R, Lee TY, Salo P, et al. Diverse spermatogenic defects in humans caused by Y chromosome deletions encompassing a novel RNA-binding protein gene . Nat Genet. 1995; ; 10 : :383.–393. 7. Vogt PH. Azoospermia factor (AZF) in Yq11: towards a molecular understanding of its function for human male fertility and spermatogenesis . Reprod Biomed Online. 2005; ; 10 : :81.–93. 8. Foresta C, Moro E, Ferlin A. Prognostic value of Y deletion analysis. The role of current methods . Hum Reprod. 2001; ; 16 : :1543.–1547. 9. Dumur V, Gervais R, Rigot JM, et al. Congenital bilateral absence of the vas deferens (CBAVD) and cystic fibrosis transmembrane regulator (CFTR): correlation between genotype and phenotype . Hum Genet. 1996; ; 97 : :7.–10. 10. Stuppia L, Antonucci I, Binni F, et al. Screening of mutations in the CFTR gene in 1195 couples entering assisted reproduction technique programs . Eur J Hum Genet. 2005; ; 13 : :959.–964. 11. Tuttelmann F, Werny F, Cooper TG, et al. Clinical experience with azoospermia: aetiology and chances for spermatozoa detection upon biopsy . Int J Androl. 2011; ; 34 : :291.–298. 12. Matzuk MM, Lamb DJ. The biology of infertility: research advances and clinical challenges . Nat Med. 2008; ; 14 : :1197.–1213. 13. Papaioannou MD, Nef S. MicroRNAs in the testis: building up male fertility . J Androl. 2010; ; 31 : :26.–33. 14. Tuttelmann F, Rajpert-De Meyts E, Nieschlag E, Simoni M. Gene polymorphisms and male infertility-a meta-analysis and literature review . Reprod Biomed Online. 2007; ; 15 : :643.–658. 15. Dam AH, Koscinski I, Kremer JA, et al. Homozygous mutation in SPATA16 is associated with male infertility in human globozoospermia . Am J Hum Genet. 2007; ; 81 : :813.–820. 16. Dieterich K, Soto Rifo R, Faure AK, et al. Homozygous mutation of AURKC yields large-headed polyploid spermatozoa and causes male infertility . Nat Genet. 2007; ; 39 : :661.–665. 17. Harbuz R, Zouari R, Pierre V, et al. A recurrent deletion of DPY19L2 causes infertility in man by blocking sperm head elongation and acrosome formation . Am J Hum Genet. 2011; ; 88 : :351.–361. 18. Koscinski I, Elinati E, Fossard C, et al. DPY19L2 deletion as a major cause of globozoospermia . Am J Hum Genet. 2011; ; 88 : :344.–350. 19. Ben Khelifa M, Zouari R, Harbuz R, et al. A new AURKC mutation causing macrozoospermia: implications for human spermatogenesis and clinical diagnosis . Mol Hum Reprod. 2011; ; 17 : :762.–768. 20. Dieterich K, Zouari R, Harbuz R, et al. The Aurora kinase C c.144delC mutation causes meiosis I arrest in men and is frequent in the North African population . Hum Mol Genet. 2009; ; 18 : :1301.–1309. 21. Nistal M, Paniagua R, Herruzo A. Multi-tailed spermatozoa in a case with asthenospermia and teratospermia . Virchows Arch B Cell Pathol. 1977; ; 26 : :111.–118. 22. Harbuz R, Zouari R, Dieterich K, et al. Function of aurora kinase C (AURKC) in human reproduction . Gynecol Obstet Fertil. 2009; ; 37 : :546.–551. 23. Devillard F, Metzler-Guillemain C, Pelletier R, et al. Polyploidy in large-headed sperm: FISH study of three cases . Hum Reprod. 2002; ; 17 : :1292.–1298. 24. Guthauser B, Albert M, Ferfouri F, et al. Inverse correlation between chromatin condensation and sperm head size in a case of enlarged sperm heads . Reprod Biomed Online. 2011; ; 23 : :711.–716. 25. Ray PF. Predictable male causes of in vitro fertilization (IVF) with intra cytoplasmic sperm injection (ICSI) failure . Gynecol Obstet Fertil. 2010; ; 38 : :114.–118. 26. Dam AH, Feenstra I, Westphal JR, et al. Globozoospermia revisited . Hum Reprod Update. 2007; ; 13 : :63.–75. 27. Liu G, Shi QW, Lu GX. A newly discovered mutation in PICK1 in a human with globozoospermia . Asian J Androl. 2010; ; 12 : :556.–560. 28. Stankiewicz P, Lupski JR. Structural variation in the human genome and its role in disease . Annu Rev Med. 2010; ; 61 : :437.–455. 29. Honigberg L, Kenyon C. Establishment of left/right asymmetry in neuroblast migration by UNC-40/DCC, UNC-73/Trio and DPY-19 proteins in C. elegans . Development. 2000; ; 127 : :4655.–4668. 30. Ray PF, Arnoult C. La délétion homozygote du gène DPY19L2 est responsable de la majorité des cas de globozoospermie . Med Sci (Paris). 2011; ; 27 : :692.–693. 31. Arnoult C, Escoffier J, Munch L, et al. Les phospholipases, enzymes clés de la physiologie spermatique : quels enjeux thérapeutiques ? Med Sci (Paris). 2012; ; 28 : :512.–518. 32. Ray PF. Deciphering the genetics of male infertility: progress and challenges . J Urol. 2011; ; 186 : :1183.–1184. |