| |
| Med Sci (Paris). 2012 May; 28(5): 534–542. Published online 2012 May 30. doi: 10.1051/medsci/2012285020.Recherche de substances naturelles à activité thérapeutique Pierre Potier (1934-2006) Pierre P.J. Da Silva1,2** and Laurent Meijer1,3* 1CNRS, USR3151, phosphorylation de protéines et pathologies humaines, station biologique, 29680Roscoff, France 2Université de Bordeaux - sciences, philosophie, humanités (SPH), EA 4574, 33400Talence, France 3ManRos Therapeutics, centre de Perharidy, 29680Roscoff, France MeSH keywords: Antinéoplasiques d'origine végétale, isolement et purification, usage thérapeutique, Facteurs biologiques, composition chimique, Produits biologiques, pharmacologie, toxicité, Chimie pharmaceutique, histoire, Découverte de médicament, méthodes, tendances, Histoire du 20ème siècle, Histoire du 21ème siècle, Humains, Modèles biologiques, Modèles moléculaires, Disciplines des sciences naturelles, Vinblastine |
|
Série « Pionniers de la découverte de substances naturelles à activité thérapeutique » Avant-propos La plupart de nos médicaments sont issus, dérivés ou inspirés de substances naturelles. Leur identification initiale, leur synthèse chimique, leur production industrielle, leur développement pharmaceutique et leurs applications thérapeutiques variées sont, pour chacun, une histoire exemplaire unique, le fruit de longs travaux parsemés d’échecs, de découvertes inattendues. Ils sont le fruit d’un mélange de chance, de sagacité et de ténacité qui permet parfois aux recherches les plus fondamentales de trouver des applications majeures. Dans cette série d’articles d’histoire des sciences qui commence par Pierre Potier, nous illustrerons le parcours scientifique de chercheurs de renom qui ont mis leur énergie, leur enthousiasme, leur imagination, leur génie et leur patience au service de la découverte de substances naturelles à activité thérapeutique.
|
Depuis les années 1940 jusqu’à aujourd’hui, les composés naturels ou issus de composés naturels représentent 55 % des produits mis sur le marché en oncologie. Selon Newman et Cragg [
1], si l’on considère uniquement les petites molécules (sont exclus les vaccins et les composés biologiques), ce pourcentage atteint près de 80 % des médicaments pour la période 1981-2010, et 65 % depuis la commercialisation du premier anticancéreux dans les années 1940 [1]. La nature et sa diversité chimique gigantesque constituent donc un réservoir immense de molécules bioactives au potentiel thérapeutique vaste. Un « coffre aux trésors » de molécules à identifier, produire et appliquer aux pathologies qui nous touchent ! Le chemin qui conduit d’une substance naturelle produite par un organisme vivant (plante, invertébré, bactérie) jusqu’à l’arrivée sur le marché d’un médicament efficace n’est pas un long fleuve tranquille ! Ce long parcours, où le succès fait figure d’exception, s’étend sur de nombreuses années (plus de 12 années en moyenne) et requiert des dépenses considérables (près d’un milliard d’euros). La purification et la détermination de la structure chimique d’une substance naturelle, processus en soi déjà très complexes, n’en sont que la toute première étape. La molécule purifiée (ou resynthétisée car le problème d’approvisionnement est souvent un premier obstacle) subit de nombreux tests précliniques (souvent éliminatoires) : criblages moléculaires et/ou cellulaires, identification du mécanisme d’action moléculaire, optimisation chimique (relation structure/activité), études sur protéines purifiées (cristallisation, interaction, effet sur une activité enzymatique, etc.), modèles cellulaires et modèles animaux de la pathologie, études de toxicité, sélection d’une voie d’administration optimale, études pharmacocinétiques, métabolisme, optimisation de la production de la molécule dans des conditions industrielles très strictes. La molécule active peut ensuite subir des études cliniques chez l’homme : toxicité (phase I), efficacité (phase II), efficacité comparée avec les traitements usuels (phase III). Ce n’est qu’à l’issue de la traversée de ce « cimetière de médicaments » que la molécule peut obtenir l’autorisation de mise sur le marché (AMM), ce qui ne la dispensera pas d’un suivi (phase IV) des patients traités, permettant d’identifier des effets secondaires imprévus et non détectés au cours des phases précédentes, aboutissant au retrait éventuel du marché ! L’histoire montre que beaucoup de molécules à visée thérapeutique développées par des sociétés pharmaceutiques ont, en fait, été découvertes dans des laboratoires académiques. Est ce la conséquence de la liberté de recherche qui règne (ou devrait régner) dans nos laboratoires académiques, et permet d’explorer des voies qui ne sont pas nécessairement rentables à court terme ? En tous cas, c’est toujours un continuum de la recherche fondamentale vers la recherche appliquée, souvent de la recherche publique vers la recherche privée, qui accompagne la mise au point d’un médicament à partir d’une substance naturelle. L’histoire des découvertes de Pierre Potier est à ce titre exemplaire. La fabrication de médicaments directement à partir de substances naturelles extraites des organismes vivants pose rapidement le problème de l’approvisionnement en matière première. Tel a été le cas pour le Taxol de l’if et les alcaloïdes de la pervenche de Madagascar. De nombreuses équipes dans le monde entier se sont heurtées à la difficulté de la synthèse de ces molécules naturelles complexes comportant souvent plusieurs carbones asymétriques, et donc la synthèse chimiquement possible de nombreux isomères, alors que l’organisme vivant ne synthétise en général qu’un seul composé. C’est en combinant extraction de substances naturelles et synthèse organique (hémisynthèse1) que Pierre Potier et son équipe ont découvert de nouvelles molécules de grand intérêt pour le traitement des cancers (Taxotère® et Navelbine®). |
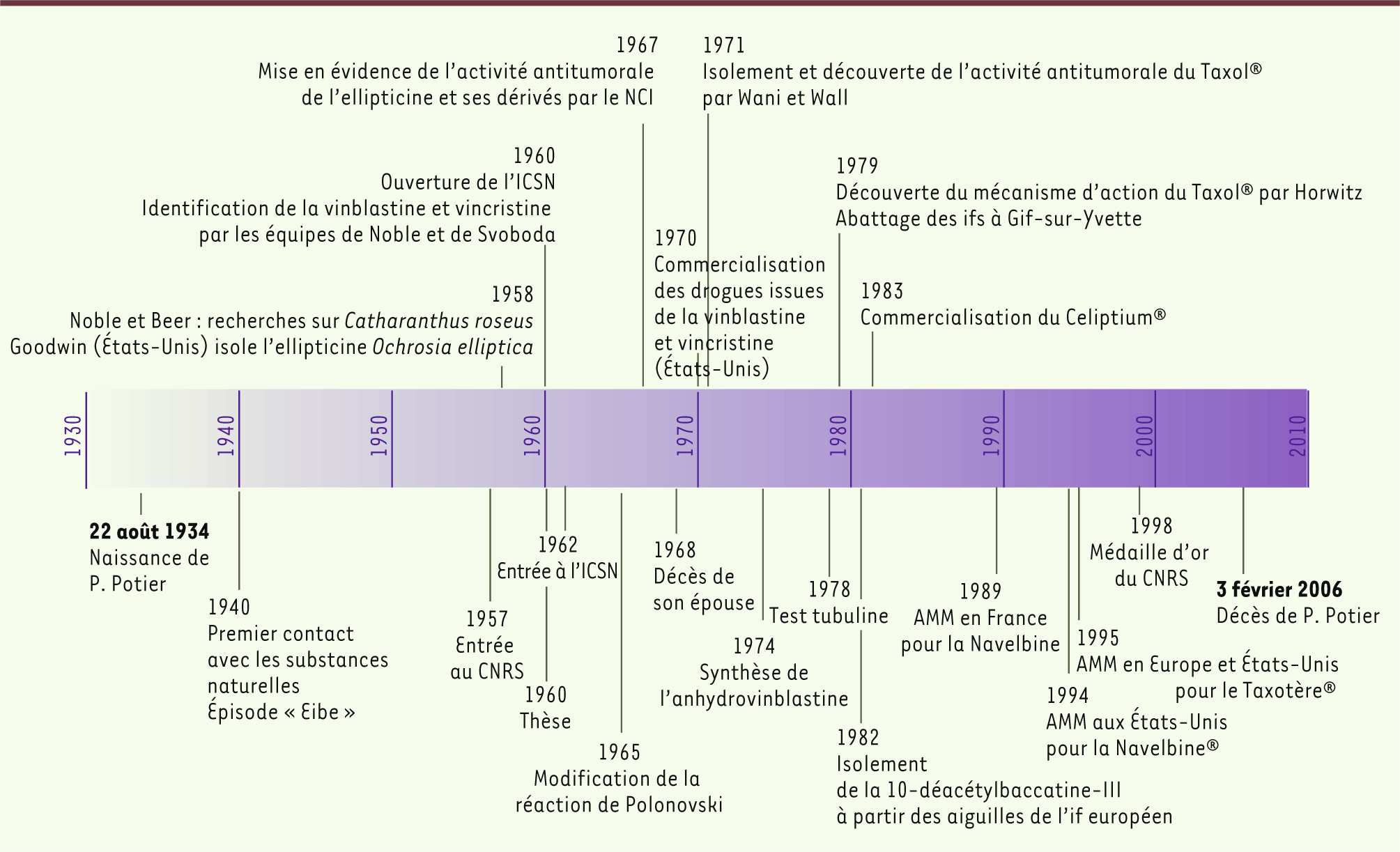
Le parcours de Pierre Potier Pierre Potier (Figure 1) voit le jour le 22 août 1934 à Bois-Colombes. C’est en 1940 à Gouville, où il est réfugié avec sa famille pendant l’occupation, que naît sa passion pour les substances naturelles. Il assiste à l’arrivée de la cavalerie allemande, et quand plusieurs chevaux sont retrouvés morts, les allemands accusent les villageois. Ces derniers sont innocentés par un vétérinaire allemand qui, après autopsie des chevaux, conclut à un empoisonnement après ingestion de fruits et d’aiguilles d’if. C’est ainsi que Pierre Potier apprend, quarante ans avant de l’étudier chimiquement, que l’if est très toxique pour les animaux, mais aussi pour l’homme.
 | Figure 1.
Pierre Potier. A. À l’époque de la synthèse du Taxotère®. De gauche à droite, Pierre Potier, Françoise Guéritte, Daniel Guénard (1987). B. Pierre Potier dans son bureau à l’ICSN. |
Pierre Potier poursuit ses études dans le domaine des substances naturelles (Figure 2). En 1952, il obtient le certificat d’études supérieures de sciences portant sur la physique, la chimie et l’histoire naturelle (SPCN), en 1953 un diplôme de botanique générale et physiologie végétale à la Sorbonne, et en 1955 un diplôme en chimie générale et en chimie approfondie ; il achève son cursus de pharmacien en 1957. À cette époque, le double cursus est interdit, mais Pierre Potier prend le risque : « On ne pourrait pas me déchoir des diplômes que j’avais acquis même de manière illicite ! ».
 | Figure 2.
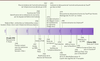
Chronologie des évènements clés de la vie de Pierre Potier.
|
Pierre Potier intègre le CNRS en 1957 comme stagiaire de recherches et entame une thèse de Doctorat ès Sciences sous la direction de Jean Le Men dans le laboratoire de Maurice-Marie Janot (laboratoire de pharmacie galénique de la faculté de pharmacie de Paris) sur le thème des alcaloïdes de Lunaria biennis [
2]. En 1960, il part en Écosse (Glasgow) dans le laboratoire de Peter Bladon pour compléter ses recherches et soutenir sa thèse le 21 décembre de cette même année. Après son service militaire en 1961-1962, il entre à l’institut de chimie des substances naturelles (ICSN), ouvert en octobre 1960 à Gif-sur-Yvette, où il retrouve ses mentors, Jean Le Men et Maurice-Marie Janot2. Il poursuit ses recherches sur les alcaloïdes, et en particulier les dérivés N-oxydes d’alcaloïdes. Pierre Potier, Adrien Cavé et Alain Ahond modifient alors la réaction d’oxydation des alcaloïdes, dite « réaction des frères Polonovski » [
3]. L’anhydride acétique étant remplacé par l’anhydride trifluoroacétique, la réaction permet de déméthyler des amines tertiaires dans la série des alcaloïdes. Cette innovation constitue un apport majeur dans l’hémisynthèse des molécules d’intérêt thérapeutique puisqu’elle copie la voie de synthèse naturelle de ces molécules, et notamment celle des vinca-alcaloïdes comme la vinblastine [
4]. À la mort de son épouse en 1968, des suites d’un cancer, Pierre Potier décide de se consacrer en grande partie à la lutte contre ce fléau. |
La synthèse de la vinblastine et la découverte de la Navelbine ®
En 1958, la pervenche de Madagascar, Catharanthus roseus, fait déjà partie de nombreuses pharmacopées exotiques, notamment en tant qu’antidiabétique (prescrit en Jamaïque). Pour vérifier cet effet thérapeutique, deux chercheurs canadiens, Robert L. Noble et Charles T. Beer, injectent des extraits de cette plante à des rats et constatent leur mort par effondrement du nombre de globules blancs (leucopénie) [
5]. Ils infirment l’effet antidiabétique, mais découvrent un effet antileucémique [
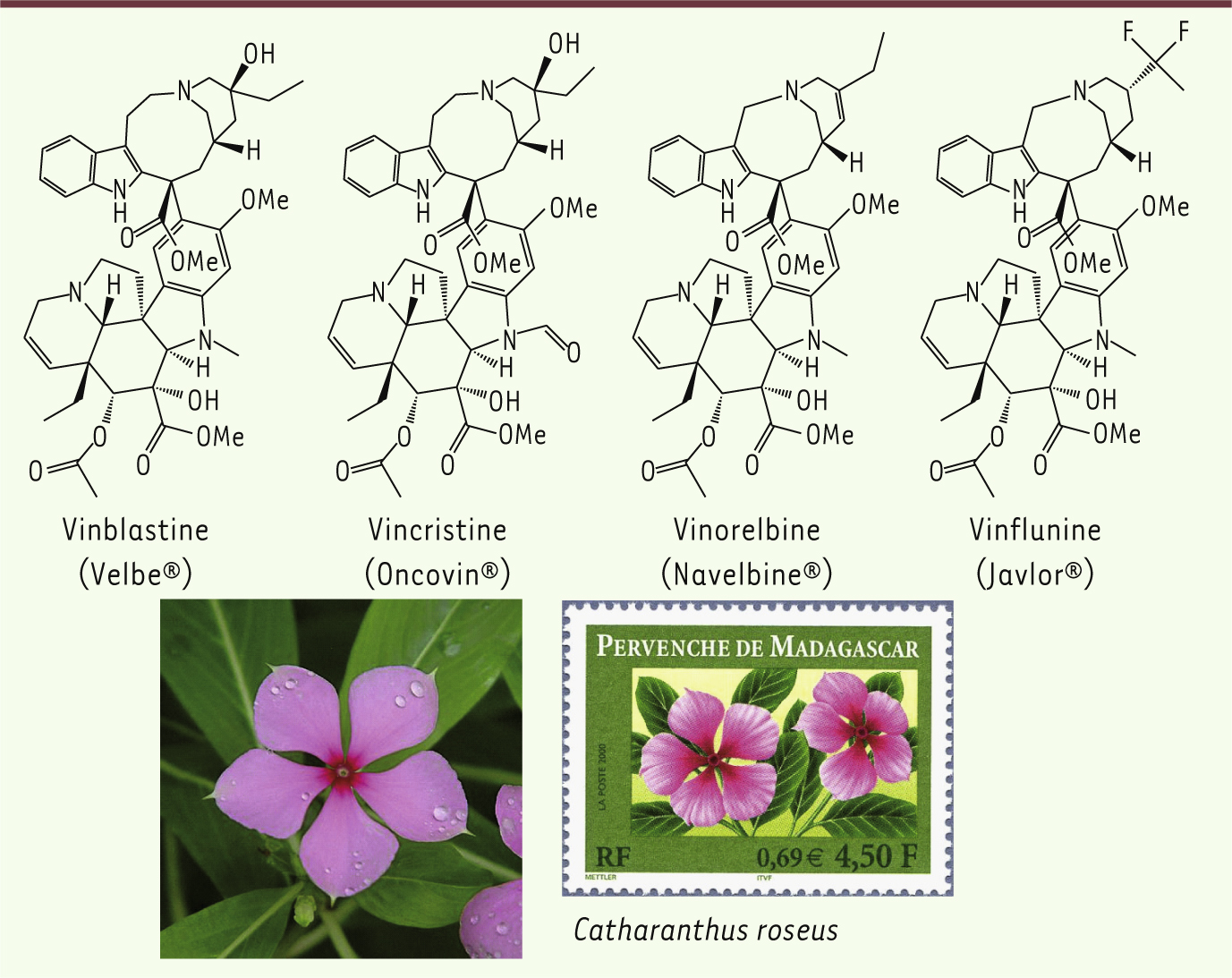
6]. Ils identifient ensuite la vinblastine comme la molécule responsable de cette action. Parallèlement, l’équipe de Gordon H. Svoboda, de la société Eli Lilly à Indianapolis (États-Unis), teste un grand nombre de plantes sur des souris leucémiques et isole aussi la vinblastine [4] et un autre alcaloïde, la vincristine [4] (Figure 3). La collaboration entre ces deux équipes aboutit, dans les années 1960, à deux médicaments destinés à la chimiothérapie anticancéreuse, Velbé® et Oncovin® [
7]. Mais les chimistes se heurtent à la complexité de la synthèse de ces substances, et la société Eli Lilly rencontre d’importants problèmes d’approvisionnement en matière première, ce qui rend le prix du médicament excessif. En effet, la vinblastine et la vincristine sont isolées en très faibles quantités de la pervenche de Madagascar (environ 0,3-1 g de vincristine et 6-10 g de vinblastine par tonne de pervenche), et la production de ces médicaments uniquement par l’extraction des substances naturelles aurait exigé d’immenses plantations.
 | Figure 3.
Structures des vinblastine (Velbe®), vincristine (Oncovin®), vinorelbine (Navelbine®) et vinflunine (Javlor®). La pervenche de Madagascar, Catharanthus roseus, une plante originaire de Madagascar. De nombreux timbres, ici un timbre français édité en 2000, célèbrent l’importance thérapeutique de cette plante. |
Pierre Potier et son équipe, composée des chercheurs Nicole et Yves Langlois et de Françoise Guéritte, alors étudiante en thèse (Figure 1), profitent de la récente mise au point de la réaction Polonovski-Potier pour tenter la synthèse de l’anhydrovinblastine, qui aurait constitué l’avant-dernière étape de la synthèse de la vinblastine, permettant ainsi de s’affranchir de sa production naturelle par la plante. Ils réussissent en 1974 à synthétiser l’anhydrovinblastine à partir de précurseurs présents en plus grande quantité dans la plante (catharanthine et vindoline) [
8]. En essayant de l’hydrater pour obtenir la vinblastine, un thésard d’Yves Langlois, Pierre Mangeney, remarque lors d’une analyse chromatographique une minuscule tache bleue qui ne correspond pas à la molécule recherchée. Il s’agit d’une nouvelle molécule, qui n’est pas produite naturellement par la plante. Celle-ci, la nor-anhydrovinblastine [
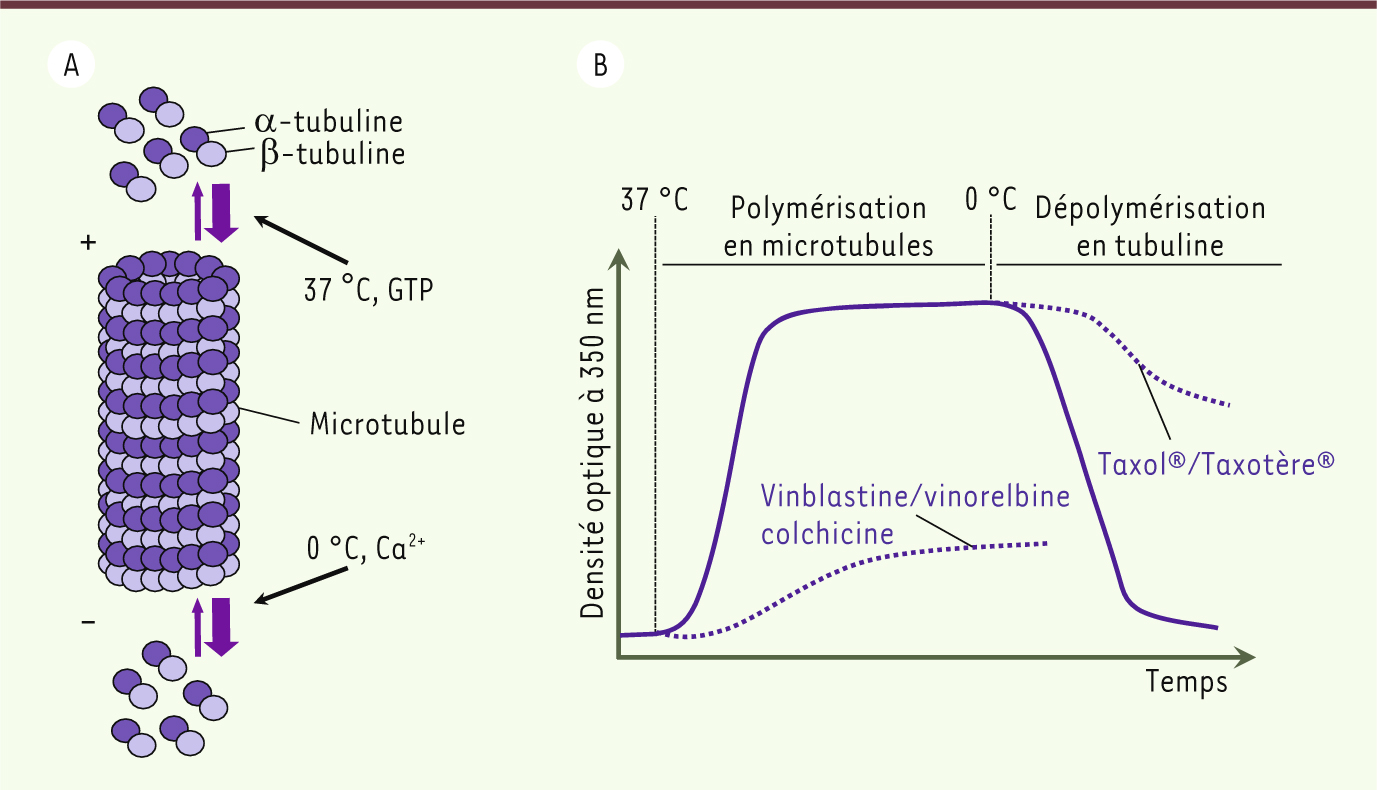
9], se révèle positive dans un test dit « test de la tubuline », mis au point par Daniel Guénard, et qui détecte en spectrométrie tout composé chimique qui inhibe ou, au contraire, favorise la polymérisation des microtubules en se fixant sur la tubuline (Figures 1 et 4) [
10]. En effet, les molécules de tubuline forment des dimères qui polymérisent en microtubules in vitro dans certaines conditions (Figure 4).
 | Figure 4.
Polymérisation de la tubuline en microtubules. A. Assemblage des dimères d’α- et de β-tubulines à l’extrémité + des microtubules (polymérisation) et désassemblage à l’extrémité – (dépolymérisation). B. Le test tubuline in vitro. À 37 °C, les dimères de tubulines polymérisent en microtubules (polymérisation mesurée par une augmentation de la densité optique à 350 nm). Cet effet est inhibé par les inhibiteurs de type vinblastine/vinorelbine ou colchicine. À 0 °C, les microtubules se dépolymérisent. Cet effet est inhibé par les inhibiteurs de type Taxol®/Taxotère®. |
Ce cycle de polymérisation/ dépolymérisation de la tubuline est essentiel au remodelage cellulaire lors de la mitose. Dans une tumeur, les cellules se divisent de façon anarchique. En bloquant l’assemblage et le désassemblage des microtubules, la mitose est bloquée et la mort cellulaire est induite. Ce test in vitro permet donc d’identifier facilement et rapidement des composés antiprolifératifs. La nor-anhydrovinblastine s’est donc avérée être un bon candidat pour le développement d’un médicament anticancéreux [9]. Françoise Guéritte (Figure 1), Zo R. Andriamialisoa et Pierre Mangeney parviennent à en produire 10 g, qui seront conditionnés à la pharmacie centrale des hôpitaux de Paris. Sa toxicologie et ses effets antitumoraux seront évalués au laboratoire de pharmacologie et de toxicologie fondamentales du CNRS à Toulouse, dirigé par Claude Paoletti. La fenêtre thérapeutique étant favorable (la concentration toxique est suffisamment éloignée de la concentration efficace), l’hôpital Paul Brousse de Villejuif (Service du Pr Georges Mathé) se lance dans des études cliniques. Celles-ci confirment l’excellente efficacité du nouveau produit3. Pour un développement industriel, Pierre Potier s’adresse à Rhône-Poulenc, leur partenaire pour le développement de molécules issues de la pervenche. Mais la firme, confrontée à des difficultés financières, ne souhaite pas s’investir. Pierre Potier cherche alors le soutien de Roussel Uclaf, de Servier, d’Eli Lilly. Et c’est finalement Pierre Fabre, via l’agence nationale de valorisation de la recherche (ANVAR) qui, convaincu par la ténacité de Pierre Potier, accepte de développer la molécule anticancéreuse. L’autorisation de mise sur le marché (AMM) est obtenue en 1989 et la nor-anhydrovinblastine devient la Navelbine®, dont la diffusion sur le marché américain sera acceptée par la Food and Drug Administration (FDA) en 1994 [
11]. La Navelbine® est utilisée dans plus de 80 pays et a apporté un bénéfice thérapeutique à plus d’un million de personnes dans le monde, notamment dans les cancers du poumon et du sein. En 2009, les laboratoires Pierre Fabre ont mis sur le marché un dérivé fluoré, la vinflunine (Javlor®) (Figure 3), utilisé en seconde ligne dans le traitement du cancer de la vessie. |
La synthèse du Taxol ® et la découverte du Taxotère ®
En 1964, dans le cadre d’une campagne de recherches du National Cancer Institute (NCI), le botaniste Arthur Barclay participe à l’échantillonnage de la flore nord-américaine. Des extraits d’ifs du Pacifique (Taxus brevifolia) sont envoyés au laboratoire de Mansukh Wani et Monroe Wall qui détectent un effet antitumoral [
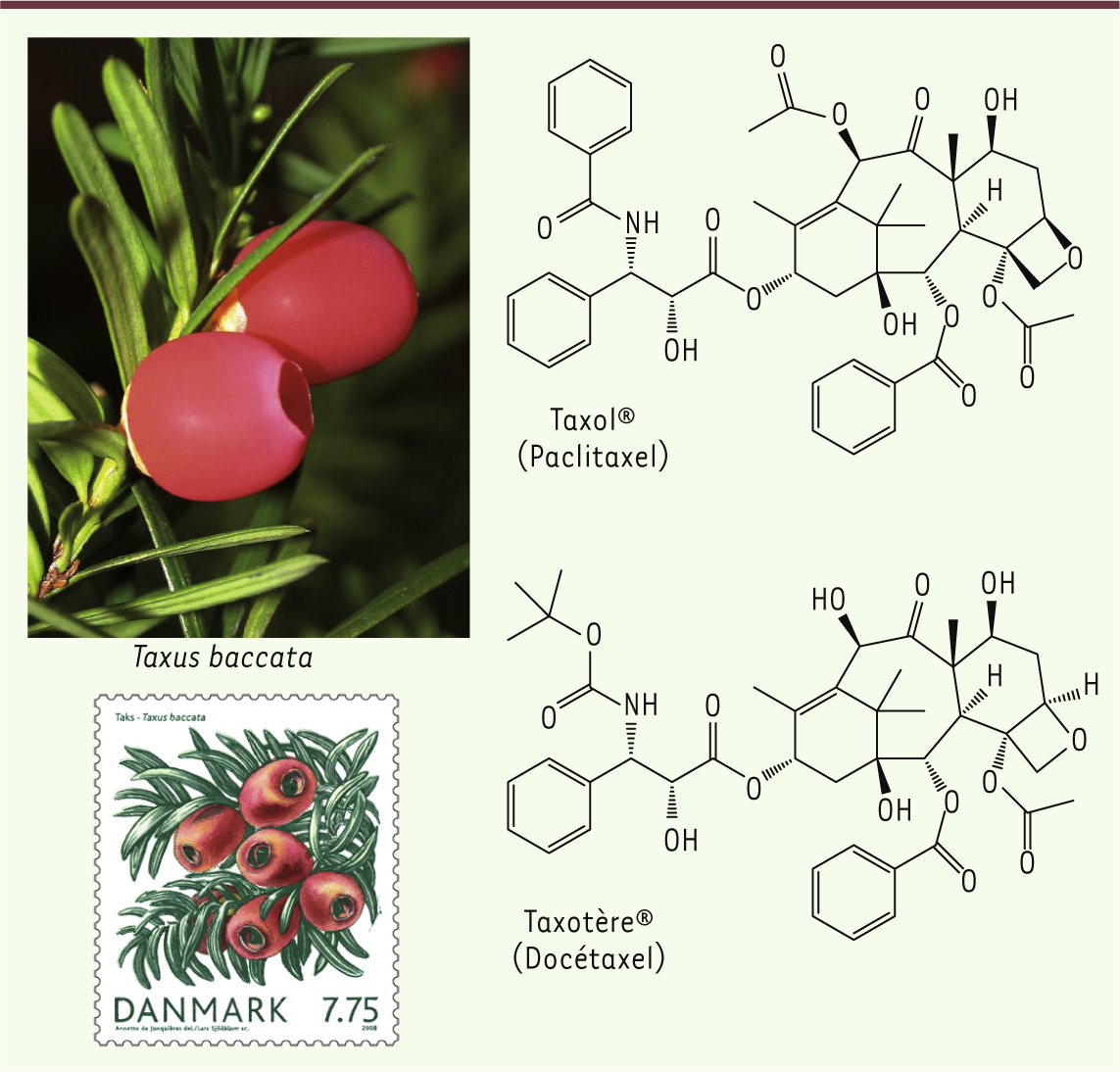
12]. Ce n’est qu’en 1971 que Mansukh Wani isole la molécule responsable et la baptise Taxol® [12] (Figure 5). Son mode d’action reste inexpliqué, et compte tenu des difficultés d’approvisionnement et de solubilité, la molécule tombe dans l’oubli.
 | Figure 5.
Structure du Taxol® (Paclitaxel) et du Taxotère® (Docétaxel). Les aiguilles et le fruit de l’if commun (Taxus baccata) sont illustrés (photographie Kevin C Nixon). Un timbre édité au Danemark souligne l’importance de cette plante dans le traitement du cancer. |
En 1979, Susan Horwitz découvre que le Taxol® appartient à la classe des poisons du fuseau mitotique (dont font partie les alcaloïdes de la pervenche) qui interviennent dans les processus d’assemblage et de désassemblage des microtubules conduisant au blocage de la cellule dans l’une des phases du cycle et à sa mort. L’étude des mécanismes d’action moléculaire de ces composés a montré qu’ils interagissent avec la tubuline à des sites divers de la protéine : le taxol et ses dérivés favorisent l’assemblage des doublets de tubuline et conduisent à une stabilisation des microtubules, la vinblastine et ses dérivés, au contraire, favorisent leur dépolymérisation (Figure 4) [
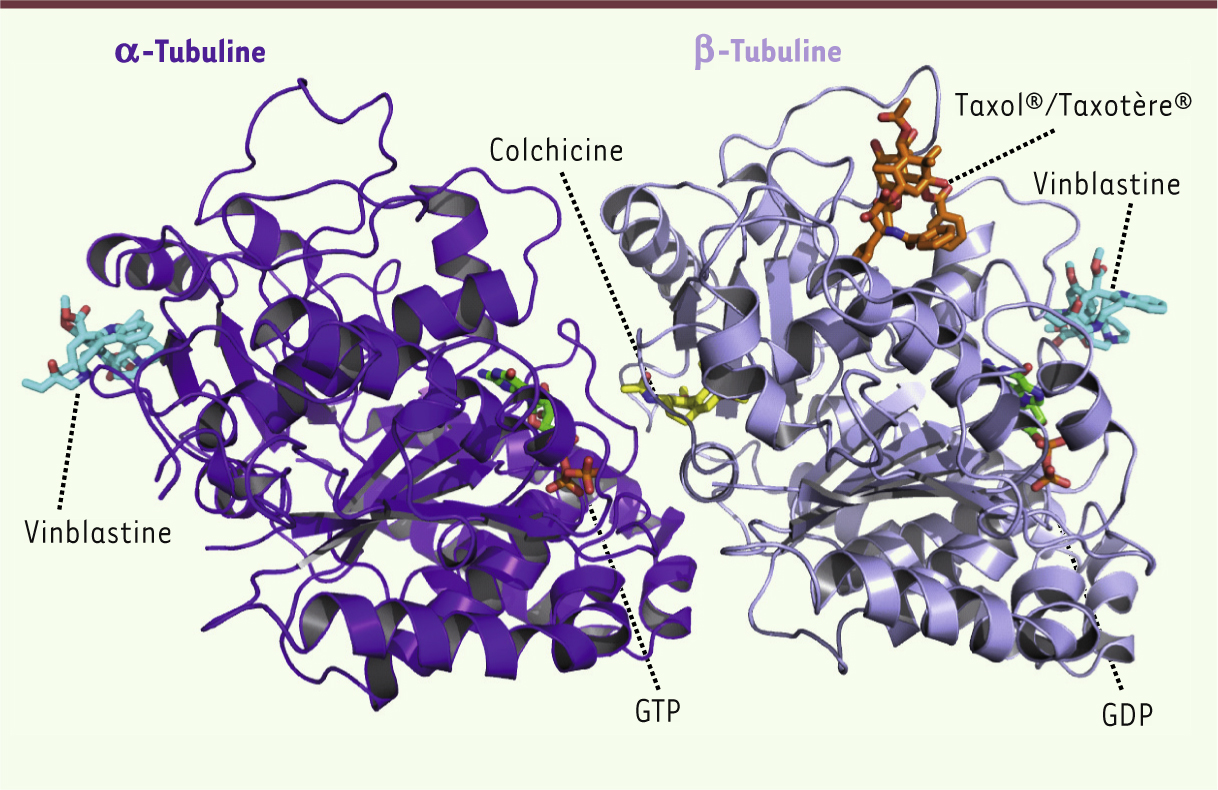
13]. La cocristallisation de la tubuline avec ces différents inhibiteurs à montré que ces derniers se fixent sur des sites différents : le taxol/taxotère se fixe sur la β-tubuline, la colchicine se localise à l’interface α-tubuline/β-tubuline, et les alcaloïdes Vinca empêchent l’assemblage des dimères α-tubuline/β-tubuline en polymères (Figure 6) [
14]. Le Taxol® redevient alors une molécule d’un grand intérêt thérapeutique. Cependant, l’approvisionnement reste toujours problématique et pose même un problème écologique crucial. En effet, l’abattage et l’extraction de huit tonnes d’écorces n’avaient permis l’extraction que de 1,3 kg de Taxol®. Cela amena de nombreux chimistes à rechercher une méthode de synthèse pour produire le Taxol® de façon plus efficace. Fin 1979, plusieurs ifs européens (Taxus baccata) centenaires doivent être abattus pour permettre la construction d’une route sur le campus de Gif-sur-Yvette. Pierre Potier et Daniel Guénard profitent de cette opportunité pour analyser chimiquement toutes les parties de l’if. Ils découvrent ainsi dans les aiguilles une substance intéressante, active dans le test à la tubuline, la 10-déacétyl-baccatine III (DAB) [
15]. Pierre Potier, Françoise Guéritte et d’autres thésards de l’équipe tentent de greffer la chaîne latérale qui manque au DAB pour obtenir le Taxol®. Après des essais infructueux, ils parviennent tout de même à isoler 12 mg d’un composé intermédiaire : le N-débenzoyl-Ntert-butoxycarbonyl-10-déacétyl taxol, ou docétaxel (Figure 5), qui s’avère deux fois plus actif que le Taxol® dans le test tubuline [
16].
 | Figure 6.
Cocristallisation du dimère d’α -tubuline (mauve foncé) et de b -tubuline (mauve clair) associés à différentes molécules inhibitrices. Le nucléotide (GTP sur α- tubuline, GDP sur β-tubuline) est en vert avec la chaîne de phosphate en orange, la colchicine en jaune, le Taxol ®/Taxotère ® est en orange et la vinblastine en cyan (figure composite adaptée d’après la figure 7 de Gigant et al. [
17]). La vinblastine empêche la polymérisation des dimères α- tubuline/β-tubuline en microtubules. |
Cette fois, Rhône-Poulenc, sous la direction de François Lavelle, directeur de la recherche en cancérologie, ne laisse pas passer l’occasion et, en 1985, investit massivement dans le développement du docétaxel. L’équipe de Pierre Potier récolte la tonne d’aiguilles nécessaire pour les études toxicologiques. Après des résultats prometteurs, les chimistes de Rhône-Poulenc réussissent à mettre au point un procédé industriel permettant de produire la molécule en grande quantité. Les essais cliniques débutent en 1990 en France, au Royaume-Uni et aux États-Unis, et confirment la très bonne activité anticancéreuse du nouveau produit [17]. En 1995, le docétaxel est commercialisé sous le nom de Taxotère®. Ce médicament, distribué dans plus de 86 pays, fait partie des cinq traitements anticancéreux les plus vendus au monde. Le Taxotère®, qui génère un chiffre d’affaires de 1,61 milliards d’euros en 2005, s’est hissé au 3e rang des médicaments de Sanofi-Aventis (Rhône-Poulenc a fusionné en 1999 avec Hoechst Marion Roussel et en 2004 avec Sanofi-Synthélabo) après le Lovenox® (héparine de bas poids moléculaire) et le Plavix® (antiaggrégant plaquettaire, clopidogrel). Le CNRS a perçu 240 millions d’euros de royalties en dix ans pour la valorisation commerciale du travail de ses équipes. La somme récoltée en 2005 représentait 90 % des redevances totales perçues par le CNRS pour l’ensemble de ses brevets [
18]. Le Taxol® fut également préparé par certains groupes américains à partir de la DAB selon le procédé breveté par Potier. Rhône Poulenc démontra qu’il y avait eu fraude en analysant les impuretés mineures présentes dans du taxol commercialisé qui prouvaient que le procédé de fabrication impliquait la DAB et non la récupération de l’écorce de l’if du Pacifique. La mise au point de la Navelbine® et celle du Taxotère® a suivi le même schéma : étape initiale de purification et d’identification d’une molécule d’intérêt extraite d’une plante, puis abandon des recherches en raison du problème d’approvisionnement et de la complexité de synthèse de ces molécules ; étape ultérieure d’extraction de produits naturels secondaires ou de précurseurs de la molécule initiale, puis hémisynthèse permettant de contourner le problème et d’aboutir à la production industrielle du médicament. |
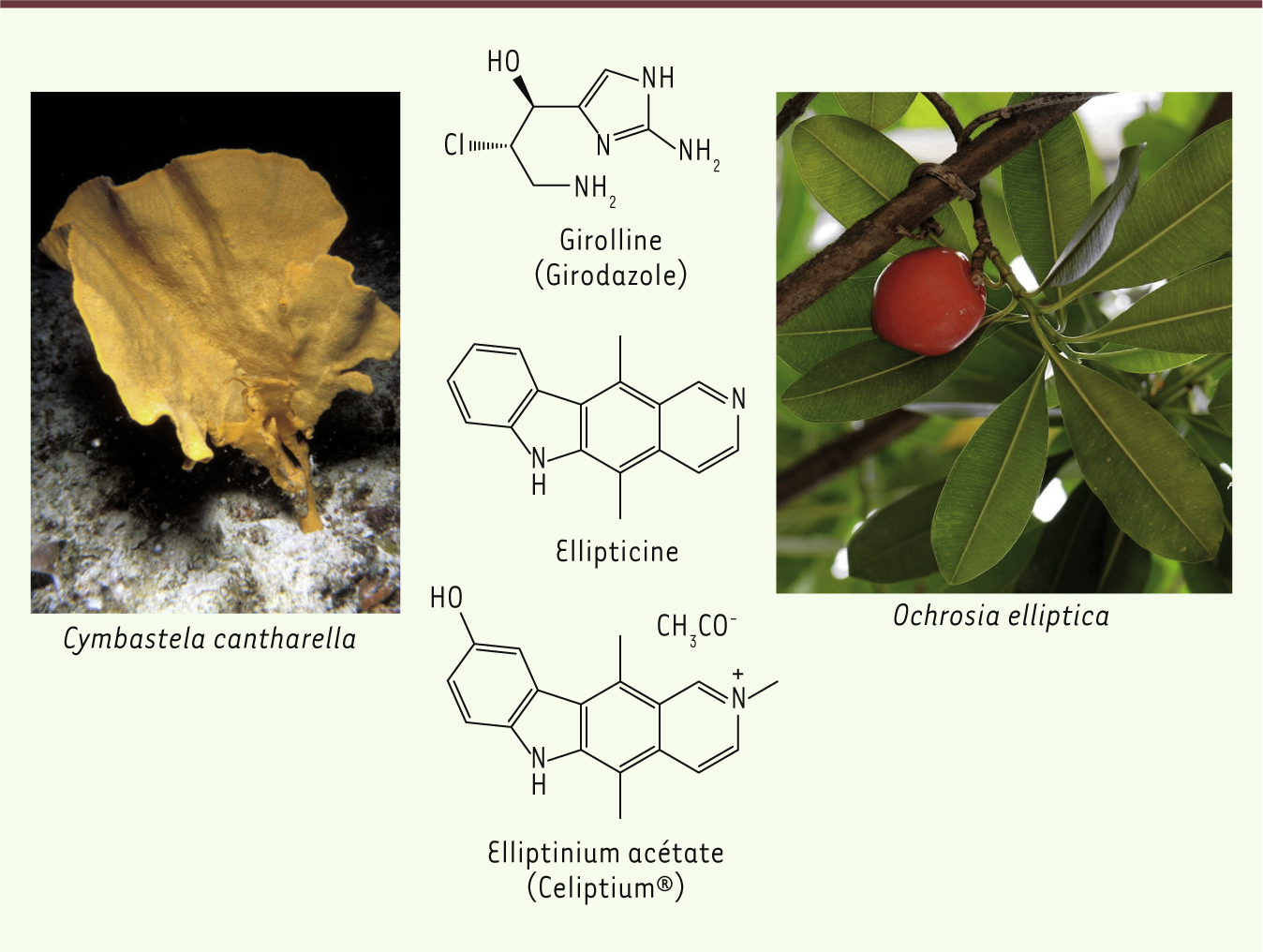
Deux autres pistes, l’ellipticine et la girolline Pierre Potier a également participé à d’autres projets dont ceux de la synthèse de la girolline (girodazole) et du Celiptium®, des antitumoraux qui n’ont pas connu le même succès que la Navelbine® et le Taxotère® du fait de leur toxicité trop importante (l’exploitation de la girolline n’a pas dépassé le stade des essais cliniques et l’utilisation du Celiptium® est très contrôlée). Ellipticine En 1968, Pierre Potier implante un laboratoire en Nouvelle-Calédonie, annexe de l’ICSN, pour récolter des plantes ou autres organismes susceptibles de renfermer de nouvelles substances naturelles intéressantes. Un jeune pharmacien ayant soutenu sa thèse de Doctorat ès Sciences à Gif-sur-Yvette, Thierry Sévenet, s’y rend au titre du service d’assistance technique de l’armée. Il crée à Nouméa, avec l’aide du centre technique forestier tropical, le laboratoire des plantes médicinales du CNRS, soutenu par le Territoire de Nouvelle-Calédonie et le CNRS. Ce laboratoire travaille pendant de nombreuses années en coopération avec l’office de la recherche scientifique et technique d’outremer (ORSTOM, maintenant IRD, Institut de recherche pour le développement). La prospection botanique et la recherche de substances naturelles isolées des plantes néocalédoniennes sont fructueuses. C’est ainsi que sont isolées d’un arbre, Ochrosia elliptica, des substances déjà connues du groupe de l’ellipticine et qui ont suscité pendant plusieurs années l’espoir d’une nouvelle série de médicaments antitumoraux [
19]. L’ellipticine d’Ochrosia elliptica, récolté à Trinidad aux Antilles, avait en effet été isolée en 1958 par l’américain Sydney Goodwin [
20]. Un an plus tard, la synthèse de l’ellipticine est réalisée par Robert B. Woodward qui confirme sa structure chimique [
21] (Figure 7).
 | Figure 7.
Structure de la girolline (Girodazole), de l’ellipticine et de l’elliptinium acétate (Celiptium®). La girolline provient de l’éponge Cymbastela cantharella (photographie institut de recherche pour le développement [IRD]) et l’ellipticine est extraite d’Ochrosia elliptica (© photographie Yilin Yao). |
En 1967, des chercheurs australiens du laboratoire de recherches chimiques du CSIRO (commonwealth scientific and industrial research organisation), soutenus par le NCI, mettent en évidence l’activité antitumorale d’extraits d’Ochrosia elliptica récoltés en Papouasie-Nouvelle Guinée et en Australie. Les molécules d’intérêt identifiées sont l’ellipticine et la 9-méthoxy-ellipticine [
22]. L’étude de l’activité antitumorale commence en 1968 chez Georges Mathé à Villejuif et celle des mécanismes d’action se poursuivra de 1976 à 1985 à Gif-sur-Yvette et à Toulouse, sous la direction de Claude Paoletti [
23]. La molécule d’ellipticine s’intercale entre les bases des acides nucléiques et, après oxydation, se fixe de façon covalente sur les sucres des nucléotides. L’ellipticine et ses dérivés se fixent aussi sur le complexe enzymatique de la topoisomérase II4 en le stabilisant, ce qui empêche la réparation de l’ADN une fois clivé par l’enzyme. Ces deux modes d’action conduisent à la mort cellulaire. En 1978 la synthèse du Celiptium®, un dérivé optimisé de l’ellipticine, est réalisée à Gif-sur-Yvette [
24] (Figure 7) et, en 1983, il est commercialisé par l’Institut Pasteur Production-Sanofi. Il agit de façon préférentielle dans les cancers du sein hormonodépendants. En effet, la molécule entre en compétition avec l’œstradiol sur son récepteur nucléaire, inhibe l’activation de la thymidine kinase et ainsi la synthèse de l’ADN. Même si ce médicament n’est plus utilisé, il a constitué un outil pharmacologique intéressant. D’autres dérivés ont été synthétisés, en collaboration avec l’équipe d’Émile Bisagni (Institut Curie, Orsay) et soumis à l’analyse biologique. Plus récemment, des travaux associant différentes équipes françaises, dont celle de Claude Cochet (commissariat à l’énergie atomique [CEA] à Grenoble), ont permis l’identification de ces molécules comme inhibiteurs de CK2 (casein kinase 2), une protéine kinase impliquée dans de multiples voies de signalisation et dérégulée dans de nombreux types de cancers [
25,
26]. Girolline Dans les années 1980, une vaste opération « substances naturelles d’origine marine » (SNOM) est montée qui associe l’ICSN, le laboratoire de Nouméa, l’ORSTOM et Rhône-Poulenc. II s’agit de récolter, dans le lagon calédonien, des plantes et des animaux marins susceptibles de renfermer des substances possédant des activités biologiques à potentialité thérapeutique. De très nombreuses récoltes sont effectuées et, en 1985, Christiane Poupat, Alain Ahond et leurs collaborateurs à Gif-sur-Yvette découvrent qu’une éponge récoltée dans le lagon néocalédonien, Cymbastela cantharella (synonyme Pseudaxinyssa cantharella), possède des propriétés cytotoxiques très puissantes [
27]. L’une des substances extraites de cette éponge, la girolline (ou girodazole) (Figure 7), présente des propriétés cytotoxiques in vitro sur des cellules leucémiques et une activité antitumorale in vivo chez la souris porteuse de plusieurs tumeurs greffées, y compris des leucémies et des tumeurs solides. Le girodazole possède une structure chimique unique, différente de celle des agents anticancéreux connus et des nouveaux composés faisant l’objet d’essais cliniques (Figure 7). En 1991, des études biochimiques indiquent que le girodazole inhibe la synthèse des protéines. En 1992, la girolline est évaluée pour ses capacités à inhiber l’initiation, l’élongation et la terminaison de la synthèse protéique. Elle agit au niveau de cette dernière puisqu’elle inhibe la libération des peptides naissants des polyribosomes dans des lysats de réticulocytes de lapin [
28], ce qui n’a pas été confirmé ultérieurement [
29]. En revanche, elle induit un arrêt des cellules en phase G2 du cycle cellulaire de manière dépendante de la dose et du temps. Le mécanisme d’action de la girolline n’est toujours pas clairement défini, mais pourrait être lié à un mécanisme contrôlant la transition G2/M [29]. Les études toxicologiques effectuées chez des souris et des chiens ne révèlent aucun effet toxique majeur qui s’opposerait à son administration chez les patients [
30]. Mais en 1995, l’étude clinique de phase 1 se solde par un échec : l’absence d’effet antitumoral et l’existence d’effets secondaires indésirables (nausées, vomissements à toutes les doses, et hypotension et asthénie sévère aux doses les plus élevées) incitent à ne pas en poursuivre l’évaluation chez les patients cancéreux [
31]. |
Pierre Potier, un esprit « préparé » Pierre Potier n’a pas travaillé que sur le cancer ; il a également contribué aux recherches sur la dépression, la malaria et, à la fin de sa carrière et de sa vie, il s’est focalisé sur le traitement du diabète, maladie dont il était atteint. Selon Pierre Potier, « il n’y a pas de recette miracle » pour les découvertes, « les ingrédients sont connus : une dose de confiance mutuelle, un grand verre de volonté, de bons outils de travail, le tout assaisonné par une pointe de chance… » [
32]. Pierre Potier a réalisé toute sa carrière au CNRS à l’ICSN dont il a été le directeur ou le codirecteur de 1974 à 2000. Il a été aussi, de 1978 à 1984, directeur du PIRMED (programme interdisciplinaire de recherche sur le médicament), puis, de 1984 à 1989, directeur du laboratoire mixte CNRS/Roussel-Uclaf et, de 1994 à 1996, directeur général de la recherche et de la technologie au ministère de l’Éducation nationale, de l’Enseignement supérieur et de la Recherche (MENESR). Il était membre de l’Académie des sciences depuis 1988 et a reçu de nombreux prix et distinctions dont celles de commandeur de l’ordre national du Mérite et chevalier de la Légion d’honneur. En 1998, il a obtenu la plus haute distinction scientifique française, la médaille d’or du CNRS [
33–
37]. Forcé de prendre sa retraite en 2000, car les députés venaient de voter une loi ramenant l’âge de la retraite de 68 à 65 ans pour les chercheurs du CNRS - loi que de façon tonitruante Potier déclarait « loi scélérate » -, il reste toujours très actif, continuant notamment ses travaux sur le diabète de type II. Pierre Potier décède le 3 février 2006. Comme disait Louis Pasteur « le hasard ne favorise que des esprits préparés », une phrase que citait souvent Pierre Potier. Nombre de découvertes dans le domaine de la chimie thérapeutique, qui permettent la mise au point de nouveaux médicaments, sont le fait de ce hasard et voient le jour grâce à des « esprits préparés » tels que Pierre Potier et ses collaborateurs proches [
38]. L’histoire des sciences nous permet de retracer et de mettre en valeur tous ces évènements ainsi que cet état d’esprit qui ont conduit à la création des médicaments d’aujourd’hui et produiront ceux de demain. Surtout, elle nous incite à ne pas oublier tous les chercheurs qui ont contribué à sauver tant de vies humaines par leurs découvertes parfois fortuites, mais aussi par leur ténacité toujours passionnée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail fait partie du travail de thèse de Pierre P.J. Da Silva (codirection : Laurent Meijer et Pascal Duris) et est financé par l’Association JPAC (Jardin de plantes anticancéreuses). Nous remercions Benoit Gigant, Kevin C. Nixon, Yilin Yao, l’IRD pour les figures et photographies. Nous remercions également Françoise Guéritte, Hervé Galons et Vincent Guen pour la relecture de cet article.
|
Footnotes |
1.
Newman
DJ
,
Cragg
GM
. Natural products as sources of new drugs over the 30 years from 1981 to 2010 . J Nat Prod.
2012; ; 75 : :311.–335. 2.
Potier
P
.
Étude chimique de la lunarine, alcaloïde de Lunaria biennis Moench, crucifères
. Thèse pour obtenir le grade de Docteur ès sciences. , soutenue le
décembre 21;
1960 , Paris: , CDU et SEDES; . 3.
Cave
A
,
Kan-Fan
C
,
Potier
P
,
Le Men
J
. Modification de la réaction de Polonovski : action de l’anhydride trifluoroacétique sur un aminoxyde . Tetrahedron.
1967; ; 23 : :4681.–4689. 4.
Svoboda
GH
,
Johnson
IS
,
Gorman
M
,
Neuss
N
. Current status of research on the alkaloids of Vinca rosea Linn. (Catharanthus roseus G. Don) . J Pharm Sci.
1962; ; 51 : :707.–720. 5.
Noble
RL
,
Beer
CT
,
Cutts
JH
. Role of chance observations in chemotherapy: Vinca rosea
. Ann NY Acad Sci.
1958; ; 76 : :882.–894. 6.
Cutts
JH
,
Beer
CT
,
Noble
RL
. Biological properties of vincaleukoblastine, an alkaloid in Vinca rosea Linn, with reference to its antitumor action . Cancer Res.
1960; ; 20 : :1023.–1031. 7.
Noble
RL
. The discovery of the vinca alkaloids: chemotherapeutic agents against cancer . Biochem Cell Biol.
1990; ; 68 : :1344.–1351. 8.
Langlois
N
,
Gueritte
F
,
Langlois
Y
,
Potier
P
. Application of a modification of the Polonovski reaction to the synthesis of vinblastine-type alkaloids . J Am Chem Soc.
1976; ; 98 : :7017.–7024. 9.
Mangeney
P
,
Andriamialisoa
RZ
,
Langlois
N
, et al.
New class of anti-tumor compounds: 5’-nor and 5’, 6’-seco derivatives of vinblastine-type alkaloids . J Org Chem.
1979; ; 44 : :3765.–3768. 10.
Zavala
F
,
Guénard
D
,
Potier
P
. Interaction of vinblastine analogues with tubulin . Experientia.
1978; ; 34 : :1479.–1479. 11.
Piccirillo
MC
,
Daniele
G
,
Di Maio
M
, et al.
Vinorelbine for non-small cell lung cancer . Expert Opin Drug Saf.
2010; ; 9 : :493.–510. 12.
Wani
MC
,
Taylor
HL
,
Wall
ME
, et al.
Plant antitumor agents. VI. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia
. J Am Chem Soc.
1971; ; 93 : :2325.–2327. 13.
Schiff
PB
,
Fant
J
,
Horwitz
SB
. Promotion of microtubule assembly in vitro by taxol . Nature.
1979; ; 277 : :665.–667. 14.
Gigant
B
,
Cormier
A
,
Dorléans
A
, et al.
Microtubule-destabilizing agents: structural and mechanistic insights from the interaction of colchicine and vinblastine with tubulin . Top Curr Chem.
2009; ; 286 : :259.–278. 15.
Gueritte-Voegelein
F
,
Senilh
V
,
David
B
, et al.
Chemical studies of 10-deacetyl baccatin-III Hemisynthesis of taxol derivatives . Tetrahedron.
1986; ; 42 : :4451.–4460. 16.
Mangatal
L
,
Adeline
M-T
,
Guénard
D
, et al.
Application of the vicinal oxyamination reaction with asymmetric induction to the hemisynthesis of taxol and analogues . Tetrahedron.
1989; ; 45 : :4177.–4190. 17.
Guénard
D
,
Gueritte-Voegelein
F
,
Lavelle
F
. Taxoids: a new class of antimitotic compounds . Curr Pharm Des.
1995; ; 1 : :95.–112. 18.
Guénard
D
,
Guéritte
F
,
Potier
P
. Anticancer natural products: Navelbine® and Taxotère®
. Actual Chim.
2003; ; 4–5 : :89.–92. 19.
Kansal
VK
,
Potier
P
. The biogenetic, synthetic and biochemical aspects of ellipticine, an antitumor alkaloid . Tetrahedron.
1986; ; 42 : :2389.–2408. 20.
Goodwin
S
,
Smith
AF
,
Horning
EC
. Alkaloids of Ochrosia elliptica Labill . J Am Chem Soc.
1959; ; 81 : :1903.–1908. 21.
Woodward
RB
,
Iacobucci
GA
,
Hochstein
FA
. The synthesis of ellipticine . J Am Chem Soc.
1959; ; 81 : :4434.–4435. 22.
Dalton
LK
,
Demerac
S
,
Elmes
BC
, et al.
Synthesis of the tumour-inhibitory alkaloids, ellipticine, 9-methoxyellipticine, and related pyrido[4, 3-b] carbazoles . Aust J Chem.
1967; ; 20 : :2715.–2727. 23.
Hayat
M
,
Mathé
G
,
Janot
MM
, et al.
Experimental screening of 3 forms and 19 derivatives or analogs of ellipticine: oncostatic effect on L1210 leukaemia and immunosuppressive effect of 4 of them . Biomedicine.
1974; ; 21 : :101.–106. 24.
Paoletti
C
,
Le Pecq
JB
,
Dat Xuong
N
, et al.
New anticancer derivatives in the ellipticine series . In :
Siegenthaler
W
,
Luthy
R
, eds.
Current chemotherapy . Washington: : ASM; , 1978 : :1195.–1197. 25.
Prudent
R
,
Moucadel
V
,
Nguyen
CH
, et al.
Antitumor activity of pyridocarbazole and benzopyridoindole derivatives that inhibit protein kinase CK2 . Cancer Res.
2010; ; 70 : :9865.–9874. 26.
Prudent
R
,
Hasenknopf
B
,
Cochet
C
. Les polyoxométallates :des inhibiteurs inorganiques de la protéine kinase CK2 . Med Sci (Paris).
2008; ; 24 : :1012.–1014. 27.
Ahond
A
,
Zurita
MB
,
Colin
MF
, et al.
Girolline, a new antitumoral compound extracted from the sponge, Pseudaxinyssa cantharella (Axinellidae) . CR Acad Sci Ser II.
1988; ; 307 : :145.–148. 28.
Colson
G
,
Rabault
B
,
Lavelle
F
,
Zerial
A
. Mode of action of the antitumor compound girodazole (RP 49532A, NSC 627434) . Biochem Pharmacol.
1992; ; 43 : :1717.–1723. 29.
Diop
D
,
Chauvin
C
,
Salhi
S
, et al.
Girolline interferes with cell-cycle progression, but not with translation . CR Biologies.
2007; ; 330 : :855.–860. 30.
Lavelle
F
,
Zerial
A
,
Fizames
C
, et al.
Antitumor activity and mechanism of action of the marine compound girodazole . Invest New Drugs.
1991; ; 9 : :233.–244. 31.
Catimel
G
,
Coquard
R
,
Guastalla
JP
, et al.
Phase I study of RP 49532A, a new protein-synthesis inhibitor, in patients with advanced refractory solid tumors . Cancer Chemother Pharmacol.
1995; ; 35 : :246.–248. 32.
Potier
P
,
Chast
F
. Le magasin du Bon Dieu. Les extraordinaires richesses thérapeutiques des plantes et des animaux . Paris: : JC Lattès; , 2001 : :286. p. 33.
Bernier
JC
,
Potier
P
. Un chimiste trouveur . L’Actualité Chimique.
2006; ; 299 : :3.–6. 34.
Le Roux
M
. Hommage à Pierre Potier (1934-2006). Dépasser les limites du présent . Rayonnement du CNRS.
2006; ; 41 : :5.–27. 35.
Calvo
F
,
Le Roux
M
. De l’intuition à l’audace, l’œuvre de Pierre Potier . La Revue pour l’Histoire du CNRS.
2006; ; 14. 36.
Mouchet
S
. Pierre Potier . Med Sci (Paris).
2006; ; 22 : :492.. 37.
Archives du CNRS : Dossier G 990001 DOC. CNRS, 53, Pierre Potier, Médaille d’or du CNRS. , 1998. 38.
Bohuon
C
,
Monneret
C
. Fabuleux hasards : histoire de la découverte de médicaments . Paris: : EDP Sciences; , 2009 : :140. p. |