| |
| Med Sci (Paris). 2012 October; 28(10): 858–863. Published online 2012 October 12. doi: 10.1051/medsci/20122810014.Des dimères et des oligomères de récepteurs couplés aux protéines G, oui mais pourquoi ? Le récepteur GABAB sous interrogatoire Julie Kniazeff1* and Jean-Philippe Pin1** 1Institut de génomique fonctionnelle, CNRS UMR5203; Inserm U661, universités Montpellier 1 et 2, 141, rue de la Cardonille, 34094Montpellier Cedex 5, France |
Les récepteurs couplés aux protéines G (RCPG) sont des acteurs importants de la communication cellulaire. Ils reconnaissent un large panel de stimulus extracellulaires qu’ils convertissent en signaux intracellulaires via l’activation de diverses cascades de signalisation, impliquant notamment les protéines G hétérotrimériques. Cette famille de récepteurs membranaires regroupe plus de 850 membres répartis en différentes classes (principalement A, B et C) sur la base de leur homologie de séquence. Bien que les RCPG reconnaissent des ligands de nature diverse et exercent des fonctions très variées, l’éventail de leurs actions est encore élargi par des phénomènes de dimérisation et d’oligomérisation, autrement dit par l’association de deux ou plusieurs RCPG identiques ou non. Ces associations ont été proposées comme des moyens de modulation des propriétés des RCPG, que ce soit leur pharmacologie, leur signalisation ou encore leurs propriétés d’internalisation et d’adressage [
1]. La taille des oligomères et leur rôle fonctionnel ont fait l’objet de nombreuses études aux cours de ces dernières années. Si le phénomène est maintenant bien caractérisé pour certains récepteurs, y compris dans des cellules les exprimant naturellement, il reste encore sujet à de nombreux débats au sein de la communauté scientifique. Au sein de la « super » famille des RCPG, le récepteur GABAB activé par le principal neurotransmetteur inhibiteur du système nerveux central, l’acide γ-aminobutyrique (GABA), représente un cas d’oligomérisation particulièrement intéressant, et ce à divers niveaux. Ce récepteur de classe C, qui est présent dans la plupart des neurones, a notamment été le premier RCPG pour lequel la dimérisation fut largement acceptée et reconnue [
2–
4]. De ce fait, il représente un modèle pour l’analyse des oligomères de RCPG, notamment de classe C, ou encore pour le développement de technologies permettant l’étude de ces oligomères. Dans le reste du manuscrit, le terme dimère fera référence à l’association de deux RCPG et le terme oligomère sera utilisé pour décrire des complexes contenant plus de deux récepteurs. |
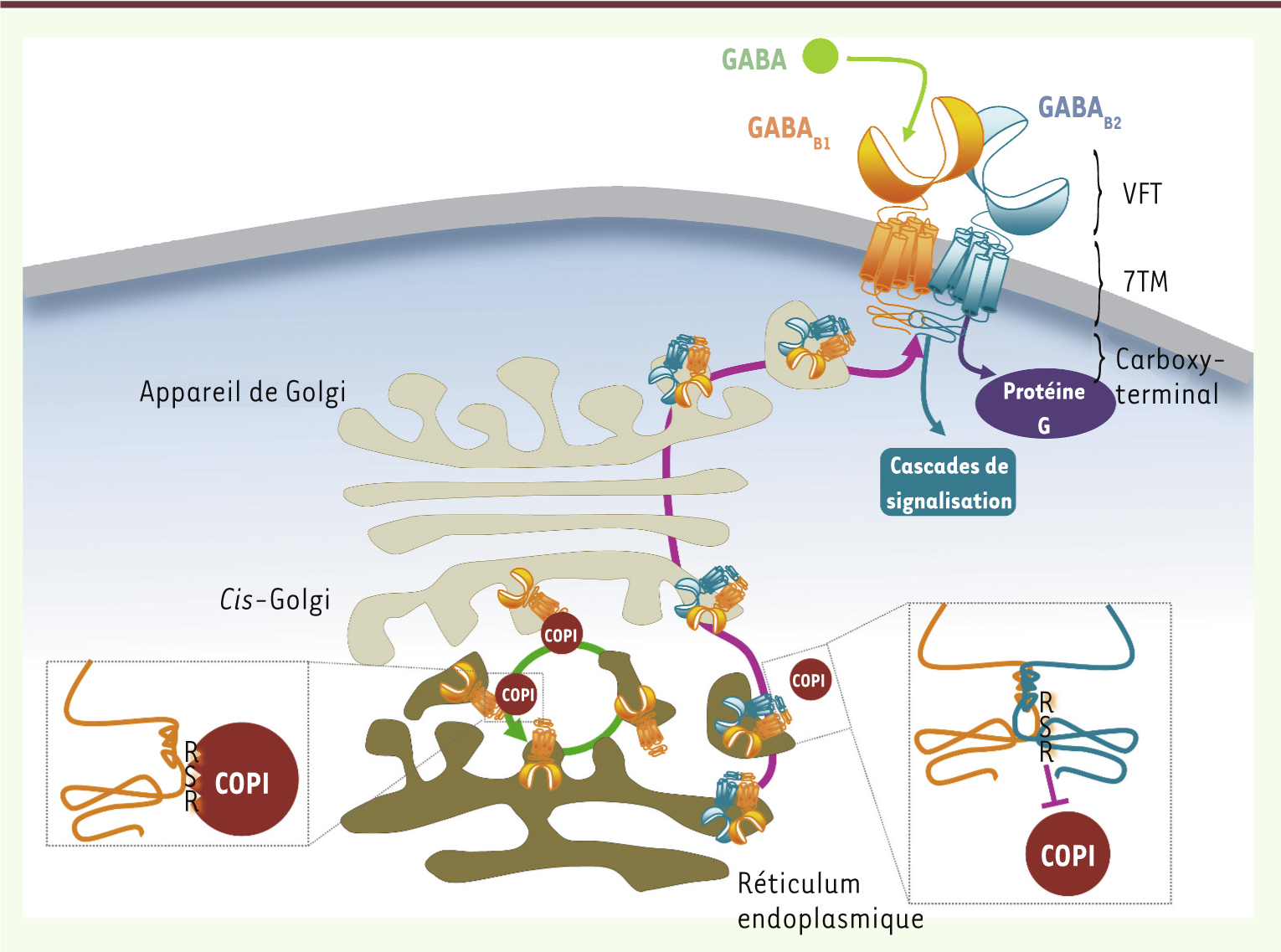
À deux sinon rien : l’hétérodimère comme entité fonctionnelle minimale Le récepteur GABAB est un hétérodimère obligatoire qui requiert l’association de deux sous-unités homologues, GABAB1 et GABAB2, pour être fonctionnel [
3]. En effet, seule la sous-unité GABAB1 lie le GABA, alors que GABAB2 est nécessaire à l’activation des protéines G [
5,
6], indiquant un fonctionnement asymétrique d’un dimère de RCPG, décrit depuis pour d’autres RCPG hétérodimériques, mais aussi homodimériques [
7]. Chacune de ces sous-unités est constituée d’un domaine à sept hélices transmembranaires, commun à l’ensemble des RCPG, et d’un grand domaine extracellulaire en forme de « pacman1
», également appelé Venus Flytrap (VFT) (Figure 1) [
8]. C’est au sein de ce domaine que se situe le site de liaison du GABA dans la sous-unité GABAB1. L’hétérodimérisation du récepteur GABAB est assurée par la cellule via un système de contrôle qualité impliquant l’extrémité carboxy-terminale de chacune des deux sous-unités. GABAB1 contient une séquence de rétention RSR qui l’empêche de progresser au sein de l’appareil de Golgi en le maintenant dans le réticulum endoplasmique [
9]. Une des hypothèses proposées pour ce mécanisme de rétention est que cette petite séquence serait reconnue, entre autres, par le complexe protéique COPI (coat protein complex I) qui transporterait de façon rétrograde GABAB1 du cis-Golgi vers le réticulum endoplasmique [
10]. Quand GABAB1 et GABAB2 interagissent, cette séquence de rétention est masquée, COPI ne se lierait plus à GABAB1 et l’hétérodimère fonctionnel pourrait alors progresser au travers de l’appareil de Golgi et rejoindre la surface cellulaire (Figure 1). Il n’est pas non plus exclu que cette séquence RSR soit directement impliquée dans la rétention de GABAB1 dans le RE, l’empêchant d’atteindre le cis-Golgi. Outre cet aspect moléculaire, des études sur tissus natifs du niveau d’expression des deux sous-unités du récepteur GABAB indiquent que GABAB2 est moins exprimée que GABAB1 [2]. Par conséquent, l’excès de GABAB1 dans les compartiments intracellulaires favorise son association à une sous-unité GABAB2 nouvellement exprimée, ce qui permet un contrôle supplémentaire d’adressage exclusif des hétérodimères proprement constitués.
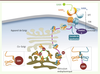 | Figure 1.
Mécanismes cellulaires pour l'adressage d’hétérodimères GABAB fonctionnels à la surface cellulaire. La sous-unité GABAB1 (orange), via la séquence RSR présente au sein de son extrémité terminale, interagit avec le complexe COPI (rouge) qui transporte de façon rétrograde GABAB1 du cis-Golgi vers le réticulum endoplasmique (flèche verte). L’extrémité carboxy-terminale de GABAB2 (bleu) masque la séquence de rétention et empêche COPI d’interagir avec GABAB1. L’hétérodimère est alors adressé à la surface cellulaire (flèche violette) et peut être activé. Le GABA (vert) se lie dans le VFT de GABAB1, et l’activation des protéines G (violet) est assurée par GABAB2. |
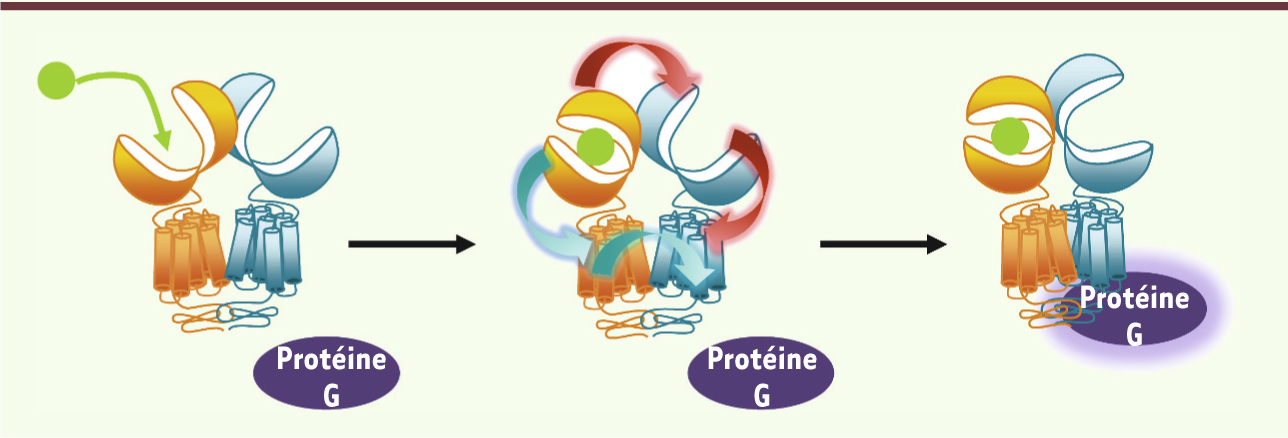
Les mécanismes cellulaires et moléculaires mis en place pour assurer l’hétérodimérisation de GABAB1-GABAB2 à la surface cellulaire trouvent leur origine dans l’importance de la dimérisation pour le mécanisme d’activation de ce récepteur. À l’image de celui proposé pour les autres RCPG de la classe C, et notamment pour les récepteurs métabotropes du glutamate (mGlu), l’activation des messagers intracellulaires en réponse à la liaison de l’agoniste dans le domaine extracellulaire du récepteur provient de changements de conformation importants au sein du dimère [
11,
12]. Dans le cas du récepteur GABAB, si l’activation est initiée par la liaison du GABA dans le VFT de la sous-unité GABAB1 et la fermeture de ce domaine [
13], la stimulation des cascades de signalisation, et notamment des protéines G, requiert des changements de conformation au sein du domaine membranaire de GABAB2 [6,
14]. La transmission conformationnelle au sein de l’hétérodimère, depuis la fermeture du domaine VFT de GABAB1 vers le domaine membranaire de GABAB2, se produit par deux voies concomitantes (Figure 2). La première consiste en un réarrangement du dimère de VFT, c’est-à-dire un changement de l’orientation relative des deux VFT à l’image des récepteurs mGlu. Ce mouvement induirait à son tour des changements dans l’organisation relative des domaines membranaires, et donc de la conformation du domaine membranaire de GABAB2 [
15]. La seconde voie consiste en une action directe de la fermeture du VFT de GABAB1 sur le domaine membranaire de la même sous-unité qui promeut à son tour la conformation active du domaine membranaire de GABAB2 [
16]. La coexistence de ces deux voies engendre une forte allostérie entre les différents domaines structuraux de l’hétérodimère GABAB, allostérie nécessaire à l’activation du récepteur par son ligand naturel. Cette allostérie favorise le développement de composés actifs qui, par leur liaison dans l’un des quatre domaines structuraux (VFT et domaines membranaires de GABAB1 et de GABAB2), influent sur la conformation générale de l’hétérodimère, et donc sur sa signalisation. Il existe notamment une série de petites molécules capables de se lier dans le domaine membranaire de GABAB2 et qui ont pour effet d’augmenter l’affinité du GABA (effet modulateur allostérique positif), mais aussi de permettre une légère activation des protéines G [
17]. Au contraire, des molécules plus grandes se liant dans le VFT de GABAB1 et empêchant sa fermeture (effet antagoniste) bloquent l’hétérodimère dans une conformation inactive et abolissent donc l’activité constitutive de celui-ci (effet agoniste inverse) [
18].
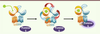 | Figure 2.
Activation et allostérie au sein de l’hétérodimère GABAB. La liaison du GABA à la sous-unité GABAB1 promeut la fermeture de son domaine VFT. Les changements conformationnels sont alors transmis au domaine membranaire de GABAB2 par deux voies concomitantes représentées par les flèches rouges (voie 1) et turquoises (voie 2), ce qui se traduit par l’activation des protéines G. |
Aucune des deux sous-unités exprimée seule, GABAB1 ou GABAB2, ne permet l’activation des protéines G ou des autres voies de signalisation en réponse à la liaison du GABA. L’hétérodimérisation du récepteur GABAB joue donc un rôle primordial pour le fonctionnement du récepteur, et non pas un rôle modulateur de l’activité comme proposé pour certains dimères de RCPG, voire pour des oligomères plus larges. |
La communication entre paires, une histoire de compromis : les oligomères pour moduler la signalisation À la suite des premières indications pharmacologiques [
19], biochimiques [
20] et fonctionnelles [
21] de l’existence de dimères de RCPG, un certain nombre de technologies ont été développées afin de vérifier l’association physique entre récepteurs. Parmi ces technologies, les techniques de transfert d’énergie par résonance BRET et FRET (pour bioluminescence ou fluorescence resonance energy transfer) se sont avérées cruciales, car elles révèlent la proximité spatiale de deux protéines [
22,
23]. En effet, le transfert d’énergie entre deux entités fluorescentes ne se produit que pour des distances inférieures à 100 Å. Dans le cas des RCPG, une telle distance entre deux récepteurs correspond à une interaction directe. Le BRET et le FRET ont donc permis d’aborder de manière plus spécifique les interactions entre RCPG. Le marquage des récepteurs par les entités fluorescentes peut être réalisé par diverses méthodes : fusion avec des protéines fluorescentes de type GFP (green fluorescent protein), marquage avec des anticorps ou ligands fluorescents [23,
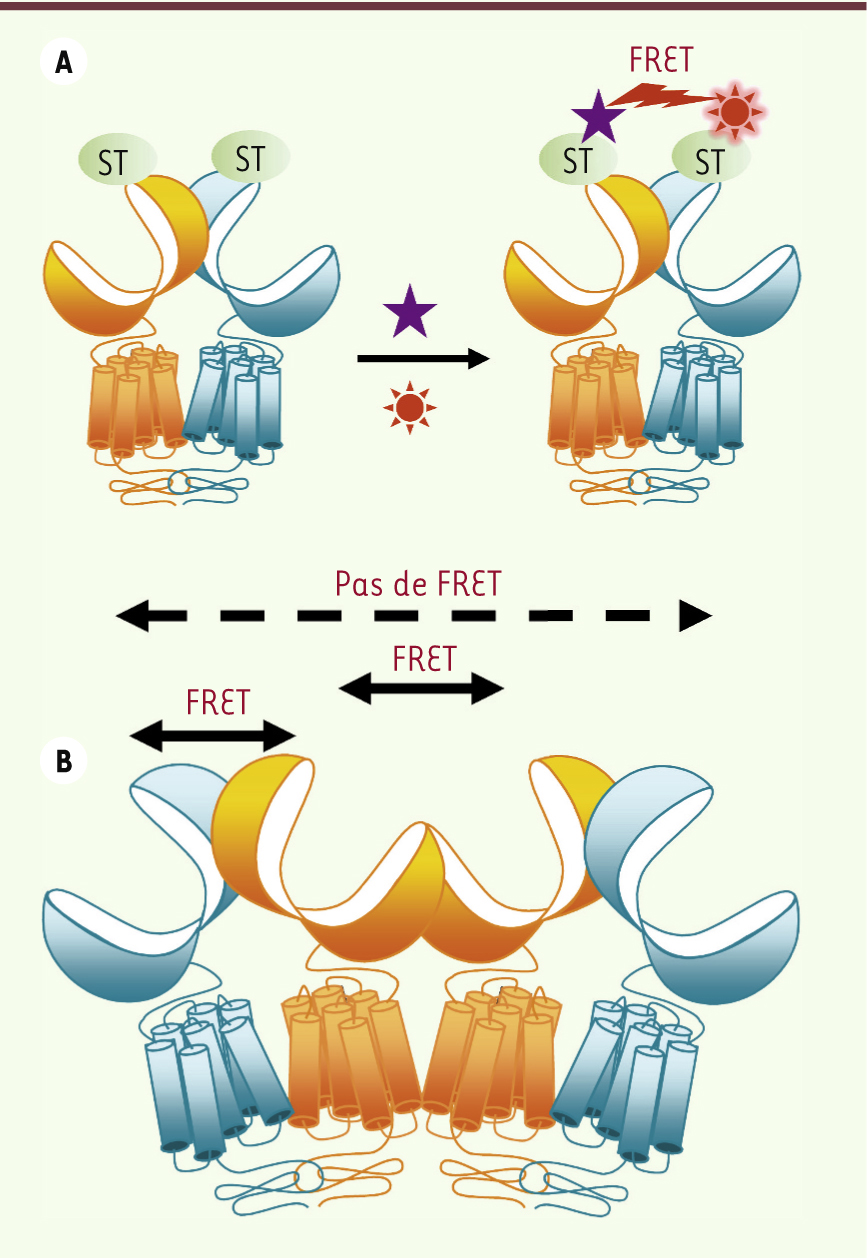
24] ou encore par fusion d’enzymes, comme le Snap-tag
2,, et réaction de substrats suicides portant des fluorophores [16,
25,
26]. Cette dernière méthode permet de marquer exclusivement les protéines de surface, si les propriétés chimiques du substrat sont telles qu’il ne traverse pas les membranes et si le Snap-tag est fusionné à une partie extracellulaire du récepteur, par exemple son extrémité amino-terminale (Figure 3) [26].
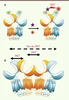 | Figure 3.
Modèle d’organisation pour un récepteur GABAB tétramérique. A. Le marquage du récepteur peut être réalisé via la fusion de Snap-tag (ST, vert) à l’extrémité amino-terminale des sous-unités, puis par réaction avec des substrats donneur (violet) et accepteur (rouge) qui se lient de façon covalente sur le Snap-tag et permet la mesure d’un signal de FRET. B. Les données obtenues par FRET indiquent que les sous-unités GABAB1 interagissent entre elles, mais que les sous-unités GABAB2 restent éloignées l’une de l’autre. Le FRET entre GABAB1 et GABAB2 est conservé. Ceci suggère une organisation oligomérique avec les sous-unités GABAB1 au centre et les sous-unités GABAB2 en périphérie. |
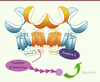 | Figure 4.
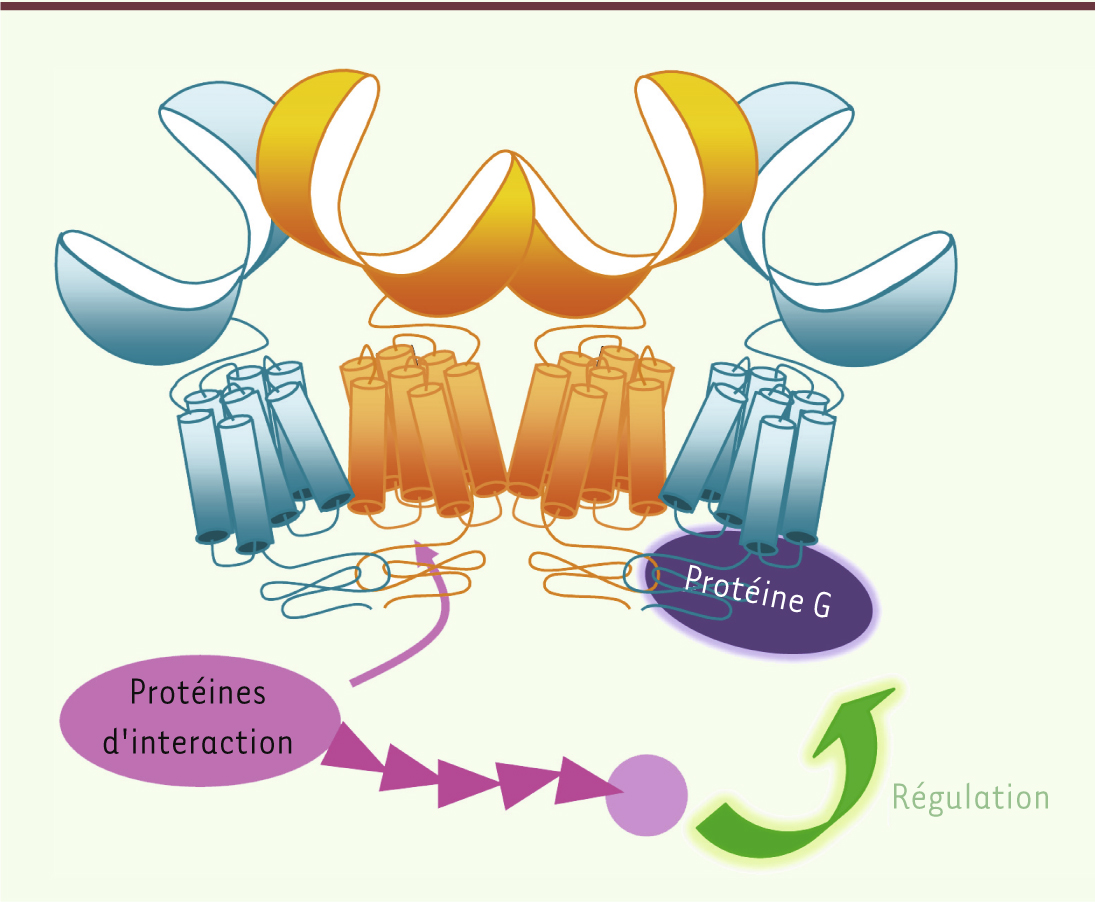
Les oligomères : un moyen de former un réseau de protéines permettant de moduler la signalisation ? Un rôle proposé pour les oligomères de RCPG est de former un réceptosome, ici schématisé pour le récepteur GABA B. Des protéines d’interaction (rose) pourraient interagir avec certaines sous-unités de l’oligomère, ce qui permettrait d’assurer une proximité spatiale avec les protéines de signalisation (par exemple les protéines G). Cela favoriserait la régulation de la signalisation au sein de l’oligomère, comme proposé dans le cas du récepteur MT1 [
31]. |
Comme le récepteur GABAB est un hétérodimère obligatoire, ces techniques ont été utilisées voire développées (dans le cas du FRET en temps résolu ou trFRET) en utilisant ce récepteur comme contrôle positif de dimérisation. Outre la confirmation de l’interaction directe de GABAB1 et GABAB2, les mesures de FRET au sein du récepteur ont révélé une nouvelle organisation oligomérique inattendue du récepteur GABAB [26]. En effet, le marquage exclusif des seules sous-unités GABAB1 donne lieu à la mesure d’un FRET du même ordre de grandeur que celui mesuré entre GABAB1 et GABAB2, indiquant que les GABAB1 interagissent entre eux, comme ils le font avec GABAB2. À l’inverse, le marquage exclusif des seules sous-unités GABAB2 ne donne lieu à aucun signal de FRET sortant du bruit de fond, ce qui suggère que ces sous-unités restent éloignées au sein du complexe. Ces résultats indiquent que les hétérodimères du récepteur GABAB peuvent s’associer en oligomères d’ordre supérieur via leur sous-unité GABAB1
(Figure 3). La stœchiométrie exacte de ces oligomères d’ordre supérieur n’est pas encore déterminée, mais les modèles les plus probables limitent le complexe à un dimère d’hétérodimères, c’est-à-dire un tétramère [
27]. La formation d’oligomères du récepteur GABAB semble également se produire dans des conditions physiologiques, comme le suggèrent plusieurs études réalisées à partir d’extraits de cerveaux, qui sont en accord avec l’interaction entre les sous-unités GABAB1 et l’existence de complexes dont la taille serait celle d’un tétramère [27,
28]. Il est intéressant de noter que les récepteurs mGlu, qui appartiennent à la même classe de RCPG que le récepteur GABAB, sont, eux, des homodimères stricts et ne peuvent pas former spontanément des oligomères plus grands, ce qui montre une spécificité du récepteur GABAB à former des oligomères [25, 26]. Ces nouvelles données concernant le récepteur GABAB soulèvent de nombreuses questions quant au rôle fonctionnel de ces oligomères. Afin de pouvoir disséquer les différences fonctionnelles entre les hétérodimères et les oligomères, il semble crucial de comprendre et de déterminer comment les sous-unités GABAB1 s’assemblent entre elles. Comme indiqué plus haut, l’interaction entre GABAB1 et GABAB2 fait intervenir les différents domaines de la protéine : VFT, domaine membranaire et extrémité carboxy-terminale. Intuitivement, on peut penser qu’il en est de même pour l’interaction entre deux sous-unités GABAB1. L’identité des hélices transmembranaires impliquées dans l’assemblage oligomérique du récepteur GABAB n’est pas encore connue, tant pour les interactions hétérodimèriques entre GABAB1 et GABAB2 que pour les interactions oligomériques entre deux sous-unités GABAB1. Au niveau des VFT, la présence de domaines de structure similaire sur les récepteurs ionotropiques du glutamate a permis d’apporter des indications sur leur organisation tétramérique. En effet, la structure cristallographique du tétramère de l’un de ces récepteurs (GluR2) a été résolue et a permis d’identifier une zone de contact entre deux dimères de VFT [
29]. À partir de cette indication, des mutations ont été introduites dans GABAB1 au niveau de cette zone de contact, qui résultent en une diminution du signal de FRET, autrement dit une augmentation de la distance entre les GABAB1 [27]. Ceci pourrait être dû au découplage des VFT de GABAB1 au sein de l’oligomère. Sur la base des différentes données biophysiques et moléculaires, diverses stratégies pour analyser les propriétés des hétérodimères et des oligomères du récepteur GABAB ont été élaborées. Celles-ci reposent alternativement sur l’utilisation d’un compétiteur pour supprimer l’interaction entre les sous-unités GABAB1 ou sur la génération de mutants permettant la déstabilisation de l’association des GABAB1. De façon surprenante, l’affinité du GABA pour le récepteur ne semble pas affectée par le degré d’oligomérisation. En revanche, une analyse comparative indique que les oligomères sont moins efficaces pour activer les protéines G que les hétérodimères stricts [27]. Ce résultat indique que le degré d’oligomérisation du récepteur GABAB définit l’efficacité de couplage aux protéines G mais aussi, probablement, l’efficacité d’activation des diverses voies de signalisation activées par le récepteur. Si l’hétérodimérisation du récepteur GABAB représente une étape cruciale pour la formation d’une entité fonctionnelle, son oligomérisation participe à la modulation des évènements de signalisation. Ceci indique que les différents degrés d’oligomérisation des RCPG peuvent avoir des implications fonctionnelles différentes, mais que tous participent à la multiplicité des possibilités de régulation de ces récepteurs. |
De futures rencontres pour s’enrichir davantage : du concept d’oligomères à celui de réceptosomes La raison pour laquelle un oligomère fonctionnerait moins bien qu’un hétérodimère, au moins en ce qui concerne le couplage aux protéines G, n’est pas encore connue. Il est en effet surprenant, d’un point de vue évolutif, que la dépense d’énergie liée à la formation d’un oligomère se traduise par une signalisation moins efficace. Une des hypothèses expliquant l’intérêt des oligomères est que ceux-ci constituent des plateformes permettant l’interaction avec des protéines partenaires qui moduleraient la fonction du récepteur [
30]. Ces complexes associés aux RCPG sont appelés réceptosomes. Ce concept de régulation via des protéines d’interaction et la formation d’oligomères a été démontré pour le récepteur de la mélatonine MT1 [7, 31,
32] (→).
(→) Voir également l’article de R. Jockers et al., page 864 de ce numéro
Dans le cas du récepteur GABAB, les protéines KCTD (potassium channel tetramerization domain-containing) sont des candidates idéales [28]. En effet, ces protéines qui interagissent avec l’extrémité carboxy-terminale de la sous-unité GABAB2 ont pour propriété de moduler la désensibilisation du récepteur GABAB. Dans le contexte oligomérique, les différents RCPG pourraient interagir avec les différents partenaires et apporter tous les éléments moléculaires pour sa signalisation et sa modulation à proximité immédiate du récepteur. De nombreuses études sont encore nécessaires pour comprendre le rôle et le mode d’action de ces protéines d’interaction au sein des oligomères, mais ceci représente une piste de grand intérêt pour l’élucidation du rôle des oligomères. |
Vers de nouvelles explorations Si les RCPG ont très tôt été considérés comme de simples « serrures » capables d’activer des protéines G quand ils sont occupés par leur ligand, les 15 dernières années ont révélé une complexité dans leur fonctionnement qui offre de multiples possibilités de régulation de leur activation. L’oligomérisation représente l’une de ces possibilités en agissant directement sur l’efficacité de couplage, voire éventuellement sur l’activation préférentielle d’une voie de signalisation par rapport à une autre. Les oligomères constituent donc une cible prometteuse pour le développement de nouveaux traitements plus spécifiques, et donc avec des effets secondaires moindres. Ceci serait de prime intérêt pour le récepteur GABAB qui, tout en étant une cible reconnue pour le traitement des dépendances (en particulier l’alcoolisme), de la douleur ou de la dépression, reste peu exploité en raison des nombreux effets secondaires de la seule molécule utilisée en clinique ciblant ce récepteur, le Lioresal® (baclofen). |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous tenons à remercier Philippe Rondard, Laurent Prézeau, Damien Maurel, Laëtitia Comps-Agrar, Carine Monnier, Virginie Binet et Thierry Galvez pour les nombreuses discussions stimulantes ainsi que Guillaume Lebon pour la relecture du manuscrit.
|
Footnotes |
1.
Terrillon
S
,
Bouvier
M.
Roles of G-protein-coupled receptor dimerization . EMBO Rep.
2004; ; 5 : :30.–34. 2.
Bettler
B
,
Kaupmann
K
,
Mosbacher
J
,
Gassmann
M.
Molecular structure and physiological functions of GABA(B) receptors . Physiol Rev.
2004; ; 84 : :835.–867. 3.
Kaupmann
K
,
Malitschek
B
,
Schuler
V
, et al.
GABA(B)-receptor subtypes assemble into functional heteromeric complexes . Nature.
1998; ; 396 : :683.–687. 4.
Bettler
B
,
Tiao
JY.
Molecular diversity, trafficking and subcellular localization of GABAB receptors . Pharmacol Ther.
2006; ; 110 : :533.–543. 5.
Kniazeff
J
,
Galvez
T
,
Labesse
G
,
Pin
JP.
No ligand binding in the GB2 subunit of the GABA(B) receptor is required for activation and allosteric interaction between the subunits . J Neurosci.
2002; ; 22 : :7352.–7361. 6.
Galvez
T
,
Duthey
B
,
Kniazeff
J
, et al.
Allosteric interactions between GB1 and GB2 subunits are required for optimal GABA(B) receptor function . EMBO J.
2001; ; 20 : :2152.–2159. 7.
Maurice
P
,
Kamal
M
,
Jockers
R.
Asymmetry of GPCR oligomers supports their functional relevance . Trends Pharmacol Sci.
2011; ; 32 : :514.–520. 8.
Galvez
T
,
Parmentier
ML
,
Joly
C
, et al.
Mutagenesis and modeling of the GABAB receptor extracellular domain support a venus flytrap mechanism for ligand binding . J Biol Chem.
1999; ; 274 : :13362.–13369. 9.
Pagano
A
,
Rovelli
G
,
Mosbacher
J
, et al.
C-terminal interaction is essential for surface trafficking but not for heteromeric assembly of GABA(b) receptors . J Neurosci.
2001; ; 21 : :1189.–1202. 10.
Brock
C
,
Boudier
L
,
Maurel
D
, et al.
Assembly-dependent surface targeting of the heterodimeric GABAB receptor is controlled by COPI but not 14–3-3 . Mol Biol Cell.
2005; ; 16 : :5572.–5578. 11.
Galvez
T
,
Pin
JP.
Comment fonctionne un récepteur couplé aux protéines G ? Le cas des récepteurs métabotropiques du glutamate et du GABA . Med Sci (Paris).
2003; ; 19 : :559.–565. 12.
Pin
JP
,
Kniazeff
J
,
Liu
J
, et al.
Allosteric functioning of dimeric class C G-protein-coupled receptors . FEBS J.
2005; ; 272 : :2947.–2955. 13.
Galvez
T
,
Prezeau
L
,
Milioti
G
, et al.
Mapping the agonist-binding site of GABAB type 1 subunit sheds light on the activation process of GABAB receptors . J Biol Chem.
2000; ; 275 : :41166.–41174. 14.
Binet
V
,
Duthey
B
,
Lecaillon
J
, et al.
Common structural requirements for heptahelical domain function in class A and class C G protein-coupled receptors . J Biol Chem.
2007; ; 282 : :12154.–12163. 15.
Rondard
P
,
Huang
S
,
Monnier
C
, et al.
Functioning of the dimeric GABA(B) receptor extracellular domain revealed by glycan wedge scanning . EMBO J.
2008; ; 27 : :1321.–1332. 16.
Monnier
C
,
Tu
H
,
Bourrier
E
, et al.
Trans-activation between 7TM domains: implication in heterodimeric GABAB receptor activation . EMBO J.
2011; ; 30 : :32.–42. 17.
Binet
V
,
Brajon
C
,
Le Corre
L
, et al.
The heptahelical domain of GABA(B2) is activated directly by CGP7930, a positive allosteric modulator of the GABA(B) receptor . J Biol Chem.
2004; ; 279 : :29085.–29091. 18.
Kniazeff
J
,
Saintot
PP
,
Goudet
C
, et al.
Locking the dimeric GABA(B) G-protein-coupled receptor in its active state . J Neurosci.
2004; ; 24 : :370.–377. 19.
Limbird
LE
,
Meyts
PD
,
Lefkowitz
RJ.
Beta-adrenergic receptors: evidence for negative cooperativity . Biochem Biophys Res Commun.
1975; ; 64 : :1160.–1168. 20.
Hebert
TE
,
Moffett
S
,
Morello
JP
, et al.
A peptide derived from a beta2-adrenergic receptor transmembrane domain inhibits both receptor dimerization and activation . J Biol Chem.
1996; ; 271 : :16384.–16392. 21.
Maggio
R
,
Vogel
Z
,
Wess
J.
Coexpression studies with mutant muscarinic/adrenergic receptors provide evidence for intermolecular cross-talk between G-protein-linked receptors . Proc Natl Acad Sci USA.
1993; ; 90 : :3103.–3107. 22.
Angers
S
,
Salahpour
A
,
Joly
E
, et al.
Detection of beta 2-adrenergic receptor dimerization in living cells using bioluminescence resonance energy transfer (BRET) . Proc Natl Acad Sci USA.
2000; ; 97 : :3684.–3689. 23.
Maurel
D
,
Kniazeff
J
,
Mathis
G
, et al.
Cell surface detection of membrane protein interaction with homogeneous time-resolved fluorescence resonance energy transfer technology . Anal Biochem.
2004; ; 329 : :253.–262. 24.
Albizu
L
,
Cottet
M
,
Kralikova
M
, et al.
Time-resolved FRET between GPCR ligands reveals oligomers in native tissues . Nat Chem Biol.
2010; ; 6 : :587.–594. 25.
Doumazane
E
,
Scholler
P
,
Zwier
JM
, et al.
A new approach to analyze cell surface protein complexes reveals specific heterodimeric metabotropic glutamate receptors . FASEB J.
2011; ; 25 : :66.–77. 26.
Maurel
D
,
Comps-Agrar
L
,
Brock
C
, et al.
Cell-surface protein-protein interaction analysis with time-resolved FRET and snap-tag technologies: application to GPCR oligomerization . Nat Methods.
2008; ; 5 : :561.–567. 27.
Comps-Agrar
L
,
Kniazeff
J
,
Norskov-Lauritsen
L
, et al.
The oligomeric state sets GABA(B) receptor signalling efficacy . EMBO J.
2011; ; 30 : :2336.–2349. 28.
Schwenk
J
,
Metz
M
,
Zolles
G
, et al.
Native GABA(B) receptors are heteromultimers with a family of auxiliary subunits . Nature.
2010; ; 465 : :231.–235. 29.
Sobolevsky
AI
,
Rosconi
MP
,
Gouaux
E.
X-ray structure, symmetry and mechanism of an AMPA-subtype glutamate receptor . Nature.
2009; ; 462 : :745.–756. 30.
Bockaert
J
,
Fagni
L
,
Dumuis
A
,
Marin
P.
GPCR interacting proteins (GIP) . Pharmacol Ther.
2004; ; 103 : :203.–221. 31.
Maurice
P
,
Daulat
AM
,
Turecek
R
, et al.
Molecular organization and dynamics of the melatonin MT receptor/RGS20/G(i) protein complex reveal asymmetry of receptor dimers for RGS and G(i) coupling . EMBO J.
2010; ; 29 : :3646.–3659. 32.
Jockers
R
,
Gbahou
F
,
Tadagaki
K
,
Kamal
M.
Oligomérisation des protéines humaines et virales à sept domaines transmembranaires : nouvelle stratégie virale pour manipuler la cellule hôte . Med Sci (Paris).
2012; ; 28 : :864.–869. |