| |
| Med Sci (Paris). 2012 November; 28(11): 909–910. Published online 2012 November 12. doi: 10.1051/medsci/20122811002.SAMHD1 prive le VIH des nucléotides essentiels à la synthèse d’ADN viral Hichem Lahouassa,1 Loïc Dragin,1 Catherine Transy,1 and Florence Margottin-Goguet1* 1Inserm U1016, Institut Cochin, 22, rue Méchain, 75014Paris, France MeSH keywords: Animaux, Maladies auto-immunes du système nerveux, génétique, Réplication de l'ADN, Cellules dendritiques, métabolisme, virologie, Nucléotide désoxyguanylique, physiologie, Désoxyribonucléotides, Infections à VIH, Transcriptase inverse du VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), VIH-2 (Virus de l'Immunodéficience Humaine de type 2), Haplorhini, Humains, Macrophages, Protéines G monomériques, déficit, Malformations du système nerveux, Structure tertiaire des protéines, Protéines virales régulatrices ou accessoires, Réplication virale |
Trente-cinq millions de personnes sont infectées dans le monde par les virus de l’immunodéficience humaine VIH-1 et VIH-2, responsables du Sida (syndrome d’immunodéficience acquise). Les cibles cellulaires de l’infection par ces virus sont principalement les macrophages, les cellules dendritiques et les lymphocytes T qui expriment le récepteur CD4. Ces cellules présentent une susceptibilité différente à l’infection en fonction de l’expression de facteurs cellulaires, appelés facteurs de restriction, qui forment une ligne de défense précoce contre le virus. Rejoignant la famille des facteurs de restriction (Trim5α, BST-2/tetherin et APOBEC3G [apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like 3G]) (→) [
10], SAMHD1 [SAM domain and HD domain 1] a été découverte en 2011 comme une protéine cellulaire bloquant l’infection virale dans les macrophages et les cellules dendritiques [
1,
2]. Notre laboratoire, dans le cadre d’une collaboration internationale, a démontré comment SAMHD1 assurait son activité antivirale. SAMHD1 bloque l’infection par les VIH-1 et VIH-2 en réduisant considérablement le taux de désoxynucléotides (dNTP), précurseurs essentiels à la synthèse de l’ADN viral [
3].
(→) Voir m/s n° 4, avril 2012, page 356
|
Le taux cellulaire de dNTP : un élément clé pour l’infection du VIH Le travail a commencé avec l’étude de la protéine auxiliaire Vpx. Alors que les VIH-1 et VIH-2, comme tous les rétrovirus, partagent l’expression de protéines structurales et catalytiques codées par les gènes gag, pol et env, ils diffèrent par leur équipement en protéines auxiliaires. Ainsi, Vpx est exprimée uniquement par le VIH-2 (et le virus simien apparenté, SIVsm), et non par le VIH-1. Vpx est la seule des protéines auxiliaires dont l’importance est observée seulement dans des cellules de la lignée monocytaire (monocytes, cellules dendritiques, macrophages). Par exemple, les macrophages ne peuvent pas être infectés par un VIH-2 (ou le SIVsm) qui a été privé de son gène codant pour Vpx, contrairement à des lymphocytes T activés qui restent infectables [
4]. Par ailleurs, Vpx délivrée à une cellule monocytaire par des particules virales non infectieuses, augmente spectaculairement l’infection par le VIH-1, mais aussi par des virus plus lointains tels que le FIV (virus de l’immunodéficience féline) [
5]. Il semble donc que de nombreux rétrovirus, bien que dépourvus de Vpx, soient sensibles à l’apport de la protéine virale. Dans tous les cas, Vpx agit en augmentant la cinétique d’une étape cruciale du cycle rétroviral, la transcription inverse [5]. Cette étape est accomplie par la transcriptase inverse (RT) du virus, qui convertit l’ARN viral en ADN en utilisant les dNTP cellulaires. Or, le taux de dNTP dans les cellules monocytaires est maintenu à une valeur très faible car ces cellules ne se divisent pas (elles sont dites quiescentes) et ne répliquent donc pas leur ADN nucléaire, contrairement aux lymphocytes T qui prolifèrent [
6]. Les VIH se sont d’ailleurs adaptés à ces conditions de faible concentration en nucléotides en développant des RT de très forte affinité vis-à-vis des dNTP [6]. Il n’en reste pas moins que l’addition de désoxynucléosides (dN), convertis en dNTP dans la cellule, permet d’augmenter fortement l’infection des macrophages par le VIH-1, indiquant que le taux de nucléotides reste limitant pour l’infection des cellules par ce virus. Ainsi, Vpx d’un côté et les dN de l’autre, augmentent l’infection par le VIH-1. L’ensemble de ces observations nous a conduits à explorer l’hypothèse selon laquelle Vpx pourrait augmenter la concentration de dNTP intracellulaires. Dans un premier temps, nous avons donc cherché à savoir si l’addition de dN au milieu de culture de macrophages cultivés in vitro permettrait de restaurer l’infection de ces cellules par le SIV (un virus proche du VIH-2) dépourvu du gène codant pour Vpx. En d’autres termes : les dN permettent-ils à un virus SIV de s’affranchir de Vpx ? La réponse est oui, mais partiellement. Ainsi, pour la première fois, des conditions métaboliques particulières permettaient à un virus SIV d’infecter des macrophages en l’absence de Vpx. Par la suite, une quantification directe de la concentration des dNTP intracellulaires a permis de montrer que Vpx augmentait significativement le taux des quatre dNTP (dATP, dCTP, dGTP et dTTP) dans les macrophages. |
La protéine SAMHD1 est une dNTPase dépendante du dGTP En 2011, la protéine SAMHD1 (impliquée dans le syndrome d’Aicardi-Goutières1 [
7]) était identifiée, non seulement comme une protéine limitant l’infection par les VIH-1 et VIH-2/SIVsm, mais aussi comme une cible cellulaire dégradée en présence de Vpx (un mécanisme viral permettant de contrecarrer l’activité de ce facteur de restriction) [1, 2]. Cette découverte était-elle compatible avec un rôle direct de Vpx sur le taux de dNTP intracellulaire ? Deux caractéristiques de SAMHD1 ont alors revêtu une importance particulière à nos yeux : son domaine HD, un domaine associé au métabolisme des acides nucléiques, et son homologie de séquence avec des enzymes permettant l’hydrolyse des dNTP (ou dNTPases) chez les bactéries. Nous nous sommes donc demandé si SAMHD1 était une enzyme de type dNTPase, auquel cas sa dégradation en présence de Vpx pouvait conduire à une augmentation du taux de dNTP intracellulaire. Pour tester cette hypothèse, nous avons, d’une part, supprimé son expression dans une lignée monocytaire (cellules THP-1 [human acute monocytic leukemia cell line]) puis quantifié les dNTP et, d’autre part, exprimé la protéine dans des cellules humaines qui ne l’expriment pas de façon naturelle (cellules U937), puis quantifié les dNTP. Nous avons observé que l’absence de SAMHD1 mimait l’effet de Vpx, c’est-à-dire entraînait une augmentation du taux de dNTP, tandis que sa surexpression diminuait de façon drastique le taux de désoxynucléotides, et ce seulement si le domaine HD était intact. Par ailleurs la protéine SAMHD1, produite chez la bactérie et purifiée, est capable d’hydrolyser les dNTP in vitro, plus précisément le dGTP, mais aussi les trois autres nucléotides en présence de dGTP. SAMHD1 est donc une dNTPase dépendante du dGTP [3,
8,
9]. |
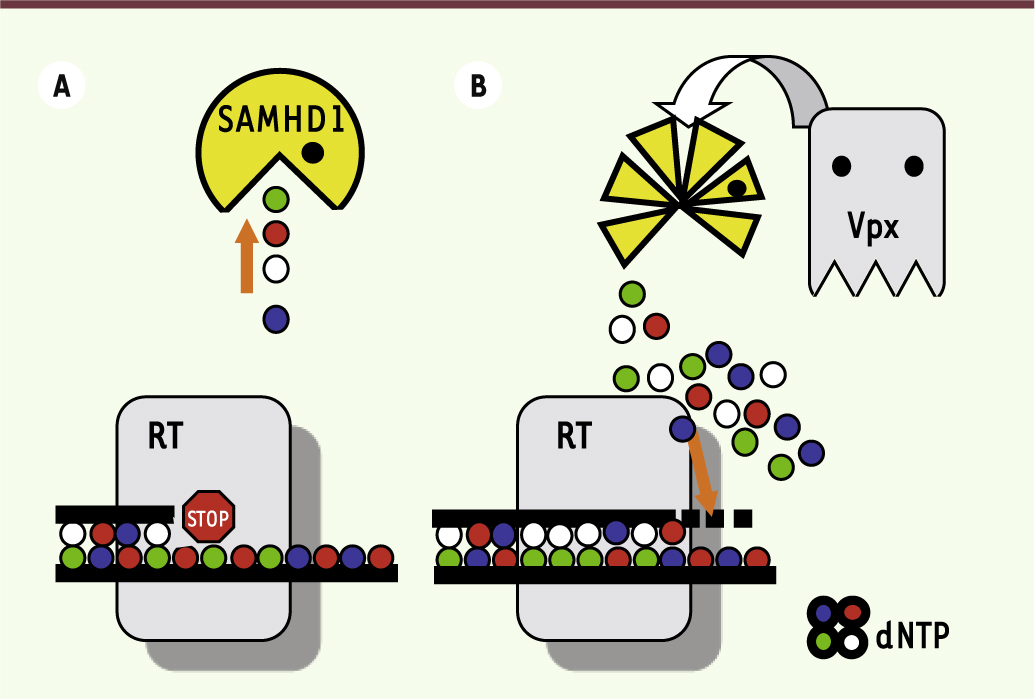
Conclusions et perspectives SAMHD1 est un régulateur clé du métabolisme des désoxynucléotides, qui limite l’infection par les VIH en maintenant un taux de dNTP dans les macrophages trop faible pour permettre un fonctionnement optimal de la transcriptase inverse (Figure 1A). Le VIH-2 (ou le SIVsm) a développé une arme pour se défendre de l’activité de SAMHD1, la protéine Vpx. Cette dernière induit la dégradation de SAMHD1 et ainsi augmente le taux intracellulaire de dNTP (Figure 1B). Le VIH-1, quant à lui, est sensible à SAMHD1 mais échappe partiellement à son action, bien qu’il ne code pas pour Vpx.
 | Figure 1.
Rôle du facteur de restriction SAMHD1 et de la protéine virale Vpx dans la régulation de la concentration cellulaire de dNTP. A. Dans les cellules monocytaires, les dNTP sont maintenus à une concentration très faible, du fait de leur dégradation par la protéine SAMHD1. En absence de substrat (dNTP), la transcriptase inverse (RT) du virus ne peut synthétiser l’ADN viral de façon optimale ; la réplication virale est bloquée à une étape précoce. Les VIH-1 et VIH-2/SIVsm sont tous les deux sensibles à l’effet inhibiteur de SAMHD1. B. Le VIH-2 et le virus simien apparenté (SIVsm) ont développé une arme contre SAMHD1 : la protéine virale Vpx. En dégradant SAMHD1, Vpx augmente le taux intracellulaire de dNTP, ce qui permet une synthèse efficace de l’ADN viral et l’infection des cellules. |
La déplétion en désoxynucléotides apparaît donc comme une stratégie de défense contre les VIH, particulièrement « intelligente » dans les cellules quiescentes qui n’ont pas besoin d’un contenu élevé en dNTP. La modulation du taux de désoxynucléotides intracellulaires est certainement un axe de recherche à prendre en considération dans le cadre de l’élaboration de nouvelles stratégies contre les VIH, mais peut-être aussi contre d’autres pathogènes. En effet, le mécanisme de déplétion en désoxynucléotides pourrait être utilisé par la cellule pour résister à l’infection contre différents pathogènes dont la survie dépend d’une synthèse d’ADN dans des cellules quiescentes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Hrecka
K
,
Hao
C
,
Gierszewska
M
, et al.
Vpx relieves inhibition of HIV-1 infection of macrophages mediated by the SAMHD1 protein . Nature.
2011; ; 474 : :658.–661. 2.
Laguette
N
,
Sobhian
B
,
Casartelli
N
, et al.
SAMHD1 is the dendritic- and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx . Nature.
2011; ; 474 : :654.–657. 3.
Lahouassa
H
,
Daddacha
W
,
Hofmann
H
, et al.
SAMHD1 restricts the replication of human immunodeficiency virus type 1 by depleting the intracellular pool of deoxynucleoside triphosphates . Nat Immunol.
2012; ; 13 : :223.–228. 4.
Ayinde
D
,
Maudet
C
,
Transy
C
,
Margottin-Goguet
F.
Limelight on two HIV/SIV accessory proteins in macrophage infection : is Vpx overshadowing Vpr?
Retrovirology.
2010; ; 7 : :35.. 5.
Goujon
C
,
Riviere
L
,
Jarrosson-Wuilleme
L
, et al.
SIVSM/HIV-2 Vpx proteins promote retroviral escape from a proteasome-dependent restriction pathway present in human dendritic cells . Retrovirology.
2007; ; 4 : :2.. 6.
Diamond
TL
,
Roshal
M
,
Jamburuthugoda
VK
, et al.
Macrophage tropism of HIV-1 depends on efficient cellular dNTP utilization by reverse transcriptase . J Biol Chem.
2004; ; 279 : :51545.–51553. 7.
Rice
GI
,
Bond
J
,
Asipu
A
, et al.
Mutations involved in Aicardi-Goutieres syndrome implicate SAMHD1 as regulator of the innate immune response . Nat Genet.
2009; ; 41 : :829.–832. 8.
Goldstone
DC
,
Ennis-Adeniran
V
,
Hedden
JJ
, et al.
HIV-1 restriction factor SAMHD1 is a deoxynucleoside triphosphate triphosphohydrolase . Nature.
2011; ; 480 : :379.–382. 9.
Powell
RD
,
Holland
PJ
,
Hollis
T
,
Perrino
FW.
Aicardi-Goutieres syndrome gene and HIV-1 restriction factor SAMHD1 is a dGTP-regulated deoxynucleotide triphosphohydrolase . J Biol Chem.
2011; ; 286 : :43596.–43600. 10.
Marquet
R
,
Guerrero
S
,
Bernacchi
S.
Un facteur de transcription se fait complice du VIH-1 pour détruire les défenses cellulaires . Med Sci (Paris).
2012; ; 28 : :356.–358. |