| |
| Med Sci (Paris). 2012 November; 28(11): 914–917. Published online 2012 November 12. doi: 10.1051/medsci/20122811004.Expulser les cellules suspectes La politique épithéliale Laure Coulombel1* 1médecine/sciences, ADR Inserm Paris V, 2, rue d’Alésia, 75014Paris, France MeSH keywords: Animaux, Anoïkis, physiologie, Adhérence cellulaire, Numération cellulaire, Mouvement cellulaire, Transformation cellulaire néoplasique, Cellules cultivées, cytologie, Chiens, Drosophila melanogaster, embryologie, croissance et développement, Cellules épithéliales, anatomopathologie, Gènes erbB-2, Humains, Jonctions intercellulaires, Cellules rénales canines Madin-Darby, Mammifères, Modèles biologiques, Métastase tumorale, Récepteur ErbB-2, biosynthèse |
Les premières étapes de la transformation tumorale sont les plus mal connues parce que leur modélisation est limitée par la difficile reconstitution in vitro de la complexité de l’architecture tissulaire in vivo, et par la difficulté de saisir expérimentalement à l’échelon clonal les tout premiers évènements de la transformation. Plusieurs articles récents abordent cette question en révélant comment un épithélium expulse une cellule au comportement suspect, qui risquerait donc de rompre l’équilibre du tissu. Mais ce processus d’expulsion peut aussi être une réponse physiologique : chez l’embryon, la délamination est un processus normal de morphogenèse des cellules neurales ou encore des cellules souches hématopoïétiques à partir de l’endothélium comme l’ont décrit C. Robin [
1] et P. Herbomel [
2] dans ces colonnes ; il peut aussi s’agir de l’expulsion de cellules apoptotiques ou en surnombre dans un épithélium en renouvellement. À moins, malheureusement, que ce ne soit une stratégie habile des cellules tumorales pour se libérer d’un environnement contraint et inhibiteur et proliférer sans retenue. Nous illustrons ci-dessous quelques-uns des exemples récemment décrits dans la littérature de l’expulsion par un épithélium adulte de cellules vivantes [
3,
7]. |
Un épithélium très vigilant L’expulsion d’une cellule hors d’un épithélium, par la voie apicale ou basale, a été bien étudiée chez la drosophile. Dans une Nouvelle publiée en 2010 dans médecine/sciences, S. Dupré-Crochet et al. [3] décrivait un exemple de ce processus d’exclusion chez les mammifères. Ainsi, l’induction, dans une couche confluente de cellules MDCK (Madin-Darby canine kidney) normales, de l’expression de Rasv12 - une forme mutée de Ras -, ou celle de v-Src dans des cellules isolées, entraîne l’expulsion rapide de ces cellules à la surface apicale de la monocouche [3,
4]. L’expulsion ne se produit que si la cellule transformée reste entourée de cellules normales. Quel est le signal d’alerte, et qui le lance ? « Comment les cellules transformées et les cellules normales peuvent-elles reconnaître leurs différences ? » [3, 4]. Malgré la caractérisation de quelques uns des acteurs moléculaires, cette extrusion reste mal expliquée. Les auteurs soulignaient la nécessité de modèles plus physiologiques chez l’homme pour explorer l’hypothèse d’un mécanisme très précoce de protection contre la progression de la carcinogenèse et l’émergence de métastases. C.T. Leung et J.S. Brugge ont exaucé ce vœu et viennent de publier dans Nature [
5] l’analyse détaillée de ce processus d’extrusion dans un modèle 3D qui mime l’organisation en structures acinaires polarisées typiques de la glande mammaire (Figure 1A). Les cellules de la lignée humaine épithéliale mammaire MCF10A cultivées sur Matrigel (un équivalent de la membrane basale) forment des structures acinaires quiescentes, polarisées et organisées autour d’une lumière centrale (Figure 2). L’infection de ces structures cellulaires par de très faibles doses d’un lentivirus porteur d’une construction bicistronique inductible (Tet), induisant la coexpression d’un oncogène et d’une étiquette fluorescente GFP (green fluorescent protein), permet de cibler une cellule sur 10 acinus, ce qui mime la survenue d’un événement tumoral clonal. L’étiquette fluorescente permet de suivre le comportement de cette cellule transformée.
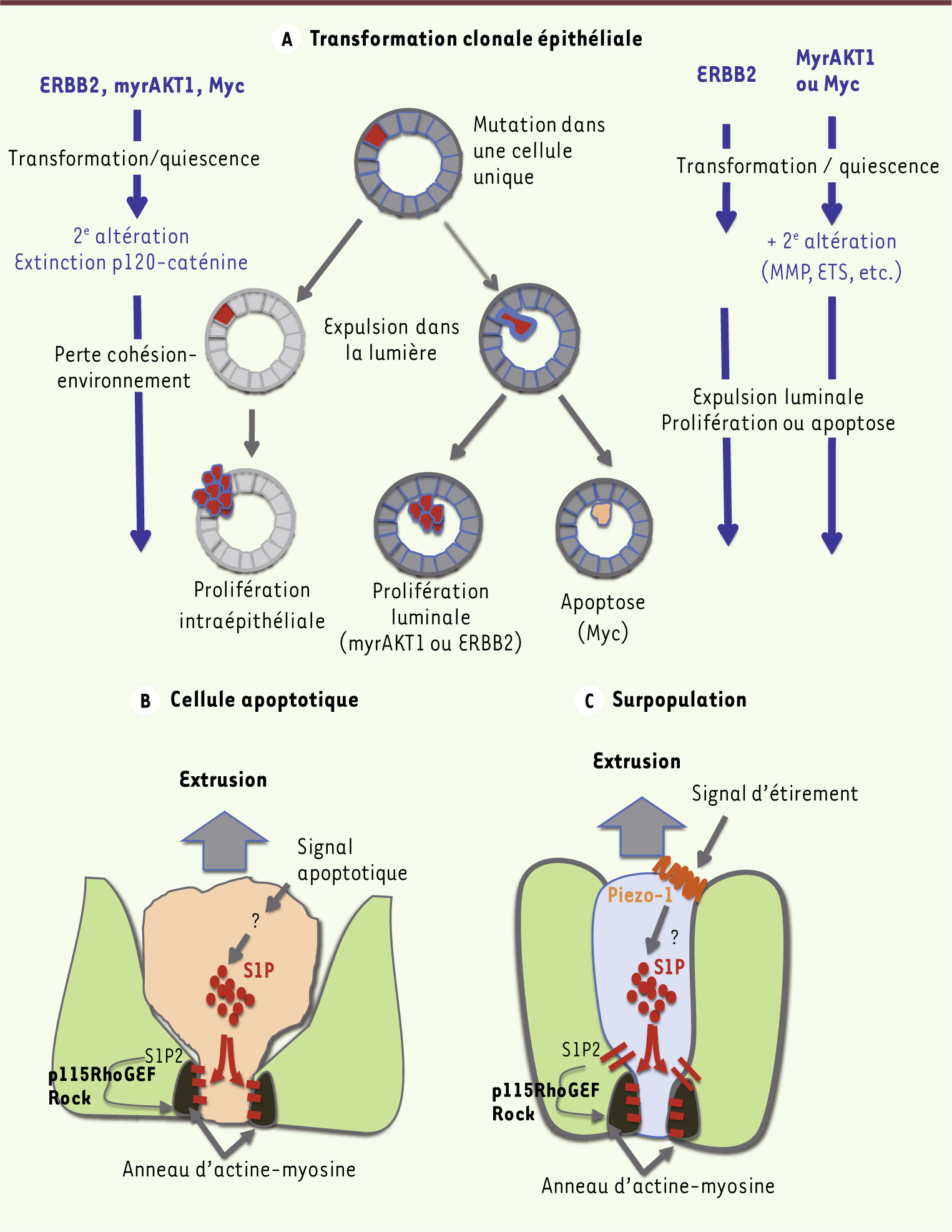
 | Figure 1.
Modèles d’extrusion de cellules d’un épithélium. Trois modèles récemment illustrés dans la littérature sont schématisés. A. Translocation vers la lumière d’une cellule épithéliale exprimant une mutation oncogène (adapté de [ 5]). Un événement transformant (oncogène) est induit dans une cellule d’une couche épithéliale (situation clonale). Cet événement induit dans la cellule des modifications qui entraînent sa migration vers la lumière de la structure acinaire, alors qu’elle est encore quiescente (à droite). Selon l’oncogène utilisé, une seconde altération sera nécessaire (induction des MMP, fragilisation des contacts cellules-matrice, etc.) à l’expulsion vers la lumière. Une fois dans la lumière, la cellule soit mourra par apoptose, soit proliférera, ce choix étant dicté par la nature de l’oncogène utilisé. En revanche, si l’ensemble de la structure épithéliale est d’emblée fragilisée (à gauche), cette dernière perd son action suppressive sur le cycle cellulaire et les cellules mutées peuvent proliférer in situ. L’expulsion d’une cellule apoptotique (B) (adapté de [
10]) ou d’une cellule en surnombre (C) fait appel à un autre mécanisme : contraction de l’anneau d’actine-myosine dans les cellules voisines en réponse à l’action de la sphingosine-1 phosphate (S1P) sécrétée par la cellule anormale. Mais, le stimulus déclenchant est différent. En B., il s’agit d’un signal apoptotique. En C., il s’agit de modifications physiques de la cellule anormale activant les canaux ioniques de type Piezo-1. p115RhoGEF : Rho guanine exchange factor. |
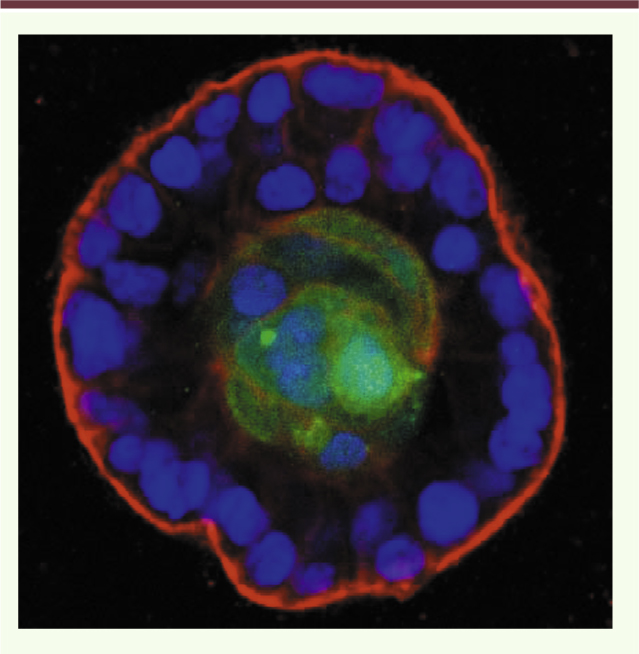
 | Figure 2.
Prolifération d’un clone tumoral dans la lumière acinaire. Une cellule d’un acinus mammaire (formé par les cellules MCF10A) a été transformée via la surexpression de ERBB2, ce qui a entraîné son expulsion via la surface luminale de l’épithélium. Une fois libérée dans la lumière, cette cellule a proliféré, entraînant la formation d’un clone multicellulaire. Les cellules tumorales ERBB2 expriment la GFP et apparaissent en vert, la membrane basale est marquée par un anticoprs anti-laminine-γ2 (rouge) et les noyaux de l’épithlium sont reconnaissables par le marquage DAPI (4,6-diamidino-2 phénylindole) (bleu) (cette photographie nous a été aimablement donnée par Cheuk T. Leung et Joan S. Brugge [ 5]). |
L’expression de ERBB2 (HER2) dans ce modèle - un récepteur à activité tyrosine kinase membre de la famille des récepteurs de l’EGF (epidermal growth factor) et dont le gène est amplifié dans 30 % des cancers du sein - induit systématiquement la prolifération clonale des cellules transformées. Mais, fait remarquable, avant de proliférer, les cellules ERBB2 (HER2)+ migrent dans la lumière de la structure acinaire (Figures 1A
et
2). Ce sont des cellules quiescentes qui sont expulsées, l’induction de la prolifération ne survient que secondairement. Cette séquence ne s’observe pas avec d’autres oncogènes (c-Myc, myrAkt1, HPV [human papillomavirus] 16-E7 ou un mutant actif de la cycline D1). Cette expulsion fait intervenir la voie MAPK, la rupture des interactions cellules-matrice extracellulaire via l’action de protéases (dont les MMP, matrix metalloproteinases) et/ou l’interruption de la voie des intégrines. De fait, l’expression de MMT1-MMP (ou celle de ETS-1, un transactivateur connu de ces MMP et cible des MAPK) ou l’extinction de la taline (protéine-relais entre les intégrines et le cytosquelette), suffit à induire l’extrusion luminale des cellules dans ce modèle. La MMP en cause ici n’a pas été identifiée précisément. Pourquoi les cellules transformées par l’oncogène ne prolifèrent-elles pas dans la couche épithéliale ? C.T. Leung et J.S. Brugge apportent des arguments indirects en suggérant qu’un épithélium intact et cohésif a une action suppressive sur l’entrée en cycle. En effet, la déstabilisation des jonctions intercellulaires par l’extinction (au moyen de shARN) de la p120-caténine induit effectivement l’expansion clonale in situ - intraépithéliale et non pas luminale - des cellules exprimant c-Myc, myrAkt1 ou ERBB2 (Figure 1A). Si l’épithélium n’est pas déstabilisé, seule l’expulsion dans la lumière permet l’entrée en cycle et l’expansion des cellules exprimant l’oncogène transformant (Figure 1A). Ce processus peut apparaître comme une première protection contre la progression de cellules prénéoplasiques. Une seconde protection vient de l’apoptose qui est souvent induite dans les cellules dont on force l’extrusion. C’est vrai lors de l’expression de c-Myc, ETS1 ou MT1-MMP, mais ce n’est pas vrai des cellules qui expriment myrAKT et ERBB2. Cette étape d’induction tumorale très précoce, qui ne s’accompagne pas de transition épithélio-mésenchymateuse, pourrait correspondre au stade de carcinome in situ des cancers humains. On peut penser qu’un épithélium normal, s’il représente une barrière efficace contre le développement d’un cancer, peut permettre la persistance sous forme quiescente de cellules transformées, qui n’attendent qu’une défaillance de l’environnement pour proliférer. En cas d’extrusion, une migration métastatique très précoce de cellules tumorales est possible. Or on sait que des cellules métastatiques ayant les caractéristiques génomiques de cellules tumorales « préinvasives» ont été détectées dans la moelle osseuse de patientes atteintes de cancer du sein [
8]. |
Comment garder constant le nombre de cellules d’un épithélium Une autre circonstance qui pourrait conduire un épithélium à éliminer des cellules est celle de son renouvellement : il lui faut en effet respecter les contraintes que lui impose un substrat aux dimensions très strictes, mais sans compromettre l’intégrité de la barrière qu’il forme et qui protège les organes sous-jacents. Cela implique un nombre constant de cellules viables, et donc la nécessaire élimination des cellules apoptotiques ou produites en excès. L’analyse de cet équilibre subtil constitue le sujet de prédilection de J. Rosenblatt. Son équipe a démontré précédemment que, dans un épithélium (cellules MDCK, cellules bronchiques humaines ou épiderme de poisson zèbre), si une cellule apoptotique émerge, elle demande - dans un élan de dévouement pour la collectivité - à ses voisines de l’exclure. Pour ce faire, elle synthétise et émet un signal chimique, le sphingosine-1 phosphate qui, en se fixant sur le récepteur SIP2 de ses voisines, enclenche la voie Rho/ROCK qui provoque la contraction des anneaux d’actine en situation basolatérale, et pousse la cellule dehors [
9, 10] (Figure 1B). Mais qu’en est-il en l’absence d’apoptose si le nombre de cellules vivantes s’avère excessif ? Dans les trois modèles utilisés par les auteurs [
6], épiderme des nageoires de poisson zèbre, épithélium colique humain et cellules épithéliales canines (MDCK), les images d’extrusion décelées spontanément prédominent là où la densité cellulaire est la importante (face luminale colique ou courbures). Pour modéliser ce processus et provoquer une densité cellulaire excessive in vitro, les auteurs ont astucieusement étiré une couche de cellules MDCK cultivées sur une membrane de silicone jusqu’à 28 % au-delà de sa longueur normale, et l’ont ensuite relâchée, créant un excès de densité cellulaire pour l’espace disponible (144 cellules / 100 µm2 pour 110 initialement), sans pour autant rompre les jonctions adhérentes ou serrées (exprimant la β-caténine ou ZO-1 [zonula occludens 1]) ni l’adhérence au substrat. Dès six heures, la densité cellulaire était revenue à la normale, soit 110 cellules / 100 µm2. Cette restauration se fait via l’extrusion de cellules vivantes et non pas apoptotiques et fait intervenir la contraction d’anneaux d’actine (Figure 1C). Comme pour l’expulsion de cellules apoptotiques, le messager est la sphingosine-1 phosphate qui, via son récepteur SIP2 et la voie Rho en aval, active le système actine-myosine à la base des cellules voisines, celles-ci expulsant les cellules en excès. Les cellules expulsées sont vivantes et le demeurent 24 heures. Quels sont les signaux déclenchant le processus d’extrusion ? Il s’agit en fait d’un signal d’étirement, relayé par les canaux ioniques qui transmettent l’information émanant de stimulations mécaniques. Le blocage de ces canaux par le gadolinium entraîne un excès de cellules au bord des arêtes des poissons zèbres, une zone d’extrusion habituelle dans ce modèle d’épithélium. Un criblage par extinction de molécules candidates par des morpholinos ou des photo-morpholinos (activables par la lumière) a permis d’identifier la protéine Piezo-1 que B. Coste nous a récemment présentée dans ces colonnes, et qui est exprimée dans différents tissus mécanosensibles tels que les poumons, la vessie, les rein, le côlon ou la peau [
11]. Un processus très semblable (publié aussi dans Nature en 2012 [7]) a été identifié chez la drosophile lors de la transition larve-pupe et de la réorganisation du notum du thorax, avec expulsion soit par voie apicale, soit par contraction des cellules voisines, de cellules vivantes qui meurent ensuite d’anoikis. |
La juxtaposition de ces articles est intéressante car elle révèle la diversité des mécanismes qu’un épithélium met en place pour contrôler son intégrité. En situation physiologique de renouvellement, ou de réorganisation lors de la métamorphose par exemple, la compétition fait rage car la « place » disponible n’est pas extensible ; le signal est surtout mécanique, pression ou étirement, et le choix de la cellule expulsée peut être aléatoire. S’il s’agit de la survenue d’une mutation sournoise, c’est la cellule précancéreuse elle-même qui signale le danger, mais nous avons vu que ce peut être un piège. On imagine donc bien qu’une altération de ces signaux ou de leurs détecteurs peut rompre cet équilibre et déclencher un processus pathologique. Mais tout cela se passe dans l’infiniment petit, à l’échelon de cellules uniques, et pourtant ce serait à ce niveau qu’il faudrait agir. Utopie ? |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1.
Boisset
JC
,
Robin
C.
Origine endothéliale des cellules souches hématopoïétiques - La preuve en image . Med Sci (Paris).
2011; ; 27 : :875.–881. 2.
Kissa
K
,
Herbomel
P.
Blood stem cells emerge from aortic endothelium by a novel type of cell transition . Nature.
2010; ; 464 : :112.–115. 3.
Dupré-Crochet
S
,
Hogan
C
,
Fujita
Y.
Interactions entre cellules épithéliales normales et transformées : conflit de voisinage . Med Sci (Paris).
2010; ; 26 : :457.–458. 4.
Hogan
C
,
Dupré-Crochet
S
,
Norman
M
, et al.
Characterization of the interface between normal and transformed epithelial cells . Nat Cell Biol.
2009; ; 11 : :460.–467. 5.
Leung
CT
,
Brugge
JS.
Outgrowth of single oncogene-expressing cells from suppressive epithelial environments . Nature.
2012; ; 482 : :410.–413. 6.
Eisenhoffer
GT
,
Loftus
PD
,
Yoshigi
M
, et al.
Crowding induces live cell extrusion to maintain homeostatic cell numbers in epithelia . Nature.
2012; ; 484 : :546.–549. 7.
Marinari
E
,
Mehonic
A
,
Curran
S
, et al.
Live-cell delamination counterbalances epithelial growth to limit tissue overcrowding . Nature.
2012; ; 484 : :542.–545. 8.
Schardt
JA
,
Meyer
M
,
Hartmann
CA
, et al.
Genomic analysis of single cytokeratin-positive cells from bone marrow reveals early mutational events in breast cancer . Cancer Cell.
2008; ; 8 : :227.–239. 9.
Rosenblatt
J
,
Raff
MC
,
Cramer
LP.
An epithelial cell destined for apoptosis signals its neighbors to extrude it by an actin- and myosin-dependent mechanism . Curr Biol.
2001; ; 11 : :1847.–1857. 10.
Gu
Y
,
Forostyan
T
,
Sabbadini
R
,
Rosenblatt
J.
Epithelial cell extrusion requires the sphingosine-1-phosphate receptor 2 pathway . J Cell Biol.
2011; ; 193 : :667.–676. 11.
Coste
B.
Détecter la pression ? Identification de deux protéines activées par les forces mécaniques . Med Sci (Paris).
2011; ; 27 : :17.–19. |