| |
| Med Sci (Paris). 2012 November; 28(11): 932–934. Published online 2012 November 12. doi: 10.1051/medsci/20122811010.Systèmes d’interface neuronale Le futur c’est (presque) maintenant Nicolas Y. Masse1* and Beata Jarosiewicz2,3** 1Department of Neurobiology, University of Chicago, Chicago, Illinois, États-Unis 2Department of Neuroscience, Brown University, Providence, Rhode Island, États-Unis 3Rehabilitation Research and Development Service, Department of Veterans Affairs, Providence, Rhode Island, États-Unis MeSH keywords: Organes artificiels, tendances, Ondes du cerveau, Interfaces cerveau-ordinateur, Électrodes implantées, Conception d'appareillage, Prévision, Humains, Systèmes homme-machine, Mouvement, Robotique, instrumentation, Dispositifs d'assistance au mouvement, Interface utilisateur |
Les grands enjeux des systèmes d’interface neuronale Parmi les millions de patients victimes de lésions cérébrales, partiellement ou totalement paralysés et dans certains cas complètement muets, certains conservent malgré tout leurs capacités cognitives. Les méthodes d’assistance à ces patients paralysés sont rares et limitées, et se basent la plupart du temps sur l’exploitation de mouvements résiduels. Au cours de cette dernière décennie, quelques laboratoires ont tenté de développer des méthodes plus puissantes capables de rendre une certaine mobilité à ces patients. Il s’agit des systèmes d’interface neuronale (SIN) : ils peuvent, à partir de l’activité neuronale, décoder les intentions de mouvements des patients et les transformer directement en mouvements d’un effecteur artificiel, curseur sur un écran d’ordinateur, bras robotisé ou autres appareils d’assistance [
1–
5]. Au cours d’une étude récente, la Brain-Gate collaboration a développé un SIN basé sur le décodage de l’activité neuronale enregistrée à l’aide d’une matrice de microélectrodes implantée dans le cortex moteur [
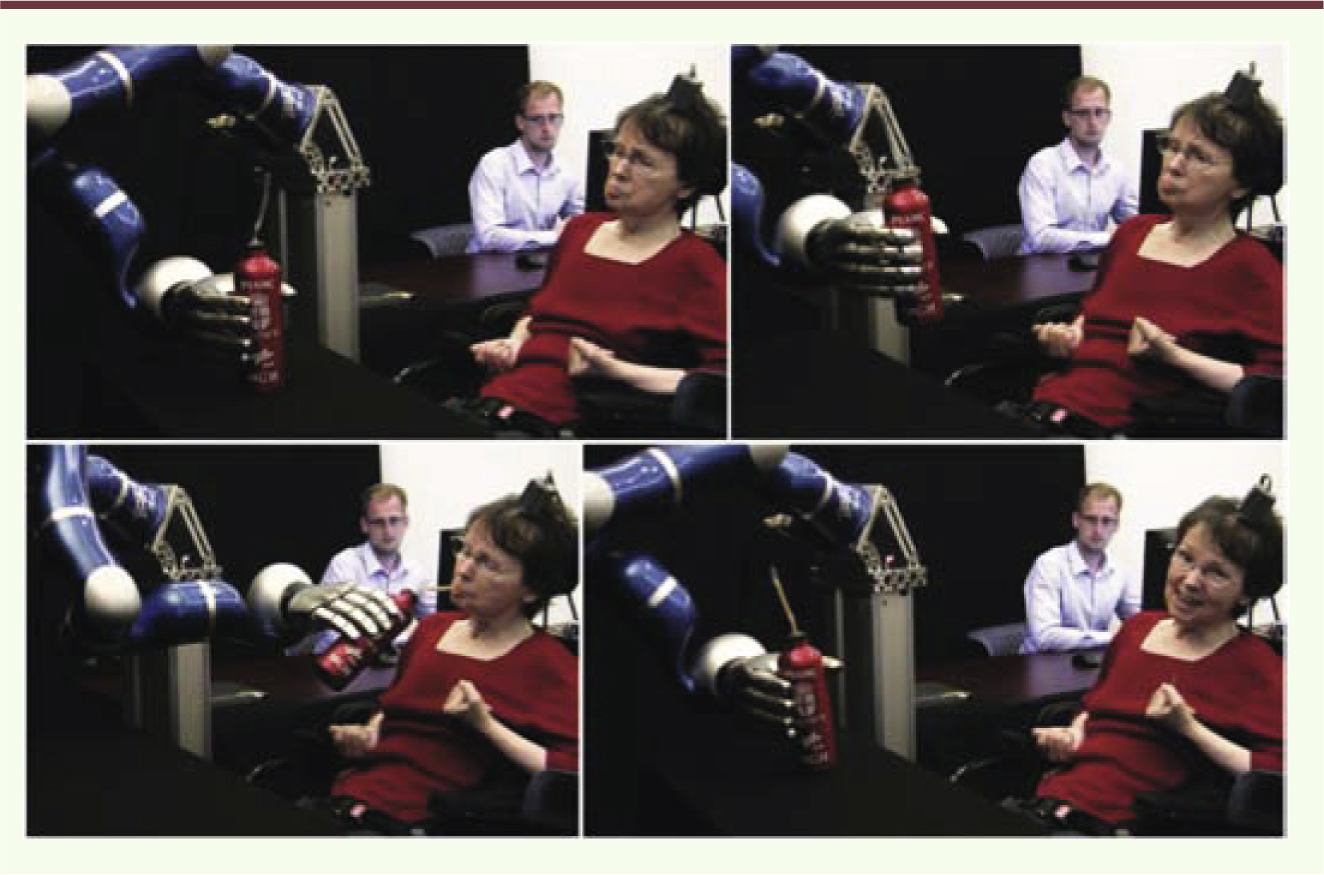
6]. Cela a permis à deux patients tétraplégiques de contrôler un bras robotisé et d’effectuer des mouvements de préhension d’objets dans un environnement en trois dimensions. Une participante a réussi, grâce à ce SIN et au bras robotisé, à prendre un thermos posé sur la table lui faisant face et à boire un café (Figure 1). C’était la première fois en 15 ans que cette personne pouvait se servir et boire un café de façon autonome. Il est important de noter que la matrice d’électrodes avait été implantée chez cette patiente plus de cinq ans auparavant, ce qui démontre que ce type de matrice est capable d’enregistrer efficacement l’activité neuronale sur des périodes beaucoup plus longues qu’on ne l’avait anticipé initialement.
 | Figure 1.
Exemple d’un système d’interface neuronal en 3D. Cathy Hutchinson, participante au projet BrainGate2, contrôle un bras robotisé lors d’un essai clinique. Grâce au SIN, elle prend un thermos rempli de café posé sur la table, l’amène à sa bouche, boit une gorgée de café et le repose sur la table [ 6]. |
|
Les SIN : de la recherche fondamentale au développement clinique Ces études ont montré le potentiel de cette technologie des SIN que, maintenant, on cherche à adapter en clinique. Les essais cliniques menés par BrainGate21 représentent une étape importante, car un de leurs buts est de tester la sécurité de l’utilisation des SIN sur les personnes. Dans cette Nouvelle, nous nous intéressons aux progrès à accomplir en matière d’ingénierie pour que cette technologie soit suffisamment fiable pour bénéficier à un grand nombre de patients. Nous présentons des pistes pour surmonter les obstacles car nous pensons qu’une utilisation clinique des SIN est envisageable si les recherches sont correctement orientées et si des ressources suffisantes leur sont allouées. La version actuelle du SIN nécessite qu’un technicien attache un câble à un connecteur percutané, implanté sur la tête du patient lors d’une opération chirurgicale. Ce connecteur ainsi que la peau avoisinante doivent être régulièrement nettoyés et stérilisés par un assistant médical pour diminuer les risques d’infection. Quelques laboratoires explorent la possibilité de développer un système d’enregistrement sans fil et implantable, qui éliminerait l’intervention d’un assistant médical, réduirait les risques d’infection et d’irritation de la peau et donnerait au système une esthétique plus acceptable [
7]. Une des principales limites au développement de matrices implantables est liée aux besoins énergétiques nécessaires à la transmission des signaux à large bande en provenance d’une centaine d’électrodes [7]. Toutefois, notre groupe de recherche, parmi d’autres [6,
8,
9], a montré que l’information liée à l’intention de mouvement peut être décodée aussi bien à partir d’un signal filtré sur lequel un seuil est appliqué qu’à partir de potentiels d’action individuellement isolés. Cette opération de filtrage et de seuillage peut être effectuée à l’aide de filtres électroniques attachés à la matrice. Cette méthode présente de nombreux avantages : l’intégralité du signal n’est pas transmise, seul le signal dépassant le seuil l’est; la puissance nécessaire est donc considérablement réduite. La structure générale du dispositif est ainsi allégée et simplifiée, réduisant la quantité d’électronique nécessaire au traitement d’un signal neuronal et améliorant l’esthétique du connecteur. |
Développements et adaptations actuelles des SIN Le programme utilisé actuellement par le SIN nécessite l’intervention d’un technicien qualifié. Il doit sélectionner et lancer différentes tâches et applications du programme, recalibrer le décodeur lorsque cela est nécessaire, choisir les signaux neuronaux à inclure dans la calibration, etc. Le but des SIN est de rendre leur autonomie à des patients paralysés, chacune de ces étapes devrait donc être automatisée ou contrôlée directement par le patient. Une étape importante du développement clinique de cette technique, actuellement en cours, consiste en l’automatisation des routines de calibrations du filtre en charge de l’extraction des intentions de mouvement à partir du signal neuronal enregistré au cours de l’utilisation du SIN [
10]. En raison des légers mouvements combinés des électrodes et des tissus, la précision du filtre se dégrade avec le temps et ce dernier doit être recalibré régulièrement pour assurer le bon fonctionnement du système. Cette calibration est aujourd’hui effectuée en demandant aux patients d’imaginer qu’ils sont en train de bouger un curseur ou un bras robotisé [1, 5], voire de le faire bouger sous contrôle neuronal [
2,
3, 6], en direction de cibles dont les positions ont été préalablement spécifiées. Pendant ce temps, le signal neuronal est décodé et associé de facto au mouvement requis. Toutefois, pendant l’utilisation quotidienne du SIN, les cibles ne peuvent pas être préassignées et l’utilisateur doit être capable de sélectionner ses propres cibles parmi une multitude de possibilités. Par exemple, il pourrait, à l’aide du SIN, déplacer un curseur sur un écran d’ordinateur et grâce à une interface dédiée, sélectionner des lettres et des mots pour envoyer un courrier électronique. Une recalibration fréquente du système en cours d’utilisation perturberait l’utilisateur. Il est donc nécessaire que la calibration soit effectuée en ligne. Des données préliminaires montrent qu’il est en effet possible de calibrer en continu, en arrière-plan de la tâche effectuée, en inférant a posteriori le mouvement désiré par le patient en se basant sur sa propre sélection [10]. Cette méthode permet, théoriquement, de maintenir un contrôle neuronal de l’effecteur pour une durée indéterminée dans une application donnée, sans nécessité de suspendre temporairement et de manière récurrente l’application pour recalibrer le système. |
L’exemple d’un SIN pour le contrôle de mouvements en 2D Bien que faciliter les méthodes de calibration pour un bras robotisé reste un objectif important pour la généralisation clinique des SIN, nous pensons que, dans un premier temps, il serait plus réaliste de se focaliser sur des problèmes plus modestes et plus faciles à résoudre, comme le contrôle total d’un curseur sur un écran d’ordinateur. En effet, il est beaucoup plus simple de contrôler un curseur dont les mouvements se limitent à des déplacements en deux dimensions, comme sur un écran, qu’un bras robotisé dans un environnement en trois dimensions. D’excellents résultats ont ainsi été obtenus dans le contrôle neuronal de mouvements en 2D, et leur efficacité était comparable à celle d’un contrôle manuel par des personnes sans infirmité [
4,
11]. Il est aussi relativement simple de recalibrer de manière automatique les mouvements d’un curseur dans un environnement en 2D. En revanche, contrôler un bras robotisé dans un environnement en 3D rempli d’obstacles rendrait plus compliquée l’interprétation des intentions de mouvement des patients lors des routines de calibration automatique. Enfin, limiter dans un premier temps les SIN au contrôle d’un curseur virtuel sur un écran d’ordinateur limiterait les coûts liés aux seules matrices d’électrodes et à l’intervention chirurgicale nécessaire à leur implantation in situ. De plus, un ordinateur grand public suffit amplement au contrôle des programmes dédiés. Même limitée au contrôle d’un curseur d’ordinateur, la généralisation de SIN serait une avancée considérable, permettant aux personnes paralysées l’utilisation autonome d’un ordinateur, et offrant à des personnes muettes un mode de communication efficace. Théoriquement, le gain d’autonomie devrait même permettre aux personnes complètements invalides de retrouver une activité professionnelle, ce qui serait une avancée importante pour la société ainsi que pour les utilisateurs des SIN. Bien que ces obstacles ne soient pas encore levés, des solutions sont envisagées et jamais la mise en place de SIN à visée clinique n’a été aussi proche. Les efforts d’ingénierie, le développement de matrices d’électrodes approuvées pour l’usage chez l’homme, ainsi que l’affinement des algorithmes chargés de décoder l’activité neuronale et de recalibrer le système sont à portée de main. Il est maintenant nécessaire que la communauté scientifique en fasse une priorité pour transformer ces objectifs en réalité. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Hochberg
LR
,
Serruya
MD
,
Friehs
GM
, et al.
Neuronal ensemble control of prosthetic devices by a human with tetraplegia . Nature.
2006; ; 442 : :164.–171. 2.
Velliste
M
,
Perel
S
,
Spalding
MC
, et al.
Cortical control of a prosthetic arm for self-feeding . Nature.
2008; ; 453 : :1098.–1101. 3.
Taylor
DM
,
Helms Tillery
SI
,
Schwartz
AB.
Direct cortical control of 3D neuroprosthetic devices . Science.
2002; ; 296 : :1829.–1832. 4.
Santhanam
G
,
Ryu
S
,
Yu
B
, et al.
A high-performance brain-computer interface 3 . Nature.
2006; ; 442 : :195.–198. 5.
Simeral
JD
,
Kim
SP
,
Black
MJ
, et al.
Neural control of cursor trajectory, click by a human with tetraplegia 1000 days after implant of an intracortical microelectrode array . J Neural Eng.
2011; ; 8 : :025027.. 6.
Hochberg
LR
,
Bacher
D
,
Jarosiewicz
B
, et al.
Reach and grasp by people with tetraplegia using a neurally controlled robotic arm . Nature.
2012; ; 485 : :372.–375. 7.
Nurmikko
AV
,
Donoghue
JP
,
Hochberg
LR
, et al.
Listening to brain microcircuits for interfacing with external world-progress in wireless implantable microelectronic neuroengineering devices: experimental systems are described for electrical recording in the brain using multiple microelectrodes and sho . Proc Inst Electr Electron Eng.
2010; ; 98 : :375.–88. 8.
Chestek
CA
,
Gilja
V
,
Nuyujukian
P
, et al.
Long-term stability of neural prosthetic control signals from silicon cortical arrays in rhesus macaque motor cortex . J Neural Eng.
2011; ; 8 : :045005.. 9.
Fraser
GW
,
Chase
SM
,
Whitford
A
,
Schwartz
AB.
Control of a brain-computer interface without spike sorting . J Neural Eng.
2009; ; 6 : :055004.. 10.
Jarosiewicz
B
,
Masse
NY
,
Bacher
D
, et al.
Context dependence of neural tuning in motor cortex of people with paralysis: implications for neural prosthetics . Program n° 142.22. Neuroscience Meeting Planner. , Washington, DC: : Society for Neuroscience; , 2011 (online). 11.
Sussillo
D
,
Nuyujukian
P
,
Fan
JM
, et al.
A recurrent neural network for closed-loop intracortical brain-machine interface decoders . J Neural Eng.
2012; ; 9 : :026027.. |