Est-ce que de nouveaux neurones sont formés au cours de la vie dans le bulbe olfactif humain ? Non, selon une étude menée par K.L. Spalding et J. Frisén, de l’Institut Karolinska à Stockholm (Suède) [ 1]. Dans cette étude parue récemment dans la revue Neuron, Bergmann et al. [1] montrent que les neurones du bulbe olfactif humain sont aussi âgés que l’individu. Chez les mammifères rongeurs, deux régions du cerveau, l’hippocampe et le bulbe olfactif, possèdent la capacité de former de nouveaux neurones à l’âge adulte [ 2, 3]. Les jeunes neurones proviennent de deux zones germinatives riches en cellules souches neuronales : la zone sous-granulaire (ZSG) du gyrus denté dans l’hippocampe et la zone sous-ventriculaire (ZSV) le long des ventricules cérébraux. La ZSV contient des cellules souches neuronales qui se différencient en neuroblastes pour ensuite migrer vers le bulbe olfactif tout au long de la vie [ 4]. La neurogenèse du bulbe olfactif a été démontrée chez les rongeurs et les primates. Cependant, chez l’humain, la migration des neurones vers le bulbe olfactif décline de façon abrupte durant la petite enfance [ 5, 6], et la persistance d’une neurogenèse du bulbe olfactif chez l’homme adulte n’a pas été établie.
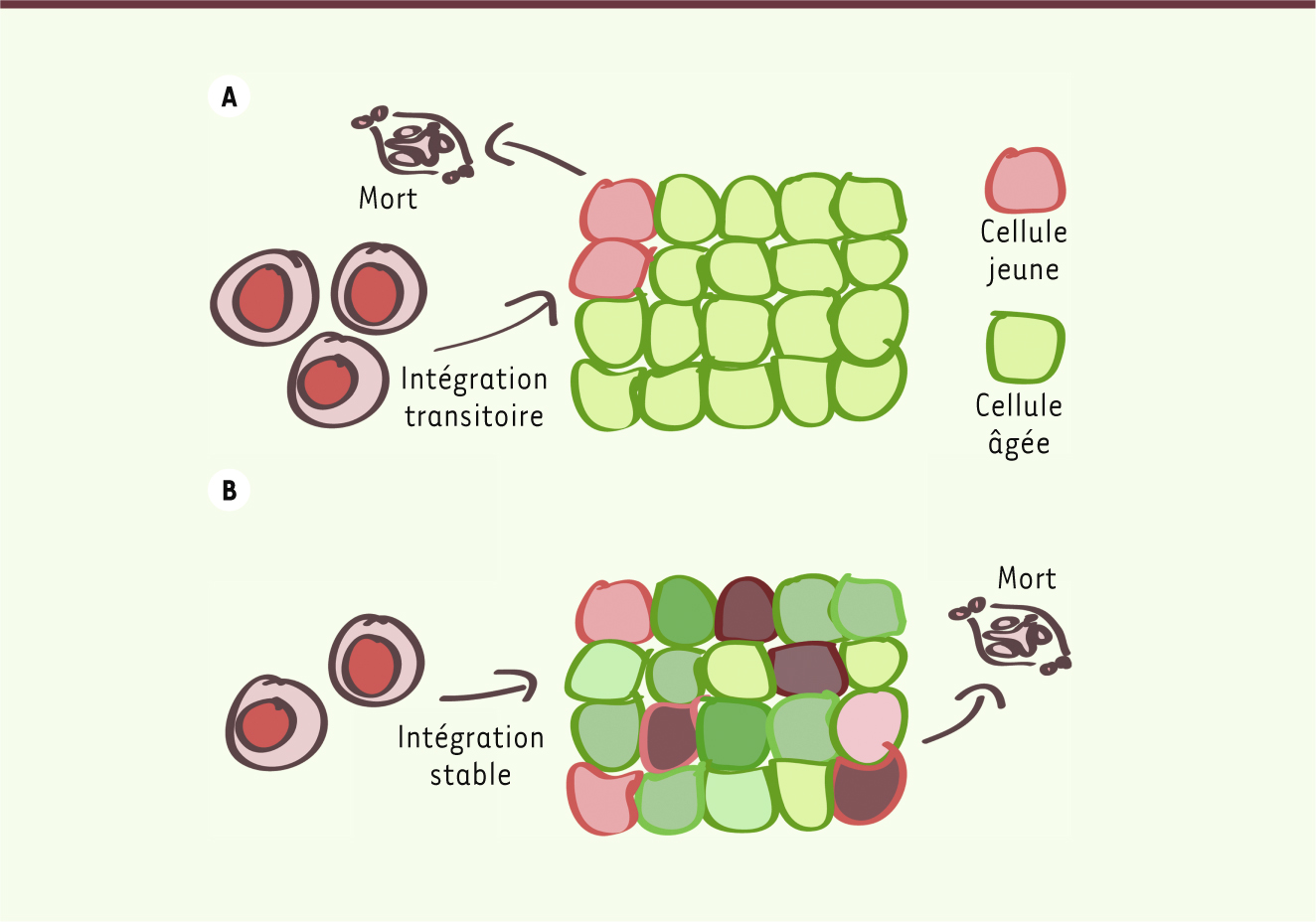
La seule présence de neuroblastes ne suffit pas à quantifier le rythme d’intégration des neurones dans le bulbe olfactif. La différenciation des neuroblastes peut se solder par une neurogenèse transitoire et un renouvellement faible des neurones (Figure 1A), ou une intégration stable des neurones et un renouvellement important (Figure 1B). Pour quantifier le renouvellement, il convient plutôt de caractériser l’âge de tous les neurones matures. En 2005, Spalding et al. [ 7] avaient développé une technique pour déterminer l’âge d’un tissu en exploitant la présence dans l’ADN génomique de carbone 14 (14C) dérivé des essais nucléaires effectués durant la guerre froide. Les essais de surface effectués avant le traité d’interdiction partielle de 19631 ont causé une augmentation marquée du taux de 14C atmosphérique. Depuis le traité, le niveau a diminué continuellement, par diffusion du 14C dans le biotope. Ce carbone entre dans la chaîne alimentaire par photosynthèse et le niveau de 14C dans le corps reflète fidèlement celui de l’atmosphère. Comme l’ADN est une molécule stable dans des cellules postmitotiques après la dernière division cellulaire, on peut déterminer l’âge d’une population de cellules d’un sujet en comparant les niveaux de 14C dans l’ADN et dans l’atmosphère depuis la naissance du sujet.
| Figure 1.
La capacité des cellules nouvellement formées à intégrer le tissu de façon stable affecte drastiquement l’âge moyen du tissu. A. L’intégration transitoire donne un âge moyen élevé et un renouvellement lent. Par exemple, si chaque année on remplace les 2 cellules jeunes d’une population constituée de 2 cellules jeunes et de 14 cellules âgées de 10 ans, l’âge moyen sera (2 cellules jeunes*0 an + 14 cellules âgées*10 ans)/(2+14 cellules) = 8,75 ans. B. L’intégration stable donne un âge moyen réduit et un renouvellement rapide. Si chaque année, les 2 cellules les plus âgées sont remplacées (âge 8 ans) parmi un total de 16 cellules : l’âge moyen sera la moyenne des âges entre les plus jeunes (0 an) et les plus vieilles (7 ans), soit (2*0 an + 2*1 an + 2*2 ans + … 2*7 ans)/16 = 3,5 ans. |
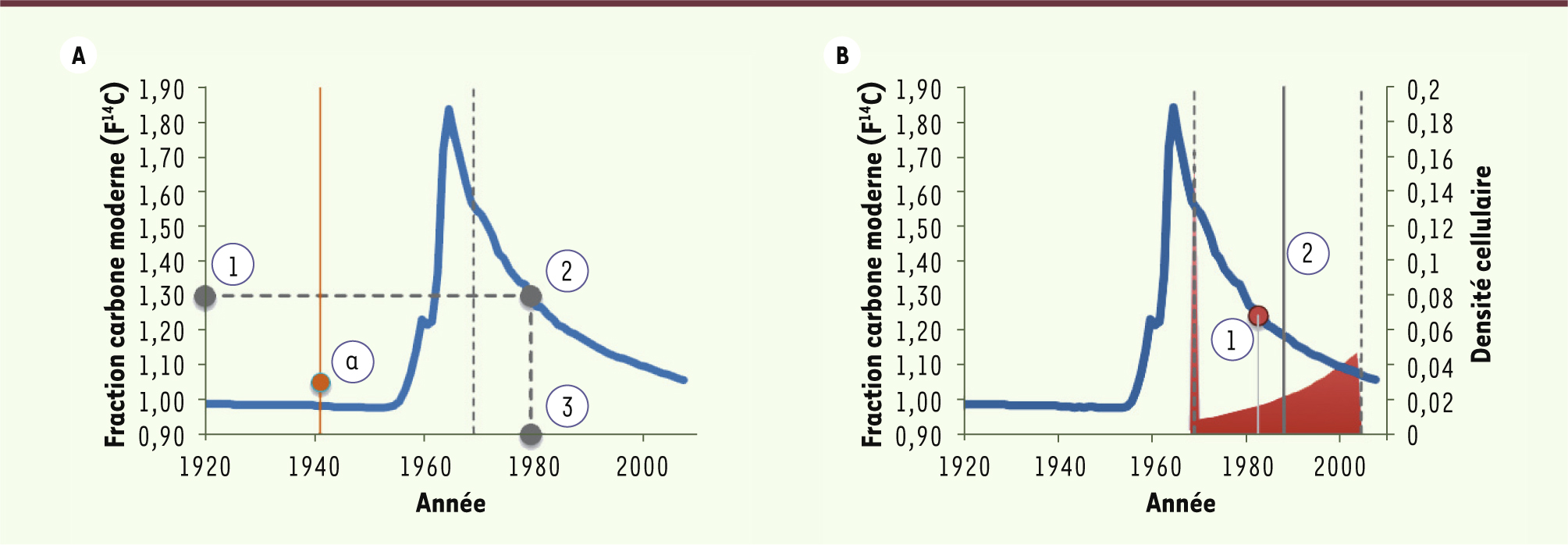
Nous avons tiré parti de la mesure du 14C cellulaire pour dater l’âge des neurones du bulbe olfactif chez l’humain [1]. Dans un tissu à renouvellement rapide, dans lequel toutes les cellules sont jeunes, le niveau de 14C mesuré est similaire à celui de l’atmosphère à la date de collection du tissu. En revanche, si les cellules sont presque aussi vieilles que le sujet, le niveau de 14C mesuré sera similaire à celui de l’atmosphère à la date de la naissance du sujet (Figure 2A). On parle d’un tissu à renouvellement lent.
| Figure 2.
Étapes de datation d’un échantillon sur la courbe de14C atmosphérique (courbe bleue). A. Pour un sujet né en 1969 (ligne pointillée verticale), le niveau de 14C, exprimé en fraction carbone moderne (1), est rapporté sur la courbe de carbone atmosphérique (2). L’année correspondant à ce niveau est 1979 (3). Pour un sujet né avant 1963 (ligne pleine verticale), le niveau de carbone ne peut pas être rapporté sur la courbe de façon unique, mais un niveau plus élevé que le niveau atmosphérique indique un renouvellement cellulaire (a). B. Exemple de datation avec renouvellement constant et une moyenne des niveaux de 14C (courbe bleue, axe de gauche) pondérée par la fraction (densité) du nombre de cellules nées chaque année (courbe rouge, axe de droite). Pour un sujet né en 1969, avec un renouvellement de 5 % par an et échantillonné en 2004, le niveau moyen de 14C dans l’ADN sera de 1,24, correspondant au niveau atmosphérique en 1982 (1). Le modèle de renouvellement constant donne une information plus précise : l’âge moyen des cellules est de 16,5 ans, pour une date de naissance moyenne de 1988 (2). |
Nous avons mesuré les niveaux de 14C dans l’ADN génomique de neurones et de cellules non neuronales du bulbe olfactif, chez plusieurs individus postmortem. Le niveau de 14C des neurones isolés du bulbe olfactif est identique au niveau de 14C mesuré dans l’atmosphère au moment de la naissance de l’individu, ce qui suggère que, s’il existe, le renouvellement est très lent. À l’opposé, le niveau de 14C dans les cellules non neuronales du bulbe olfactif est différent du niveau atmosphérique à la naissance, indiquant un renouvellement cellulaire. La comparaison des niveaux de 14C ne permet pas de quantifier directement les taux de renouvellement. Le niveau de 14C mesuré est une moyenne des niveaux d’une population cellulaire, incluant probablement des cellules d’âge différent, et elle reflète la démographie du tissu. Pour explorer les différents scénarios d’évolution démographique dans le bulbe olfactif, nous avons utilisé un ensemble de modèles mathématiques de populations cellulaires décrivant la naissance, le vieillissement et la disparition des cellules [1, 8, 9].
Dans le scénario le plus simple, le tissu est formé durant le développement et est renouvelé à un taux constant après la naissance. Le seul paramètre caractérisant ce modèle, le taux de renouvellement, correspond à la fraction de cellules mortes et remplacées chaque année. Comme le renouvellement est ininterrompu à partir de la naissance, il faut calculer la moyenne entre les niveaux de 14C des cellules survivant depuis la naissance et des nouvelles cellules accumulées à chaque année de vie (Figure 2B). Le résultat est le niveau moyen de 14C dans une population contenant des jeunes et des vieilles cellules. En ajustant le modèle aux cellules non neuronales, on trouve un taux de renouvellement de 2,0 à 3,4 % par an. Ce taux de renouvellement représente une moyenne, qui peut varier entre les différents types de cellules non neuronales. Quand le scénario de renouvellement constant est appliqué aux neurones, le taux de renouvellement obtenu est minuscule, de l’ordre de 0,008 % ± 0,08 % par an. Cela correspond à moins de 1 % de nouveaux neurones sur toute une vie ! Sachant que le taux de renouvellement pourrait atteindre 50 % par an chez les rongeurs [3], la différence est énorme. La variabilité du taux de renouvellement est grande (écart-type de 0,08 % par an), et il se peut que la neurogenèse soit plus importante chez certains sujets. Quand le scénario de renouvellement constant est ajusté pour chaque sujet individuellement, le résultat est le même : la neurogenèse est au mieux transitoire. Il se peut aussi que la neurogenèse varie avec l’âge du sujet.
D’autres scénarios décrivant des évolutions temporelles plus complexes, comme un déclin de la neurogenèse à l’âge adulte, ont été testés et donnent des résultats similaires. Même si de nouveaux neurones sont produits chez l’humain, ils ne s’intègrent pas durablement dans le bulbe olfactif. Ces résultats sont cohérents avec les études récentes indiquant une faible migration de neurones vers le bulbe olfactif passé la petite enfance [5, 6].
Chez les rongeurs, les neurones nouveau-nés du bulbe olfactif intègrent les réseaux synaptiques et participent à des fonctions complexes comme la mémoire olfactive, la discrimination d’odeur et les interactions sociales [ 10]. L’absence d’une telle neurogenèse chez l’humain soulève une question : ces fonctions sont-elles régulées par des mécanismes conceptuellement différents ? ou le rôle limité de l’olfaction chez l’humain est-il causé par le manque de plasticité du bulbe olfactif ? Les sommeliers et autres « nez » pourront peut-être apporter une partie de la solution…