| |
| Med Sci (Paris). 2013 January; 29(1): 14–17. Published online 2013 January 25. doi: 10.1051/medsci/2013291004.Vers des bisphénols sans effets hormonaux Patrick Balaguer,1 Vanessa Delfosse,2 Marina Grimaldi,1 and William Bourguet2* 1Institut de recherche en cancérologie de Montpellier, Inserm U896, Centre régional de lutte contre le cancer Val d’Aurelle Paul Lamarque, Université Montpellier 1, 34298Montpellier, France 2Centre de biochimie structurale, Inserm U1054, CNRS UMR 5048, Universités Montpellier 1 et 2, 29, rue de Navacelles, 34090Montpellier, France MeSH keywords: Animaux, Composés benzhydryliques, composition chimique, métabolisme, pharmacologie, Récepteur alpha des oestrogènes, effets des médicaments et des substances chimiques, Récepteur bêta des oestrogènes, Oestrogènes nonstéroïdiens, Humains, Modèles moléculaires, Phénols, Récepteurs des oestrogènes |
Très présent dans notre environnement domestique, le bisphénol A (BPA) est suspecté d’induire des effets hormonaux chez l’homme. Les interdictions effectives ou à venir frappant la production et la commercialisation d’objets à usage alimentaire contenant du BPA incitent les industriels du plastique à développer des molécules de substitution. Des résultats récents décrivant pour la première fois le mode d’action des bisphénols à l’échelle atomique devraient permettre la synthèse de nouveaux composés conservant leurs caractéristiques industrielles, mais dénués de propriétés hormonales. |
Les bisphénols (Figure 1A) forment une grande famille de composés chimiques utilisés dans la fabrication de nombreux produits de consommation courante. Produit à plus de trois millions de tonnes par an, le BPA entre dans la composition des plastiques et des résines. Il est utilisé par exemple dans la fabrication de récipients alimentaires et d’emballages. On le trouve également dans les films de protection à l’intérieur des canettes et des boîtes de conserve, ou encore sur les tickets de caisse où il est utilisé comme révélateur. De nombreuses applications industrielles font appel à d’autres bisphénols tels que le bisphénol AF (BPAF) pour la fabrication de membranes perméables aux gaz ou encore le bisphénol C (BPC) dans l’élaboration de polymères résistants au feu. De nombreuses études ont montré que le BPA induit des effets néfastes sur la reproduction, le développement et le métabolisme d’animaux de laboratoires [
1], et ce composé est fortement suspecté d’avoir les mêmes conséquences chez l’homme [
2]. Des analyses épidémiologiques suggèrent ainsi que l’exposition au BPA pourrait augmenter l’incidence de l’obésité [
3]. Par ailleurs, des taux significatifs de BPA ont été mesurés dans le sang, les urines et le placenta humains. La source majeure d’exposition semble être la nourriture contaminée par des molécules de BPA libérées des contenants alimentaires [
4], mais une étude récente a montré que le BPA pouvait aussi être absorbé par la peau [
5]. En conséquence, la fabrication et la commercialisation des biberons produits à base de BPA sont interdites depuis janvier 2011 en France, et cette interdiction sera étendue au 1er juillet 2015 à tout autre conditionnement, contenant ou ustensile à usage alimentaire.
 | Figure 1.
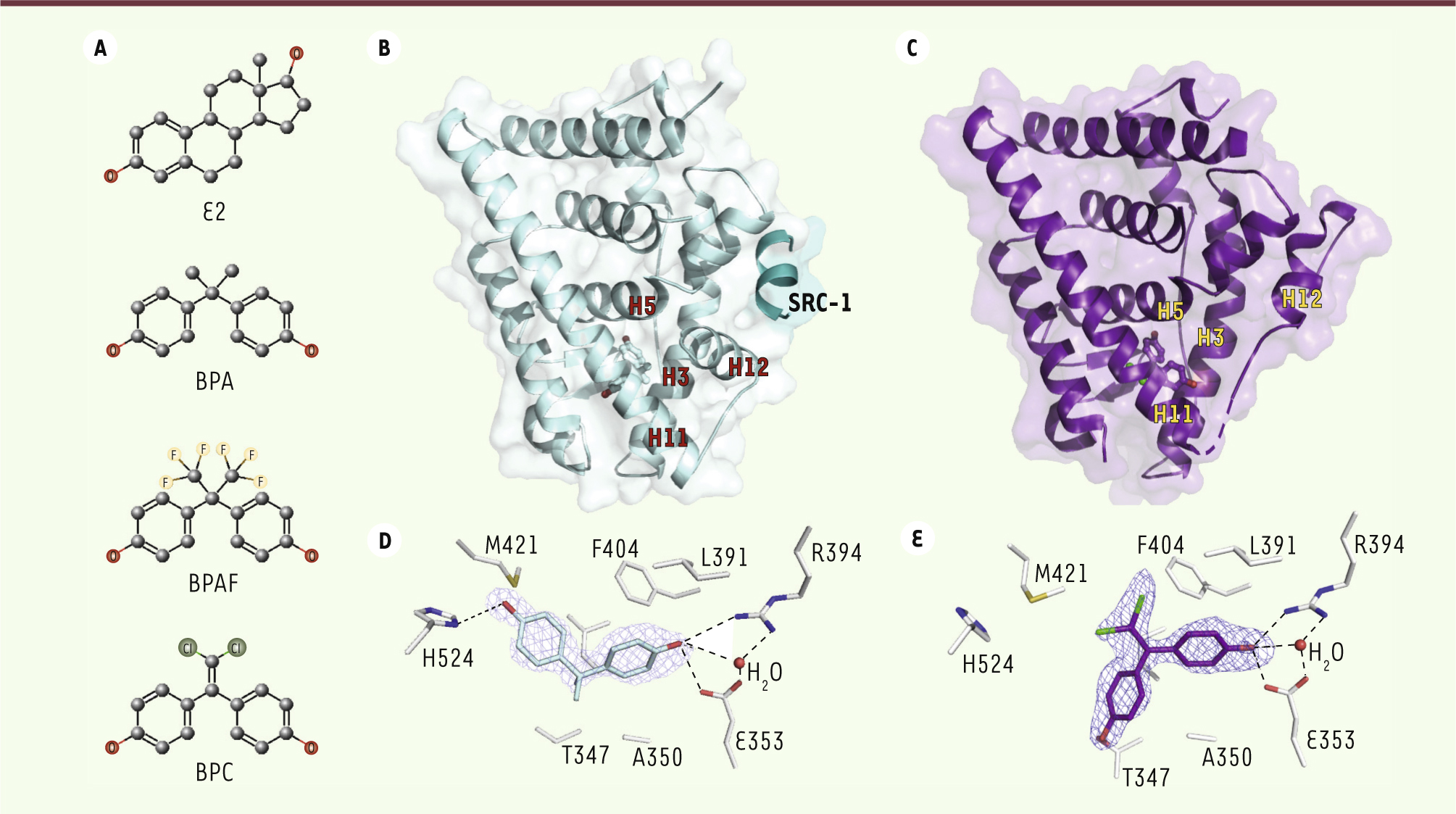
Structure des bisphénols et de leur domaine d’interaction avec les récepteurs aux œstrogènes. A. Structures chimiques de l’estradiol (E2), du bisphénol A (BPA), du bisphénol AF (BPAF) et du bisphénol C (BPC). B. Forme agoniste du HBD du récepteur ERα humain en complexe avec le BPA et un fragment peptidique du coactivateur SRC-1 (steroid receptor coactivator) contenant le motif LXXLL. C. Forme antagoniste du HBD de ERα en complexe avec le BPC. D. et E. Détail des principales interactions du BPA et du BPC avec les résidus de la poche de liaison du ligand de ERα. Les liaisons hydrogènes sont représentées par des pointillés noirs. |
|
Pourquoi le BPA est-il toxique ? Les bisphénols sont considérés comme des perturbateurs endocriniens capables d’activer certains récepteurs cellulaires en mimant l’action d’hormones naturelles [
6], principalement le 17β-estradiol (E2) qui est le ligand physiologique des récepteurs des œstrogènes ERα et ERβ. L’interaction de E2 avec ERα et ERβ induit la transcription de gènes importants pour la croissance et la maintenance de nombreux tissus, tels que la glande mammaire, l’utérus, les os, le système cardiovasculaire ou encore le système nerveux central. En se substituant à E2, les bisphénols se comportent comme des leurres hormonaux capables d’activer les récepteurs de manière non contrôlée. L’utilisation de lignées cellulaires, telles que MCF-7 (cancer du sein) ou HeLa (cancer du col de l’utérus), a permis de mettre en évidence le caractère agoniste partiel des bisphénols A, AF et C [
7]. Ces composés sont, par exemple, capables d’activer de façon complète la croissance cellulaire dans la lignée MCF-7 mais, contrairement à l’hormone naturelle, ils n’activent que partiellement l’expression de la luciférase placée sous le contrôle d’un promoteur œstrogénique dans la lignée HeLa. L’utilisation de récepteurs mutés a permis de montrer que les régions des récepteurs activées par la liaison des bisphénols diffèrent de celles activées par E2. Comme les autres membres de la famille des récepteurs nucléaires d’hormones, ERα et ERβ possèdent deux fonctions d’activation transcriptionnelle : une localisée dans la région amino-terminale (AF-1), l’autre située au niveau du domaine carboxy-terminal (AF-2) qui contient également le domaine de liaison à l’hormone. Contrairement à E2, les bisphénols activent peu (BPA) ou pas du tout (BPC) la fonction AF-2, leur activité étant essentiellement portée par la fonction AF-1 [7]. L’ensemble de ces résultats cellulaires suggèrent que les bisphénols pourraient ne pas reproduire tous les effets de E2 dans les différents tissus ciblés et soulignent l’importance du choix des tests biologiques dans l’évaluation de l’activité hormonale des bisphénols. |
Quel est le mécanisme d’action du BPA au niveau moléculaire ? De nombreuses structures cristallographiques du domaine carboxy-terminal (HBD, hormone-binding domain) de ERα et ERβ en complexe avec E2 ou avec des ligands pharmaceutiques agonistes ou antagonistes, ont été résolues. Elles ont révélé une architecture composée essentiellement de 12 hélices α (H1-H12) repliées de manière à générer une cavité hydrophobe où vient se nicher le ligand. Dans les structures avec des ligands agonistes comme E2, la dernière hélice du domaine (H12) adopte une conformation dite active engendrant la formation d’un sillon hydrophobe qui permet l’interaction avec les motifs hélicoïdaux LXXLL (L étant une leucine et X n’importe quel acide aminé) des coactivateurs. En présence d’antagonistes, tels que le tamoxifène utilisé dans le traitement du cancer du sein hormonodépendant, l’hélice H12 est déplacée et ne permet plus le recrutement de coactivateurs. La résolution des structures cristallographiques du HBD de ERα en complexe avec les trois bisphénols a révélé des mécanismes d’interaction permettant de mieux comprendre leur mode d’action à l’échelle atomique [7]. Alors que les structures avec le BPA et le BPAF présentent la forme agoniste du récepteur (Figure 1B), le complexe avec le BPC adopte une conformation antagoniste (Figure 1C), en accord avec les résultats des tests cellulaires montrant le caractère antagoniste AF-2 de ce bisphénol. Par ailleurs, ces structures mettent en évidence deux modes de liaison des bisphénols. Le BPA établit des interactions similaires à celles qui sont observées avec E2, les deux groupements hydroxyles formant des liaisons hydrogènes avec trois résidus situés de part et d’autre du site de liaison : His524 (H11) d’un côté, et Glu353 (H3) et Arg394 (H5) de l’autre (Figure 1D). Le BPC quant à lui présente un mode de liaison différent puisque l’un des phénols s’oriente vers l’hélice H12, formant une nouvelle liaison hydrogène avec la Thr347 (H3) (Figure 1E). |
Vers le développement de substituts du BPA Ces informations structurales ont ensuite été utilisées pour développer un outil de criblage virtuel qui pourrait prédire le mode de liaison de n’importe quel bisphénol aux récepteurs des œstrogènes, tout en évaluant l’effet agoniste ou antagoniste de la molécule ainsi que son affinité. Pour cela, le serveur @TOME-2 [
8] utilise les structures existantes de ERα et ERβ déposées dans la protein data bank (PDB) et intègre également les nouvelles structures (celles avec les bisphénols par exemple). Il les classe en deux groupes selon leur conformation agoniste ou antagoniste, et génère ainsi une banque interne de structures de complexes protéines-ligands. Ces structures expérimentales sont alors utilisées par le serveur comme des « ancres d’amarrage » où les ligands contenus dans les structures servent de modèles pour positionner les nouveaux composés. La plus grande variété possible en termes de diversité chimique des ligands contenus dans la banque est donc requise. Ainsi la résolution des structures avec le BPA, le BPAF et le BPC permet de positionner plus précisément les nouvelles molécules de bisphénols. Les affinités des ligands pour les formes agoniste et antagoniste des récepteurs sont ensuite évaluées à l’aide de différentes fonctions de scores. Cette approche bioinformatique a été validée en comparant les affinités prédites de sept bisphénols pour ERα et ERβ à celles mesurées expérimentalement. Non seulement le serveur a été capable de prédire les bonnes orientations des bisphénols, mais il a également évalué des affinités d’interaction (BPAF > BPC > BPB > BPA > BPE > BPF > BPS) en accord avec le classement expérimental. Cette approche in silico a ensuite été étendue au récepteur des androgènes [
9] et au récepteur apparenté aux récepteurs des œstrogènes γ [
10] (deux cibles secondaires des bisphénols), avec des résultats confirmés expérimentalement. |
En associant des approches complémentaires de biologie cellulaire, de biologie structurale et de bioinformatique, cette étude montre avec une précision encore inégalée comment les bisphénols interagissent avec les récepteurs hormonaux et modulent leur activité. Cette connaissance des mécanismes de reconnaissance bisphénol-récepteurs offre des bases rationnelles permettant de modifier la structure chimique du BPA afin qu’il perde sa capacité d’interaction avec les récepteurs d’hormones. Actuellement limité au criblage virtuel des bisphénols sur certains récepteurs humains, ce serveur devrait, à terme, permettre de prédire le caractère perturbateur endocrinien de différentes familles de xénobiotiques sur les principaux récepteurs hormonaux de différentes espèces. L’étude se poursuit donc pour mettre au jour les structures cristallographiques avec d’autres perturbateurs endocriniens tels que les alkylphénols, les pesticides, les parabènes ou encore les benzophénones, et ainsi étendre les capacités du serveur @TOME-2. Comme dans le cas des bisphénols, ces informations permettront d’orienter la recherche et la synthèse de nouveaux composés aux propriétés industrielles intactes, mais dépourvus de propriétés hormonales. |
1.
Richter
CA
,
Birnbaum
LS
,
Farabollini
F
, et al.
In vivo effects of bisphenol A in laboratory rodent studies . Reprod Toxicol.
2007; ; 24 : :199.–224. 2.
Rubin
BS
,
Soto
AM
. Bisphenol A: perinatal exposure and body weight . Mol Cell Endocrinol.
2009; ; 304 : :55.–62. 3.
Trasande
L
,
Attina
TM
,
Blustein
J.
Association between urinary bisphenol a concentration and obesity prevalence in children and adolescents . JAMA.
2012; ; 308 : :1113.–1121. 4.
Vandenberg
LN
,
Maffini
MV
,
Wadia
PR
, et al.
Exposure to environmentally relevant doses of the xenoestrogen bisphenol-A alters development of the fetal mouse mammary gland . Endocrinology.
2007; ; 148 : :116.–127. 5.
Zalko
D
,
Jacques
C
,
Duplan
H
, et al.
Viable skin efficiently absorbs and metabolizes bisphenol A . Chemosphere.
2011; ; 82 : :424.–430. 6.
Welshons
WV
,
Nagel
SC
,
vom Saal
FS.
Large effects from small exposures. III. Endocrine mechanisms mediating effects of bisphenol A at levels of human exposure . Endocrinology.
2006; ; 147 : :56.–69. 7.
Delfosse
V
,
Grimaldi
M
,
Pons
JL
, et al.
Structural and mechanistic insights into bisphenols action provide guidelines for risk assessment and discovery of bisphenol A substitutes . Proc Natl Acad Sci USA.
2012; ; 109 : :14930.–14935. 8.
Pons
JL
,
Labesse
G.
@TOME-2: a new pipeline for comparative modeling of protein-ligand complexes . Nucleic Acids Res.
2009; ; 37 : :W485.–W491. 9.
Paris
F
,
Balaguer
P
,
Terouanne
B
, et al.
Phenylphenols, biphenols, bisphenol-A and 4-tert-octylphenol exhibit alpha and beta estrogen activities and antiandrogen activity in reporter cell lines . Mol Cell Endocrinol.
2002; ; 193 : :43.–49. 10.
Okada
H
,
Tokunaga
T
,
Liu
X
, et al.
Direct evidence revealing structural elements essential for the high binding ability of bisphenol A to human estrogen-related receptor-gamma . Environ Health Perspect.
2008; ; 116 : :32.–38. |