| |
| Med Sci (Paris). 2013 January; 29(1): 19–21. Published online 2013 January 25. doi: 10.1051/medsci/2013291006.Rôle du locus H19 dans le placenta Paul Monnier1 and Luisa Dandolo1* 1Institut Cochin, Départment de génétique et développement, 24, rue Faubourg Saint-Jacques, 75014Paris, France MeSH keywords: Animaux, Développement embryonnaire, génétique, Femelle, Expression des gènes, effets des médicaments et des substances chimiques, Humains, microARN, pharmacologie, physiologie, Tumeurs, Placentation, Grossesse, ARN long non codant, Récepteur IGF de type 1 |
Le gène H19 produit un ARN non codant fortement exprimé au cours du développement embryonnaire. Découvert il y a plus de 20 ans [
1,
11], il fut, avec le gène voisin Igf2 (insulin-like growth factor 2), parmi les premiers gènes décrits comme étant soumis à l’empreinte parentale [
2,
3], mécanisme épigénétique qui conduit à une expression monoallélique de ces gènes, dépendante de l’origine parentale de l’allèle. Le gène H19 est ainsi exclusivement exprimé à partir de l’allèle hérité de la mère. De fait, ce locus H19-Igf2 a servi de modèle à la compréhension de ce mécanisme épigénétique d’empreinte parentale qui touche environ une centaine de gènes chez l’homme et la souris. |
Rôle du gène H19 dans le développement embryonnaire et la tumorigenèse En dépit du nombre important d’études portant sur ce locus, la fonction précise du gène H19 reste à ce jour encore mal comprise. Il est, chez l’homme, associé aux syndromes de Beckwith-Wiedemann et de Silver-Russell [
12], qui sont des syndromes respectivement de surcroissance somatique et de retard de croissance intra-utérin [
4]. Il fut également montré in vivo chez la souris que le gène H19 joue un rôle de suppresseur de tumeur [
5]. Enfin, toujours chez la souris, une étude a montré que ce gène régule la croissance embryonnaire en contrôlant, par un mécanisme en trans, l’expression d’un réseau de gènes soumis à empreinte parentale (IGN, imprinted gene network), dont fait partie le facteur de croissance Igf2 [
6]. Cependant, les mécanismes moléculaires via lesquels le gène H19, qui ne produit pas de protéine, exerce ces différents rôles, restent encore inconnus. |
Le long ARN non codant H19e miR-675 inhibe est le précurseur du microARN miR-675 Au début des années 2000, une structure en forme de tige-boucle, conservée entre l’homme et la souris, avait été identifiée dans l’exon 1 du gène H19. Il a été montré récemment que cette structure sert de précurseur à un microARN, le miR-675 [
7]. Ce petit ARN est fortement conservé chez les mammifères, suggérant qu’il pourrait jouer un rôle biologique important [
8]. Le locus H19 pourrait donc exercer ses différents rôles soit par son long ARN non codant, soit par l’expression de ce microARN. Une étude récente [
9] a montré que, au cours du développement embryonnaire, ce miR-675 est exprimé exclusivement dans le placenta en fin de gestation. Il est totalement réprimé dans les tissus embryonnaires, y compris dans le foie ou le cœur, tissus dans lesquels le précurseur de ce microARN, l’ARN H19, de forme longue, est fortement exprimé. Ceci suggère que la production de ce microARN à partir de la forme longue de l’ARN H19 est totalement inhibée dans les tissus embryonnaires et le placenta en début de gestation, mais que cette inhibition est un processus dynamique et qu’elle peut être levée en fin de gestation dans le placenta pour permettre son expression. |
HuR inhibe l’expression du miR-675 : rôle dans le cancer ? Des expériences d’immunoprécipitation d’ARN et de répression par siARN ont permis de montrer que la production du miR-675 est inhibée par la liaison de la protéine HuR (human antigen R) à l’ARN H19. Les résultats de cette étude suggèrent fortement que cette inhibition a lieu à l’étape du clivage du pri-miARN (l’ARN H19 de forme longue) par le complexe DROSHA dans le noyau [
13]. Cette inhibition par la protéine HuR est un résultat extrêmement intéressant, à mettre en perspective avec le rôle suppresseur de tumeur du locus H19. En effet, la translocation de la protéine HuR du noyau vers le cytoplasme a été décrite dans certaines situations tumorales. Dans de telles circonstances, HuR ne serait plus capable d’inhiber la production du miR-675, qui pourrait alors être exprimé dans ces tumeurs. Or, le miR-675 exerce un rôle fortement inhibiteur sur la prolifération cellulaire. Ces résultats suggèrent que le locus H19 pourrait exercer son rôle suppresseur de tumeur en partie par l’expression de ce microARN. |
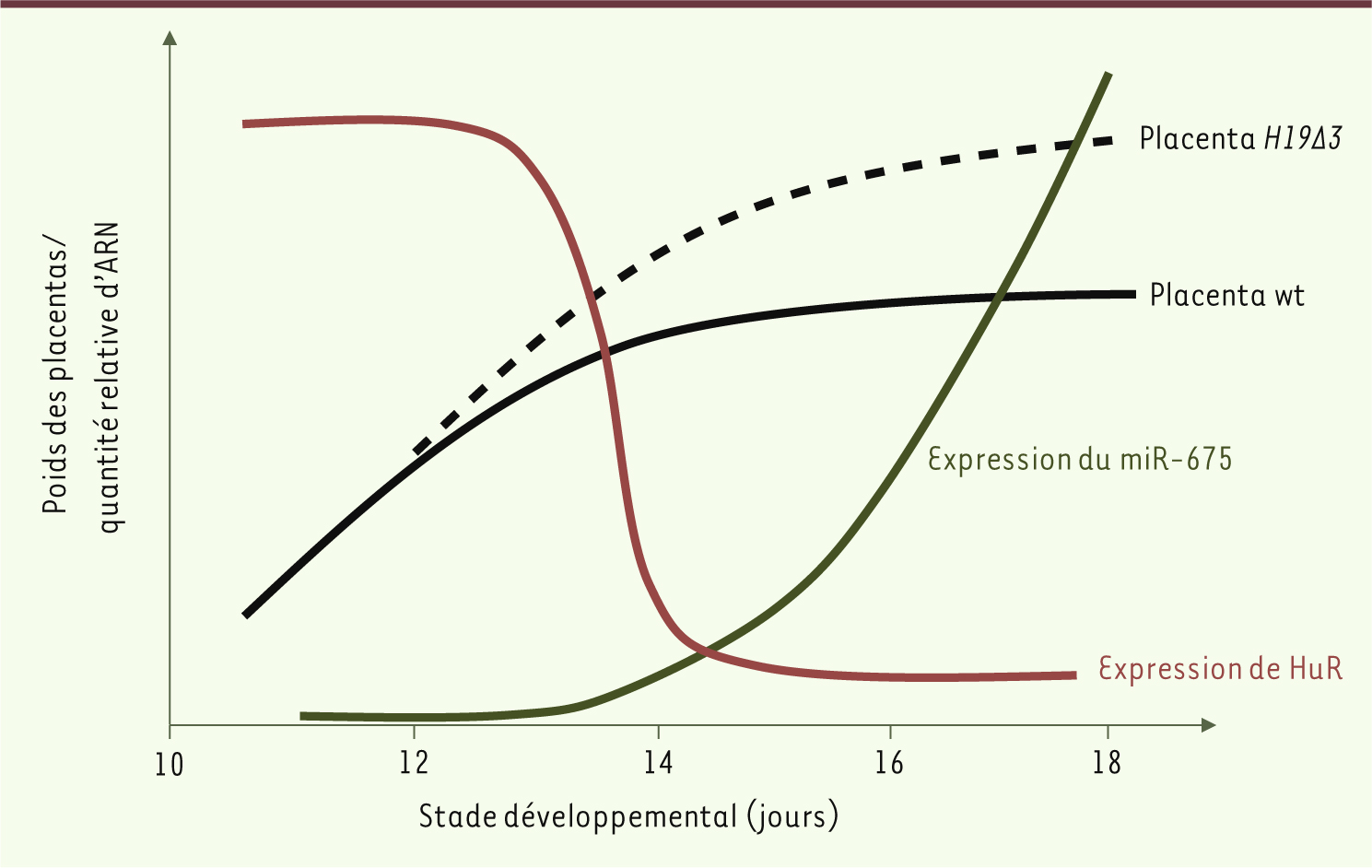
Le miR-675 : suppresseur de la croissance placentaire ? De façon tout à fait intéressante, les placentas de souris chez lesquelles le gène H19, et donc le miR-675 (H19Δ3), est invalidé, ont une taille supérieure d’environ 30 % à celle des placentas normaux (wild-type, wt). De plus, lorsque l’on superpose les courbes d’expression de HuR et du miR-675 avec les courbes de croissance de placentas issus de souris wt ou H19Δ3 au cours du développement (Figure 1), on observe tout d’abord que l’expression du miR-675 est corrélée parfaitement à la répression de la protéine HuR dans ce tissu. Ceci conforte les résultats concernant la régulation de la production de ce micro-ARN. De plus, l’expression de miR-675 semble coïncider avec un arrêt de la croissance des placentas wt. Enfin, de façon tout à fait remarquable, on n’observe aucun arrêt de la croissance placentaire lorsque le gène H19 et le miR-675 sont absents.
 | Figure 1.
Corrélation entre le poids du placenta et l’expression génique au cours du développement. À partir de 13,5 jours de développement, on observe une diminution rapide de l’expression de HuR (courbe rouge), corrélée avec le début de l’expression du miR-675 (courbe verte). À ce moment, le poids des placentas wt cesse de croître (courbe noire), alors que le poids des placentas dépourvus de H19 et miR-675 (courbe en pointillés) continue d’augmenter. Les données sont extraites de [ 9]. |
C’est donc au moment où le miR-675 commence à être exprimé dans les placentas wt, autour du stade E13,5, qu’apparaît une différence de taille entre les placentas wt et H19Δ3. Sachant que l’expression de la forme longue de l’ARN H19 est constante dans le placenta au cours du développement, ces résultats suggèrent fortement que le miR-675 pourrait agir comme un suppresseur de la croissance placentaire. |
Le miR-675 inhibe l’expression du gène Igf1r
Afin d’identifier les cibles potentielles du miR-675, nous avons comparé les transcriptomes des placentas wt et H19Δ3 par séquençage d’ARN (RNA-seq). Parmi les cibles surexprimées dans les placentas H19Δ3, plusieurs avaient été précédemment décrites par des analyses in silico comme des cibles potentielles du miR-675. Parmi celles-ci, on trouve le gène Igf1r (insulin-like growth factor receptor 1). Ce dernier code pour le récepteur clé via lequel l’IGF-1, mais aussi l’IGF-2, exercent leur rôle de facteur de croissance. Nous avons confirmé in vitro qu’Igf1r est effectivement une cible du miR-675. Il est donc probable que le miR-675 exerce son rôle de suppresseur de croissance dans le placenta via le contrôle de l’expression du gène Igf1r. |
L’étude de A. Keniry et al. [9] révèle, pour la première fois, un mécanisme moléculaire par lequel le locus H19 exerce son rôle au cours du développement. Le locus produit un ARN non codant de 2,3 kb qui sert de précurseur à un microARN, le miR-675. Celui-ci serait capable d’inhiber la croissance placentaire en contrôlant l’expression d’Igf1r, récepteur clé d’une voie de signalisation impliquée dans la croissance cellulaire. La régulation de l’expression de ce miR-675 par la protéine HuR suggère que ce microARN pourrait également être, au moins en partie, responsable du rôle suppresseur de tumeur du locus H19. Cependant, ce mécanisme ne semble pas capable d’expliquer, à lui seul, la fonction du locus H19, notamment en ce qui concerne le contrôle de la croissance embryonnaire. En effet, le miR-675 n’est pas du tout exprimé dans l’embryon, et ne semble avoir pour cible aucun des gènes de l’IGN. Ces gènes cibles de H19, de par leur empreinte, son étroitement régulés par les modifications de marques épigénétiques. Or, il a été montré durant ces dernières années que les longs ARN non codants sont capables d’exercer une régulation transcriptionnelle de leurs cibles via le recrutement de protéines impliquées dans la mise en place ou la modification de marques épigénétiques [
10]. Un tel mécanisme concernant l’ARN H19 mérite sans aucun doute d’être envisagé. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Pachnis
V
,
Belayew
A
,
Tilghman
SM.
Locus unlinked to alpha-fetoprotein under the control of the murine raf and Rif genes . Proc Natl Acad Sci USA.
1984; ; 81 : :5523.–5527. 2.
Bartolomei
MS
,
Zemel
S
,
Tilghman
SM.
Parental imprinting of the mouse H19 gene . Nature.
1991; ; 351 : :153.–155. 3.
DeChiara
TM
,
Robertson
EJ
,
Efstratiadis
A.
Parental imprinting of the mouse insulin-like growth factor II gene . Cell.
1991; ; 64 : :849.–859. 4.
Azzi
S
,
Rossignol
S
,
Steunou
V
, et al.
Multilocus methylation analysis in a large cohort of 11p15-related foetal growth disorders (Russell Silver and Beckwith Wiedemann syndromes) reveals simultaneous loss of methylation at paternal and maternal imprinted loci . Hum Mol Genet.
2009; ; 18 : :4724.–4733. 5.
Yoshimizu
T
,
Miroglio
A
,
Ripoche
MA
, et al.
The H19 locus acts in vivo as a tumor suppressor . Proc Natl Acad Sci USA.
2008; ; 105 : :12417.–12422. 6.
Gabory
A
,
Ripoche
MA
,
Le Digarcher
A
, et al.
H19 acts as a trans regulator of the imprinted gene network controlling growth in mice . Development.
2009; ; 136 : :3413.–3421. 7.
Cai
X
,
Cullen
BR.
The imprinted H19 noncoding RNA is a primary microRNA precursor . RNA.
2007; ; 13 : :313.–316. 8.
Smits
G
,
Mungall
AJ
,
Griffiths-Jones
S
, et al.
Conservation of the H19 noncoding RNA and H19-IGF2 imprinting mechanism in therians . Nat Genet.
2008; ; 40 : :971.–976. 9.
Keniry
A
,
Oxley
D
,
Monnier
P
, et al.
The H19 lincRNA is a developmental reservoir of miR-675 that suppresses growth and Igf1r . Nat Cell Biol.
2012; ; 14 : :659.–665. 10.
Rinn
JL
,
Chang
HY.
Genome regulation by long noncoding RNAs . Annu Rev Biochem.
2012; ; 81 : :145.–166. 11.
Gabory
A
,
Dandolo
L.
Épigénétique et développement : l’empreinte parentale . Med Sci (Paris).
2005; ; 21 : :390.–395. 12.
Henckel
A
,
Feil
R.
Asymétrie des génomes parentaux : implications en pathologie . Med Sci (Paris).
2008; ; 24 : :747.–752. 13.
Dunoyer
P.
La bataille du silence : mécanisme et inhibition du RNA silencing au cours des interactions plante/virus . Med Sci (Paris).
2009; ; 25 : :505.–512. |