| |
| Med Sci (Paris). 2013 January; 29(1): 31–33. Published online 2013 January 25. doi: 10.1051/medsci/2013291010.Les récepteurs µ-opioïdes de la veine porte Messagers de la régulation de la satiété Filipe De Vadder,1,2 Amandine Gautier-Stein,1,2 and Gilles Mithieux1,2* 1Inserm U855, 7-11, rue Guillaume Paradin, Lyon69372, France 2Université Lyon-Est, Lyon69008, France MeSH keywords: Animaux, Encéphale, physiologie, Protéines alimentaires, pharmacologie, Consommation alimentaire, Néoglucogenèse, Humains, Intestins, innervation, Veine porte, composition chimique, Récepteur mu, Satiété |
En raison de l’augmentation mondiale de l’obésité et des maladies qui lui sont associées, dont le diabète de type 2, la communauté scientifique se doit d’améliorer notre compréhension des mécanismes sous-jacents de l’homéostasie énergétique. Un champ toujours plus important d’investigations concerne les signaux hormonaux que produit l’intestin en réponse à l’assimilation des nutriments, et qui modulent les sensations de faim et de satiété. On sait aujourd’hui que le système nerveux entérique joue un rôle clé dans la détection et la transmission au cerveau de beaucoup de ces signaux [
1]. Parmi les signaux récemment décrits, on trouve la néoglucogenèse intestinale (capacité à synthétiser du glucose de novo) ou NGI, qui interfère avec le contrôle de l’homéostasie énergétique à l’état nourri post-absorption1 (pour revue, voir [
2]). L’induction de la néoglucogenèse intestinale se traduit par une libération de glucose dans la veine porte. La détection de ce glucose par un détecteur de glucose présent dans les parois de la veine porte et la transmission de ce signal au cerveau par le système nerveux périphérique se traduisent par la diminution de la sensation de faim. Cela concerne deux situations nutritionnelles particulières : un régime enrichi en protéines [
3–
5] et la chirurgie de type by-pass gastrique2 [
6]. |
Propriétés m-opioïdes des protéines alimentaires Une propriété connue depuis longtemps des hydrolysats de protéines, qui ont un intérêt en nutrition humaine, comme les caséines du lait ou le gluten, est qu’ils exercent une activité μ-opioïde in vitro [
7]. Il est également connu que la modulation de l’activité des récepteurs μ-opioïdes peut interférer avec le contrôle de la prise alimentaire au niveau central : les agonistes stimulent la prise alimentaire, tandis que les antagonistes l’inhibent (pour revue, voir [
8]). Fait intéressant, les deux organes du corps dans lesquels les récepteurs μ-opioïdes sont le plus largement exprimés sont le cerveau, en particulier dans les régions impliquées dans le contrôle de la prise alimentaire lié au système de récompense [
9], et l’intestin grêle où ils contrôlent la motilité intestinale [
10]. De plus, la naloxone (Nalox), un antagoniste des récepteurs μ-opioïdes, diminue l’apport alimentaire lorsqu’elle est administrée par voie orale chez l’homme [8], alors qu’elle est activement dégradée par le foie [
11]. Ceci suggérait que les modulateurs des récepteurs μ-opioïdes d’origine alimentaire pourraient agir sur un site portal, gastro-intestinal ou mésentérique. |
Les récepteurs m-opioïdes de la veine porte régulent la néoglucogenèse intestinale via un circuit intestin-cerveau Afin de tester l’hypothèse d’un contrôle par les récepteurs μ-opioïdes de la veine porte sur la NGI, via un arc réflexe intestin-cerveau, nous avons perfusé des modulateurs de ces récepteurs dans la veine porte de rats conscients, grâce à un cathéter implanté dans une veine mésentérique [3]. Une perfusion de 8 h de β-casomorphine 1-7 (qui provient de la caséine β humaine) ou de DAMGO, deux agonistes des récepteurs μ-opioïdes, réduisait l’activité des enzymes clés de la NGI (glucose-6 phosphatase et PEPCK-c [phosphoénolpyruvate carboxykinase-c]). Au contraire, les antagonistes de récepteurs μ-opioïdes induisaient ces activités. Ces résultats ont été confirmés par la mesure de la production intestinale de glucose : celle-ci représentait 25 à 30 % de la production de glucose endogène totale après la perfusion de Nalox, mais était quasi inexistante chez les rats perfusés avec le DAMGO. En accord avec les résultats attendus des effecteurs sur la NGI, les rats perfusés avec un antagoniste des récepteurs μ-opioïdes ont diminué leur prise alimentaire, tandis que ceux perfusés avec un agoniste l’ont augmentée [
12]. Des études d’immunofluorescence ont révélé la colocalisation du marqueur neuronal PGP9.5 et des récepteurs μ-opioïdes dans les parois de la veine porte de rats et de souris, mais aussi dans les ramifications portales irrigant les espaces portes du foie humain (Figure 1). Nous avons ensuite identifié, par un marquage immunohistochimique de la protéine c-Fos, les régions du cerveau activées par les signaux nerveux d’origine portale. Ceci nous a permis de démontrer que la voie vagale (connectée au complexe vagal dorsal), mais aussi la voie spinale (connectée au noyau parabrachial), sont toutes deux impliquées dans la transmission du signal issu des récepteurs μ-opioïdes de la veine porte au système nerveux central. Enfin, l’activation centrale ainsi que l’induction des gènes impliqués dans la NGI étaient annulées par une dénervation préalable de la veine porte par la capsaïcine, confirmant le rôle capital du système nerveux portal dans la transmission du signal [12].
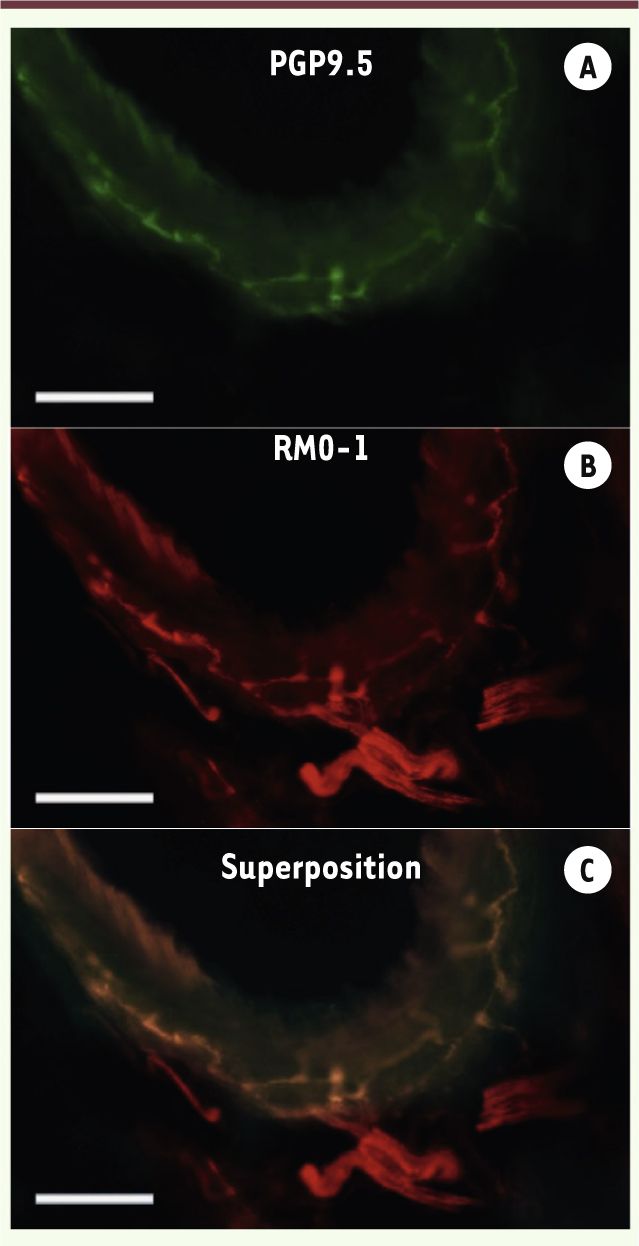
 | Figure 1.
Expression des récepteurs μ-opioïdes dans les parois de veines portes humaines. La protéine PGP9.5 (en vert, panneau A) et le marqueur neuronal RMO-1 (en rouge, panneau B) sont visualisés par immunofluorescence dans les ramifications veineuses à l’entrée des espaces portes. La superposition des signaux (en jaune, panneau C) révèle la colocalisation des deux protéines. Barre d’échelle : 50 µm. |
|
Les hydrolysats de protéines et les peptides induisent la NGI via leurs propriétés antagonistes des récepteurs m-opioïdes Il faut rappeler que les protéines alimentaires sont absorbées depuis la lumière intestinale après leur protéolyse incomplète, et que des oligopeptides passent dans le sang portal [
13]. Nous avons donc perfusé un hydrolysat protéolytique ou des oligopeptides sélectionnés (di- ou tripeptides) dans la veine mésentérique porte des rats. Dans tous les cas, l’induction marquée des gènes intervenant dans la NGI était observée, ainsi qu’une activation des régions centrales de réception des signaux en provenance de la veine porte, sauf si une dénervation de la veine porte avait été réalisée au préalable (comme observé précédemment avec les modulateurs des récepteurs μ-opioïdes). Nous avons vérifié que les hydrolysats protéiques et les oligopeptides se comportaient également en antagonistes des récepteurs μ-opioïdes dans des cellules de neuroblastome exprimant de manière constitutive ces récepteurs [12]. Pour établir de façon définitive les liens de causalité dans la séquence peptides- récepteurs μ-opioïdes-NGI-satiété, nous avons étudié ces mécanismes chez des souris déficientes pour le gène codant pour les récepteurs μ-opioïdes et chez des souris déficientes pour la NGI [5]. Perfusés chez les souris sauvages, les oligopeptides induisaient la NGI et s’opposaient à l’effet suppresseur du DAMGO. En revanche, chez des souris dépourvues de récepteurs μ-opioïdes, aucun de ces effecteurs n’induisait d’effet sur la NGI. Ainsi, les souris knock-out pour les récepteurs μ-opioïdes ne réduisaient pas leur apport alimentaire lorsqu’elles étaient soumises à un régime riche en protéines, contrairement aux souris sauvages qui le diminuaient de 20 %. Enfin, nous avons étudié la prise alimentaire des souris déficientes pour la NGI traitées avec un antagoniste des récepteurs μ-opioïdes ou chez lesquelles un dipeptide était infusé dans la veine porte. Tandis que les souris sauvages diminuaient leur prise alimentaire de 15 %, aucun effet n’était observé en l’absence de la néoglucogenèse intestinale [12]. |
Nous avons élucidé le mécanisme par lequel les protéines alimentaires exercent leur effet bien connu de satiété. Au cours de leur assimilation, les peptides libérés exercent un effet antagoniste sur les récepteurs μ-opioïdes des parois de la veine porte, qui se traduit par l’envoi d’un signal nerveux au niveau central. Un arc réflexe induit l’expression des gènes de la NGI et la libération de glucose dans le sang de la veine porte, ce qui induit alors une diminution de la sensation de faim (Figure 2). Il est intéressant de mentionner que cette séquence d’évènements requiert du temps. En effet, elle nécessite l’expression de certains gènes, et son effet peut ainsi perdurer après la fin du repas. C’est ce qui nous a permis de comprendre cette propriété unique des protéines qui diminuent la sensation de faim bien après le repas en cours, ce qui répond à la définition de la satiété.
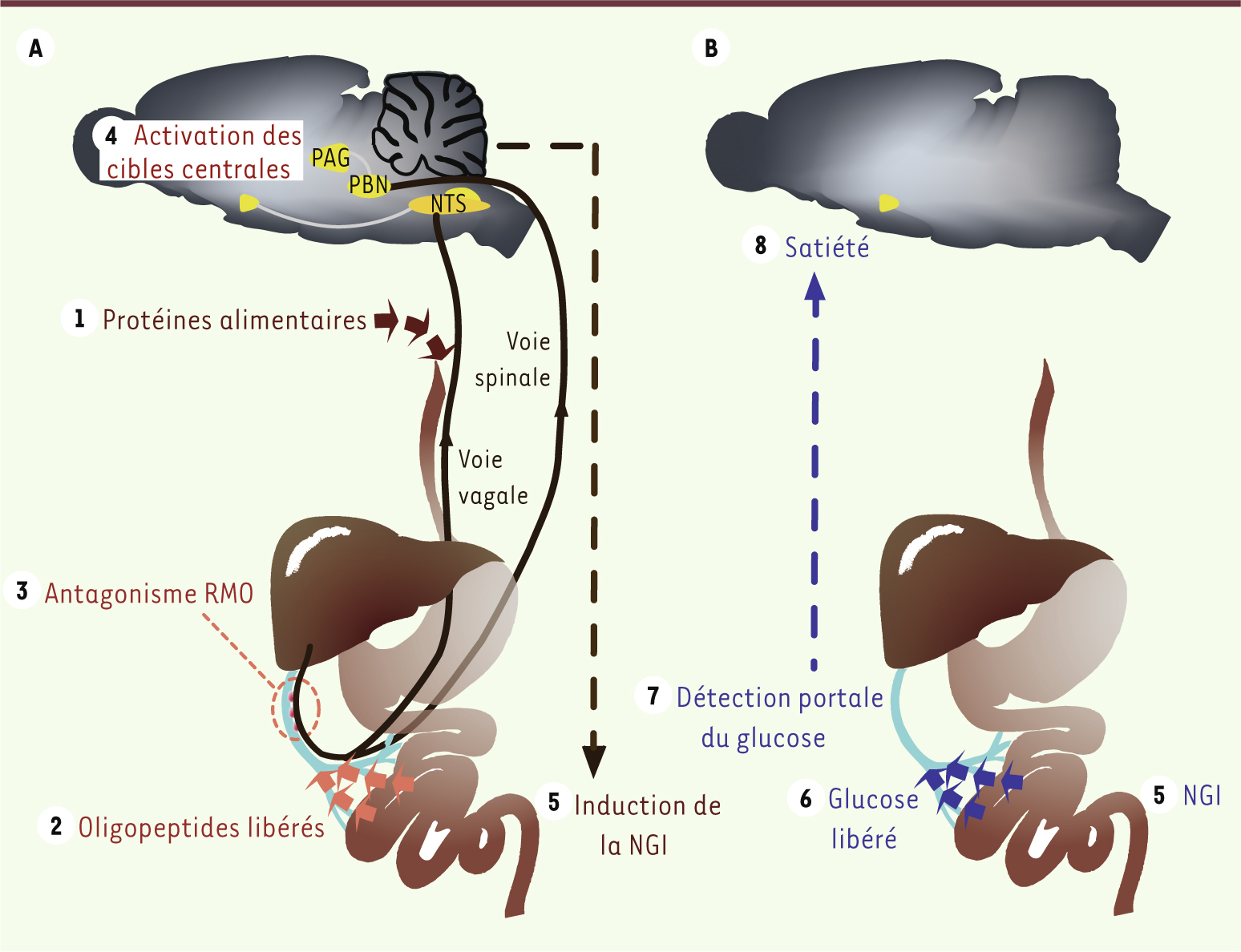
 | Figure 2.
Séquence d’induction de la satiété par les protéines alimentaires. A. Pendant la période postprandiale, les oligopeptides libérés dans la veine porte inhibent l’activité des récepteurs μ-opioïdes dans la paroi. Les afférences nerveuses contrôlées par les récepteurs μ-opioïdes envoient un signal à leurs cibles centrales, induisant au final l’expression des gènes de la néoglucogenèse intestinale. B. Pendant la période post-absorption, le glucose libéré est détecté dans la veine porte et exerce ses effets de satiété [ 3]. PBN : noyau parabrachial ; PAG : substance grise périaqueducale ; NTS : noyau du tractus solitaire. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Berthoud
H.
Anatomy and function of sensory hepatic nerves . Anat Rec A Discov Mol Cell Evol Biol.
2004; ; 280 : :827.–835. 2.
Mithieux
G.
A novel function of intestinal gluconeogenesis: central signaling in glucose and energy homeostasis . Nutrition.
2009; ; 25 : :881.–884. 3.
Mithieux
G
,
Misery
P
,
Magnan
C
, et al.
Portal sensing of intestinal gluconeogenesis is a mechanistic link in the diminution of food intake induced by diet protein . Cell Metab.
2005; ; 2 : :321.–329. 4.
Pillot
B
,
Soty
M
,
Gautier-Stein
A
, et al.
Protein feeding promotes redistribution of endogenous glucose production to the kidney and potentiates its suppression by insulin . Endocrinology.
2009; ; 150 : :616.–624. 5.
Penhoat
A
,
Mutel
E
,
Amigo-Correig
M
, et al.
Protein-induced satiety is abolished in the absence of intestinal gluconeogenesis . Physiol Behav.
2011; ; 105 : :89.–83. 6.
Troy
S
,
Soty
M
,
Ribeiro
L
, et al.
Intestinal gluconeogenesis is a key factor for early metabolic changes after gastric bypass but not after gastric lap-band in mice . Cell Metab.
2008; ; 8 : :201.–211. 7.
Zioudrou
C
,
Streaty
R
,
Klee
W.
Opioid peptides derived from food proteins . J Biol Chem.
1979; ; 254 : :2446.–2449. 8.
Yeomans
M
,
Gray
R.
Opioid peptides and the control of human ingestive behaviour . Neurosci Biobehav Rev.
2002; ; 26 : :713.–728. 9.
Glass
M
,
Billington
C
,
Levine
A.
Opioids and food intake: distributed functional neural pathways?
Neuropeptides.
1999; ; 33 : :360.–368. 10.
Hedner
T
,
Cassuto
J.
Opioids and opioid receptors in peripheral tissues . Scand J Gastroenterol.
1987; ; 130 : :27.–46. 11.
Reimer
K
,
Hopp
M
,
Zenz
M
, et al.
Meeting the challenges of opioid induced constipation in chronic pain management. A novel approach . Pharmacology.
2009; ; 83 : :10.–17. 12.
Duraffourd
C
,
De Vadder
F
,
Goncalves
D
, et al.
Mu-opioid receptors and dietary protein stimulate a gut-brain neural circuitry limiting food intake . Cell.
2012; ; 150 : :377.–388. 13.
Lee
VH.
Membrane transporters . Eur J Pharm Sci.
2000; ; 11 : :S41.–S50. |