| |
| Med Sci (Paris). 2013 January; 29(1): 36–38. Published online 2013 January 25. doi: 10.1051/medsci/2013291012.Résistance des cellules de LLC à l’apoptose Le rôle déterminant des cellules stromales dans le maintien du potentiel redox Wan Zhang,1 Li Feng,2 Hélène Pelicano,2 and Peng Huang2* 1The first affiliated hospital of Nanchang university, 17 Yongwaizheng street, Nanchang, Jiangxi, 330006Chine 2Department of molecular pathology, the university of Texas, M.D. Anderson cancer center, Houston, TX77030, États-Unis MeSH keywords: Animaux, Apoptose, Humains, Leucémie chronique lymphocytaire à cellules B, traitement médicamenteux, anatomopathologie, physiopathologie, Oxydoréduction, Récepteurs CXCR3, Cellules stromales, physiologie |
La leucémie lymphoïde chronique (LLC) est la forme la plus fréquente des hémopathies lymphoïdes dans le monde occidental [
1,
2]. Elle reste incurable en dépit de la mise au point régulière de nouvelles thérapies. Les traitements actuels utilisent des agents alkylants (chlorambucil, cyclophosphamide), une polychimiothérapie de type CHOP (vincristine, cyclophosphamide, adriamycine, prednisone), des antimétabolites qui affectent en premier lieu la synthèse de l’ADN (fludarabine, cladribine) et un anticorps monoclonal (rituximab) dirigé contre l’antigène de membrane CD20 [
3,
4]. |
Physiopathologie de la LLC et rôle du microenvironnement La LLC résulte de l’accumulation progressive de lymphocytes B CD5+ (LLC-B). Les cellules LLC-B se caractérisent par un faible index de prolifération et leur résistance à l’apoptose en raison de la surexpression de Bcl2 (B-cell lymphoma 2), Mcl-1 (myeloid cell factor 1) et Bag-1, et de la faible expression de protéines pro-apoptotiques comme Bax (Bcl-2-associated X protein) [
5–
7]. Les cellules LLC-B ont un métabolisme plus actif que les cellules saines, ce qui entraîne une production plus importante de radicaux libres et une dépendance vis-à-vis des antioxydants cellulaires comme le glutathion (GSH) pour maintenir leur balance redox intracellulaire [
8,
9]. De plus, l’interaction des cellules LLC-B avec les cellules accessoires (cellules stromales, cellules nurse-like) dans la moelle osseuse ou les ganglions est aussi importante pour leur survie [
10,
11]. En effet, les cellules leucémiques expriment à leur surface le récepteur de chémokines CXCR4 (CD184), dont le ligand CXCL12 (SDF-1, stromal cell-derived factor-1), sécrété par les cellules stromales de la moelle et les cellules nurse-like dérivées des monocytes, permet aux cellules LLC-B d’échapper à l’apoptose par activation des voies MAP (mitogen activated protein) kinase [
12–
14]. La résistance des cellules LLC-B à l’apoptose in vivo contraste avec leur hypersensibilité à l’apoptose in vitro. Ceci suggère la perte dans ces cellules de facteurs nécessaires à leur survie. En outre, les cellules LLC-B dépendent du GSH (glutathion réduit) pour leur survie in vivo et, quand elles sont cultivées in vitro, la concentration de GSH décline rapidement [
15,
16]. La localisation médullaire initiale de la maladie et l’induction d’un retard de cette apoptose lorsque les lymphocytes sont cultivés en présence de cellules stromales [
17] ou de chémokines [
18] suggèrent que l’interaction entre les cellules lymphocytaires et le microenvironnement est importante. Il est bien établi que les cellules stromales participent, non seulement au maintien et à la protection des tumeurs, mais aussi à la résistance aux drogues via l’augmentation de l’expression des molécules anti-apoptotiques qu’elles entraînent [
19–
21]. En conséquence, une meilleure connaissance des composants du microenvironnement et de leur interaction avec les cellules LLC-B permettrait de développer de nouvelles stratégies pour le traitement des leucémies. |
L’interaction entre les cellules LLC-B et les cellules stromales est requise pour la résistance à l’apoptose des cellules LLC-B Nous avons récemment démontré que les cellules LLC-B cocultivées en présence de cellules stromales (HS5 et NKtert) in vitro deviennent résistantes à l’apoptose spontanée et à un traitement avec des agents anticancéreux (fludarabine et oxaliplatine) ; de plus, leur concentration en GSH est supérieure à celle des cellules LLC-B cultivées sans stroma [
22]. Ce système de coculture permet donc de reproduire les conditions observées in vivo. De plus, l’addition de N-acétylcystéine, précurseur du GSH, permet de prolonger la survie des cellules LLC-B in vitro en l’absence de cellules stromales. L’addition aux cocultures de β-phényléthylisothiocynate (PEITC), qui induit l’épuisement du GSH [9], empêche la protection des cellules LLC-B par les cellules stromales et entraîne l’augmentation de l’apoptose spontanée. Par conséquent, les cellules stromales protègent les cellules LLC-B de la mort cellulaire en augmentant la concentration du GSH, ce qui leur permet de lutter efficacement contre les radicaux libres. |
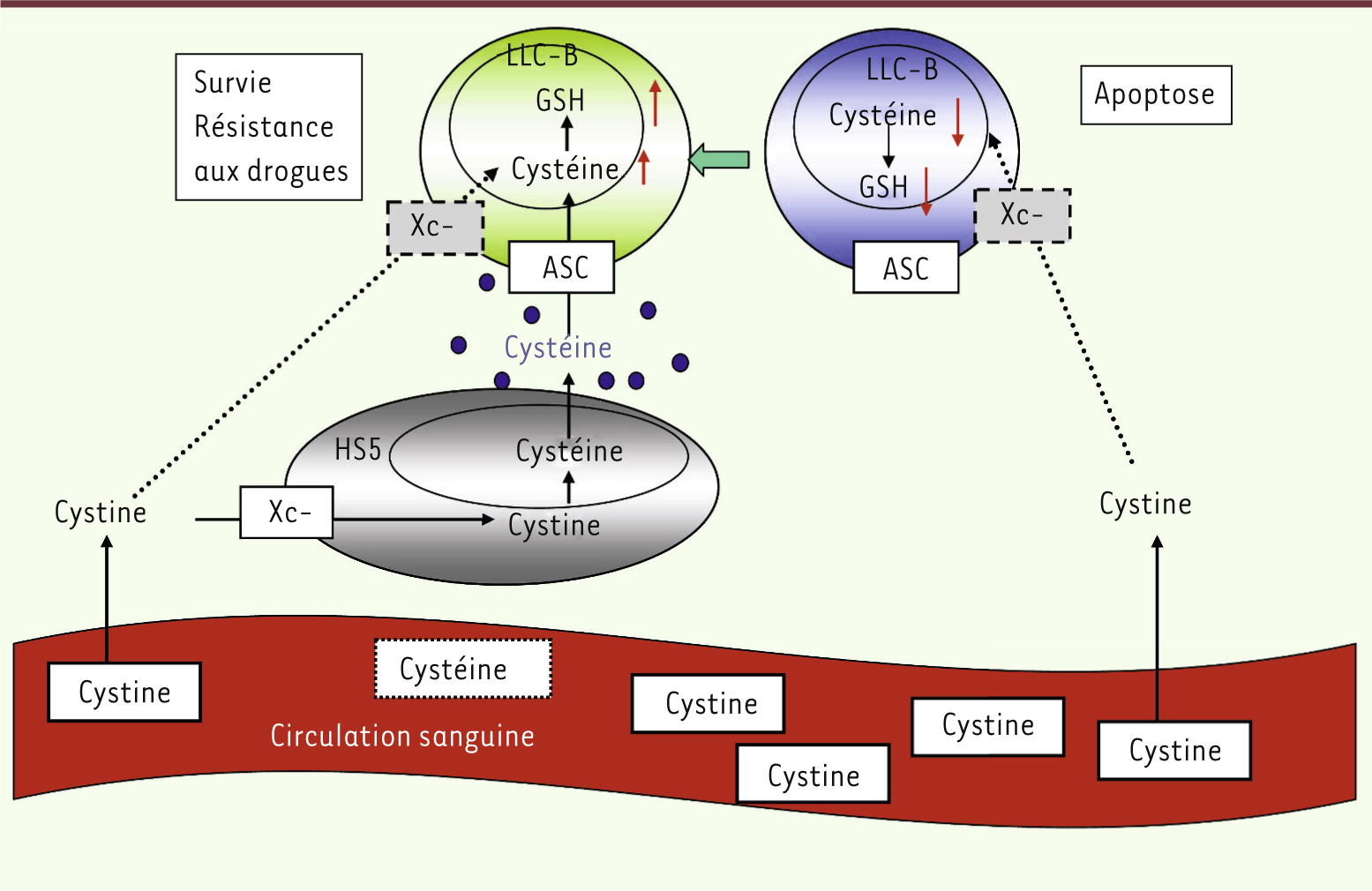
Les cellules stromales, source de la cystéine nécessaire à la synthèse du GSH Nous avons montré en utilisant un système de double chambre que les cellules stromales sécrètent plusieurs facteurs solubles de moins de 3 000 daltons qui induisent l’augmentation de la concentration de GSH dans les cellules LLC-B. Parmi ces facteurs solubles, l’un présente un motif thiol car il peut être réduit par le réactif d’Ellman. L’analyse du milieu de culture par spectrométrie de masse en tandem (LC-MS/MS) a permis d’identifier la cystéine comme l’un de ces facteurs. Par ailleurs, la cystéine est le facteur limitant pour la synthèse du GSH (formé par la condensation d’acide glutamique, de cystéine et de glycine) ; in vivo elle provient soit de l’alimentation, soit d’un processus de synthèse endogène à partir de la méthionine (via la S-adénosylméthionine et l’homocystéine). D’autre part, la cystéine est très instable dans le milieu extracellulaire et s’oxyde spontanément et rapidement en cystine (deux molécules de cystéine liées par une liaison disulfure). La cystine, plus abondante et plus stable que la cystéine, est transportée du milieu extracellulaire vers le milieu intracellulaire par l’antiporteur cystine/glutamate (Xc-) (Figure 1) pour y être réduite en cystéine. En utilisant la cystine radioactive, nous avons démontré que les cellules LLC-B consomment peu de cystine par rapport à la cystéine, et expriment le transporteur Xc- beaucoup plus faiblement que les cellules stromales. En revanche, les cellules stromales peuvent prélever la cystine dans le milieu extracellulaire, la convertir en cystéine, et ensuite l’expulser dans le milieu extracellulaire. La cystéine est ensuite véhiculée par les transporteurs dépendants et indépendants du Na+ des cellules LLC-B pour être utilisée pour la synthèse du GSH (Figure 1). En effet, si la coculture de cellules LLC avec les cellules stromales est faite dans un milieu dépourvu de cystine, la concentration du GSH n’augmente pas dans les cellules LLC-B et les cellules sont plus sensibles à l’apoptose spontanée. De plus, les cellules LLC-B deviennent plus sensibles aux agents anticancéreux lorsque le PEITC, qui réduit le GSH, ou des inhibiteurs du transporteur Xc- (S-4-carboxyphénylglycine et sulphasalazine, SSZ), sont ajoutés aux cocultures avec les cellules stromales. Dans ces conditions, la conversion de cystine en cystéine par les cellules stromales ne peut avoir lieu.
 | Figure 1.
Interaction entre le stroma et les cellules LLC-B. Les cellules LLC-B expriment faiblement le transporteur de la cystine Xc- et, par conséquent, leur capacité d’utilisation de la cystine pour la synthèse de GSH est faible. Les cellules LLC-B peuvent importer la cystéine, mais celle-ci est très instable dans le milieu extracellulaire. L’expression du transporteur Xc- est plus élevée dans les cellules stromales (HS5), qui peuvent prélever la cystine du microenvironnement et la convertir en cystéine. La cystéine peut être ensuite sécrétée dans le microenvironnement, puis être captée et transportée dans le cytosol des cellules LLC-B par des transporteurs dépendants (ASC) et indépendants du Na+, et utilisée pour la synthèse du GSH. Le GSH est important pour la survie des LLC-B et leur défense contre les radicaux libres et les agents anticancéreux. ASC : alanine, serine, cysteine preferring transporter. |
Pour valider l’importance de cette interaction in vivo, nous avons utilisé la souris Tcl1 transgénique dont le phénotype est caractérisé par une expansion de cellules B1 CD5+ péritonéales, et qui développe avec l’âge un syndrome lymphoprolifératif qui ressemble à la LLC humaine [
23]. Le blocage du transporteur Xc- in vivo avec SSZ entraîne une diminution de la concentration de glutathion dans les cellules CD5+ et altère leur viabilité. |
Nous avons démontré que les cellules LLC-B dépendent des cellules stromales qui leur apportent la cystéine dont elles ont besoin pour contrer le stress oxydatif et la mort cellulaire. L’interaction entre le stroma et les cellules LLC-B est importante pour le maintien et la survie des cellules leucémiques, et toute perturbation de cette interaction semble rendre les cellules leucémiques plus sensibles aux agents thérapeutiques. La dérégulation du métabolisme énergétique cellulaire est une caractéristique des cellules cancéreuses [
24]. Décrypter les relations entre les cellules cancéreuses et leur microenvironnement permettra de comprendre les mécanismes requis pour le maintien et le métabolisme de ces cellules cancéreuses, et de concevoir des thérapies plus efficaces et moins toxiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Dighiero
G
,
Binet
JL.
Chronic lymphocytic leukemia . Hematol Cell Ther.
1996; ; 38 : :S41.–S61. 2.
Ma
S
,
Rosen
ST.
Signal transduction inhibitors in chronic lymphocytic leukemia . Curr Opin Oncol.
2011; ; 23 : :601.–608. 3.
Cheson
BD.
Current approaches to the chemotherapy of B-cell chronic lymphocytic leukemia: a review . Am J Hematol.
1989; ; 32 : :72.–77. 4.
Robak
T
,
Lech-Maranda
E
,
Robak
P.
Rituximab plus fludarabine and cyclophosphamide or other agents in chronic lymphocytic leukemia . Exp Rev Anticancer Ther.
2010; ; 10 : :1529.–1543. 5.
Schimmer
AD
,
Munk-Pedersen
I
,
Minden
MD
,
Reed
JC.
Bcl-2 and apoptosis in chronic lymphocytic leukemia . Curr Treat Options Oncol.
2003; ; 4 : :211.–218. 6.
Kitada
S
,
Andersen
J
,
Akar
S
, et al.
Expression of apoptosis-regulating proteins in chronic lymphocytic leukemia: correlations with in vitro and in vivo chemoresponses . Blood.
1998; ; 91 : :3379.–3389. 7.
Gottardi
D
,
Alfarano
A
,
De Leo
AM
, et al.
In leukaemic CD5+ B cells the expression of BCL-2 gene family is shifted toward protection from apoptosis . Br J Haematol.
1996; ; 94 : :612.–618. 8.
Oltra
AM
,
Carbonell
F
,
Tormos
C
, et al.
Antioxidant enzyme activities and the production of MDA and 8-oxo-dG in chronic lymphocytic leukemia . Free Radic Biol Med.
2001; ; 30 : :1286.–1292. 9.
Trachootham
D
,
Zhang
H
,
Zhang
W
, et al.
Effective elimination of fludarabine-resistant CLL cells by PEITC through a redox-mediated mechanism . Blood.
2008; ; 112 : :1912.–1922. 10.
Kalluri
R
,
Zeisberg
M.
Fibroblasts in cancer . Nat Rev Cancer.
2006; ; 6 : :392.–401. 11.
Burger
JA
,
Ghia
P
,
Rosenwald
A
,
Caligaris-Cappio
F.
The microenvironment in mature B-cell malignancies: a target for new treatment strategies . Blood.
2009; ; 114 : :3367.–3375. 12.
Burger
JA
,
Burger
M
,
Kipps
TJ.
Chronic lymphocytic leukemia B cells express functional CXCR4 chemokine receptors that mediate spontaneous migration beneath bone marrow stromal cells . Blood.
1999; ; 94 : :3658.–3667. 13.
Burger
JA
,
Kipps
TJ.
Chemokine receptors and stromal cells in the homing and homeostasis of chronic lymphocytic leukemia B cells . Leuk Lymphoma.
2002; ; 43 : :461.–466. 14.
Burger
M
,
Hartmann
T
,
Krome
M
, et al.
Small peptide inhibitors of the CXCR4 chemokine receptor (CD184) antagonize the activation, migration, and antiapoptotic responses of CXCL12 in chronic lymphocytic leukemia B cells . Blood.
2005; ; 106 : :1824.–1830. 15.
Collins
RJ
,
Verschuer
LA
,
Harmon
BV
, et al.
Spontaneous programmed death (apoptosis) of B-chronic lymphocytic leukaemia cells following their culture in vitro
. Br J Haematol.
1989; ; 71 : :343.–350. 16.
Silber
R
,
Farber
CM
,
Papadopoulos
E
, et al.
Glutathione depletion in chronic lymphocytic leukemia B lymphocytes . Blood.
1992; ; 80 : :2038.–2043. 17.
Lagneaux
L
,
Delforge
A
,
Bron
D
, et al.
Chronic lymphocytic leukemic B cells but not normal B cells are rescued from apoptosis by contact with normal bone marrow stromal cells . Blood.
1998; ; 91 : :2387.–2396. 18.
Chiorazzi
N
,
Ferrarini
M.
B cell chronic lymphocytic leukemia: lessons learned from studies of the B cell antigen receptor . Annu Rev Immunol.
2003; ; 21 : :841.–894. 19.
Burger
M
,
Hartmann
T
,
Krome
M
, et al.
Small peptide inhibitors of the CXCR4 chemokine receptor (CD184) antagonize the activation, migration, and antiapoptotic responses of CXCL12 in chronic lymphocytic leukemia B cells . Blood.
2005; ; 106 : :1824.–1830. 20.
Berger
MG
,
Berger
J
,
Richard
C
, et al.
Preferential sensitivity of hematopoietic (HPs) and mesenchymal (MPs) progenitors to fludarabine suggests impaired bone marrow niche and HP mobilization . Leukemia.
2008; ; 22 : :2131.–2134. 21.
Zhang
W
,
Huang
P.
Cancer-stromal interactions: role in cell survival, metabolism and drug sensitivity . Cancer Biol Ther.
2011; ; 11 : :150.–156. 22.
Zhang
W
,
Trachootham
D
,
Liu
J
, et al.
Stromal control of cystine metabolism promotes cancer cell survival in chronic lymphocytic leukaemia . Nat Cell Biol.
2012; ; 14 : :276.–286. 23.
Bichi
R
,
Shinton
SA
,
Martin
ES
, et al.
Human chronic lymphocytic leukemia modeled in mouse by targeted TCL1 expression . Proc Natl Acad Sci USA.
2002; ; 99 : :6955.–6960. 24.
Hanahan
D
,
Weinberg
RA
, Hallmarks of cancer: the next generation . Cell.
2011; ; 144 : :646.–674. |