| |
| Med Sci (Paris). 2013 February; 29(2): 139–141. Published online 2013 February 28. doi: 10.1051/medsci/2013292008.PSD-95, une nouvelle protéine contrôlant les dyskinésies induites par la L-DOPA Matthieu Bastide1 and Erwan Bézard1* 1Université de Bordeaux, CNRS, institut des maladies neurodégénératives, UMR 5293, 146, rue Léo Saignat, 33076Bordeaux, France MeSH keywords: Animaux, Neurones dopaminergiques, effets des médicaments et des substances chimiques, physiologie, Dyskinésie due aux médicaments, étiologie, génétique, Expression des gènes, Humains, Protéines et peptides de signalisation intracellulaire, métabolisme, Lévodopa, effets indésirables, usage thérapeutique, Protéines membranaires, Modèles génétiques, Maladie de Parkinson, traitement médicamenteux, Transport de protéines, Récepteur dopamine D1 |
La maladie de Parkinson est une maladie neurodégénérative caractérisée par une perte progressive de plusieurs populations neuronales, incluant notamment les neurones dopaminergiques de la substance noire pars compacta. Sur le plan clinique, cette maladie se traduit par trois symptômes moteurs majeurs : l’akinésie, la rigidité articulaire et les tremblements. L’objectif des traitements actuels est de pallier la déficience en dopamine, soit par l’utilisation d’agonistes dopaminergiques, soit par l’administration de Levodopa (L-Dopa ou L-3,4-dihydroxyphénylalanine), un précurseur direct de la dopamine. Bien qu’efficace pendant quelques années, la L-Dopa induit systématiquement des complications motrices se traduisant par des mouvements anormaux involontaires, appelés dyskinésies [
1,
2]. |
Les dyskinésies induites par la L-Dopa dans le traitement de la maladie de Parkinson À l’heure actuelle, il n’existe pas de traitement efficace permettant de lutter contre les dyskinésies. Néanmoins, plusieurs stratégies sont utilisées afin de soulager les patients. Tout d’abord, afin de retarder le plus longtemps possible la prise de L-Dopa, des agonistes dopaminergiques peuvent être administrés au stade initial de la maladie, seuls ou en combinaison avec la L-Dopa. Il est également possible de stabiliser les taux de dopamine dans le cerveau en administrant des inhibiteurs des enzymes de dégradation de la dopamine, comme la catéchol-O-méthyl-transférase (tolcapone, entacapone) ou la monoamine oxydase B (sélégiline, rasagiline). En ce qui concerne les traitements pharmacologiques anti-dyskinétiques, seule l’amantadine est prescrite. Cependant, son utilisation reste limitée par son efficacité et des effets secondaires indésirables. Une intervention neurochirurgicale est également possible. Son objectif est de permettre une stimulation cérébrale profonde, soit du noyau sous-thalamique, soit du globus pallidus interne. Cette approche permet, non seulement de diminuer les dyskinésies, mais également de réduire de moitié les doses de L-Dopa administrées aux patients. |
Modifications de l’expression neuronale de protéines de signalisation au cours des dyskinésies Au cours de ces dernières années, l’évolution des connaissances sur les dyskinésies a fait émerger de nouveaux concepts. La dégénérescence de la voie nigro-striée, caractéristique de la maladie de Parkinson, induit des dysfonctionnements dans la signalisation des récepteurs de la dopamine comme du glutamate. Sur le plan moléculaire, la distribution subcellulaire et les interactions fonctionnelles des récepteurs de la dopamine et du glutamate semblent jouer un rôle central dans la maladie de Parkinson, mais également dans le développement des dyskinésies. Ainsi, notre équipe a précédemment mis en évidence une augmentation du nombre des récepteurs de la dopamine de type D1 à la membrane plasmique des neurones épineux du striatum (structure cible de la dopamine) lors des dyskinésies [
3,
4], alors qu’ils devraient être normalement internalisés après leur stimulation par la dopamine. Il a également été montré que les dyskinésies entraînaient une diminution de l’expression neuronale de deux protéines, la G protein-coupled receptor kinase 6 (GRK6) et l’arrestine 2, impliquées dans le mécanisme de désensibilisation homologue [
5] qui conduit à l’internalisation des récepteurs suite à leur stimulation. Or, la surexpression de GRK6 dans le striatum de rongeurs et de primates développant la maladie de Parkinson entraîne une diminution des dyskinésies [
6]. Les récepteurs du glutamate sont également impliqués : des études ont montré une augmentation du nombre de récepteurs glutamatergiques de type NMDA (N-méthyl-D-aspartate) [
7,
8] et AMPA (α-amino-3-hydroxy-5-méthylisoazol-4-propionate) [
9] à la membrane plasmique de neurones striataux dans un modèle de primate développant la maladie de Parkinson avec des dyskinésies. |
Rôle de PSD-95 dans l’internalisation du récepteur D1 au cours des dyskinésies Les augmentations concomitantes du nombre des récepteurs D1 et du glutamate suggèrent une activation anormale de protéines impliquées dans la signalisation en aval de ces récepteurs. La protéine postsynaptic density 95 (PSD-95) participe à la signalisation glutamatergique et, ainsi, à la régulation de l’activité synaptique. Or, des éléments indiquent que PSD-95 pourrait également interagir avec le récepteur D1 [
10] et, ainsi, réguler sa distribution membranaire et ses fonctions [
11,
12]. En effet, il a été montré que les niveaux de PSD-95 étaient considérablement augmentés chez un modèle rongeur de la maladie de Parkinson, dyskinétique [
13]. Nous avons alors voulu corriger la surexpression de PSD-95 afin de restaurer une signalisation normale [
14]. L’étude comportementale secondaire à l’inhibition de PSD-95 a d’abord été réalisée chez le rongeur, dans un modèle de maladie de Parkinson : celui du rat unilatéralement déplété en dopamine par l’injection intracérébrale de 6-hydroxydopamine, puis traité par L-Dopa de façon chronique, ce qui induit des dyskinésies. Puis, un ARN interférent inhibant spécifiquement l’expression de PSD-95 a été sélectionné, et cloné dans un vecteur lentiviral injecté dans le striatum. Cette thérapie génique a permis de réduire considérablement les dyskinésies dans ce modèle. Des expériences de coimmunoprécipitation ont permis de vérifier l’implication du récepteur D1 dans ce phénomène, en confirmant l’interaction entre PSD-95 et le récepteur D1, et en identifiant le domaine d’interaction avec PSD95 au niveau du récepteur D1. Un peptide correspondant à cette séquence et permettant ainsi de rompre l’interaction entre le récepteur D1 et PSD-95 par compétition a été synthétisé puis injecté dans le striatum. Comme le faisait l’ARN interférent anti-PSD-95, le peptide a permis de diminuer les dyskinésies au pic de L-Dopa, ce qui démontre le rôle clef de l’interaction entre le récepteur D1 et PSD-95 dans les dyskinésies chez ce modèle rongeur. Afin de se placer dans un contexte de recherche translationnelle, nous avons répété ces travaux chez le singe macaque intoxiqué au 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP), une autre molécule neurotoxique spécifique des neurones dopaminergiques, et considéré comme le modèle expérimental de référence de la maladie de Parkinson. Dans ce modèle, l’inhibition de PSD-95 dans le striatum par ARN interférence permet également de diminuer la sévérité des dyskinésies de façon remarquable, confirmant le rôle de PSD-95 dans les dyskinésies chez le singe. Enfin, pour approfondir le mécanisme d’action de PSD-95 sur le récepteur D1, des expériences d’imagerie de neurones striataux en culture ont été réalisées. Elles montrent que l’inhibition de PSD-95 et, plus particulièrement, l’absence d’interaction entre le récepteur D1 et PSD-95 perturbe la localisation du récepteur D1 via une augmentation de sa diffusion latérale (Figure 1). Cette dernière peut alors être suivie d’une augmentation de l’internalisation du récepteur et, donc, d’une diminution de son expression à la membrane plasmique des neurones, permettant ainsi de restaurer la désensibilisation homologue du récepteur D1.
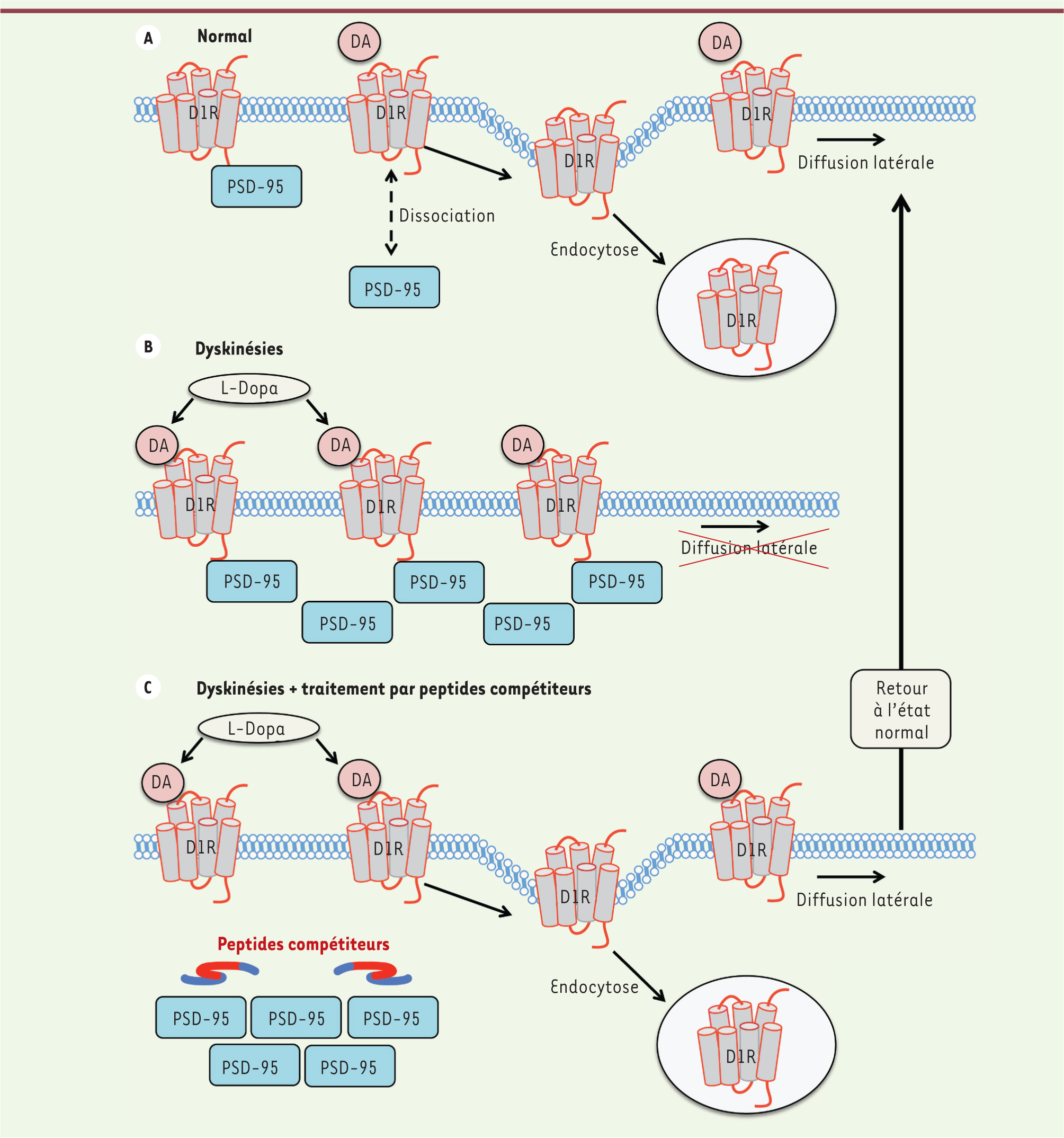
 | Figure 1.
PSD-95 contrôle les dyskinésies induites par la L-Dopa. A. En situation normale, la stimulation des récepteurs dopaminergiques par la dopamine (DA) et, plus particulièrement celle du récepteur D1 (D1R), entraîne une diffusion latérale de ce dernier dans le plan de la membrane plasmique des neurones striataux. Par la suite, soit D1R reste associé à la membrane loin du lieu de stimulation, soit il est internalisé et recyclé afin d’éviter une stimulation continue. Cette diffusion, dite latérale, implique des protéines intervenant dans la signalisation de ces récepteurs, comme PSD-95 qui, en situation normale, peut se dissocier du récepteur D1 après sa stimulation et le « libérer ». B.Le traitement chronique par la L-Dopa entraîne le développement de mouvements anormaux involontaires appelés dyskinésies, conséquence d’une augmentation massive des taux de dopamine dans le cerveau. Lorsque ces dysfonctionnements sont manifestes, PSD-95 est surexprimée. L’accumulation de PSD-95 entraîne une immobilisation du récepteur D1 à la membrane plasmique. Il ne peut donc ni diffuser latéralement, ni être internalisé. C. L’inhibition de l’interaction directe entre PSD-95 et le récepteur D1, via des peptides compétiteurs injectés dans le striatum, permet de diminuer considérablement les dyskinésies. Sur le plan moléculaire, ce phénomène se traduit par une modification de la distribution membranaire du récepteur D1, qui peut alors diffuser latéralement ou être internalisé. Ainsi, les animaux traités par ces peptides peuvent bénéficier pleinement du traitement à la L-Dopa sans dyskinésies sévères. |
|
L’ensemble de ces données soulignent l’importance du rôle fonctionnel de PSD-95 dans le développement des dyskinésies et valident son intérêt thérapeutique. En effet, nous avons démontré que la surexpression pathologique de PSD-95 immobilise le récepteur D1 de la membrane plasmique des neurones, réduisant ainsi sa mobilité à l’intérieur et à l’extérieur des synapses. Or, si cette mobilité est facilitée, soit en inhibant l’expression de PSD-95, soit en empêchant son interaction directe avec le récepteur D1, il en résulte une diminution drastique des dyskinésies. Par conséquent, sachant qu’une stratégie de thérapie génique utilisant des vecteurs viraux n’est pas privilégiée, l’utilisation de peptides compétiteurs, comme celui utilisé dans cette étude, pourrait s’avérer efficace dans le traitement des dyskinésies. |
Erwan Bézard déclare avoir une participation financière dans le capital de l’entreprise Motac Holding Ltd., United Kingdom.
Matthieu Bastide déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Stocchi
F
,
Nordera
G
,
Marsden
CD.
Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias . Clin Neuropharmacol.
1997; ; 20 : :95.–115. 2.
Fahn
S.
How do you treat motor complications in Parkinson’s disease: medicine, surgery, or both?
Ann Neurol.
2008; ; 64 : :S56.–S64. 3.
Guigoni
C
,
Doudnikoff
E
,
Li
Q
, et al.
Altered D(1) dopamine receptor trafficking in parkinsonian and dyskinetic non-human primates . Neurobiol Dis.
2007; ; 26 : :452.–463. 4.
Berthet
A
,
Porras
G
,
Doudnikoff
E
, et al.
Pharmacological analysis demonstrates dramatic alteration of D1 dopamine receptor neuronal distribution in the rat analog of L-DOPA-induced dyskinesia . J Neurosci.
2009; ; 29 : :4829.–4835. 5.
Bezard
E
,
Gross
CE
,
Qin
L
, et al.
L-DOPA reverses the MPTP-induced elevation of the arrestin2 and GRK6 expression and enhanced ERK activation in monkey brain . Neurobiol Dis.
2005; ; 18 : :323.–335. 6.
Ahmed
MR
,
Berthet
A
,
Bychkov
E
, et al.
Lentiviral overexpression of GRK6 alleviates L-dopa-induced dyskinesia in experimental Parkinson’s disease . Sci Transl Med.
2010; ; 2 : :28ra28.. 7.
Hallett
PJ
,
Dunah
AW
,
Ravenscroft
P
, et al.
Alterations of striatal NMDA receptor subunits associated with the development of dyskinesia in the MPTP-lesioned primate model of Parkinson’s disease . Neuropharmacology.
2005; ; 48 : :503.–516. 8.
Gardoni
F
,
Polli
F
,
Cattabeni
F
,
Di Luc
M.
Calcium-calmodulin-dependent protein kinase II phosphorylation modulates PSD-95 binding to NMDA receptors . Eur J Neurosci.
2006; ; 24 : :2694.–2704. 9.
Silverdale
MA
,
Kobylecki
C
,
Hallett
PJ
, et al.
Synaptic recruitment of AMPA glutamate receptor subunits in levodopa-induced dyskinesia in the MPTP-lesioned nonhuman primate . Synapse.
2010; ; 64 : :177.–180. 10.
Fiorentini
C
,
Gardoni
F
,
Spano
P
, et al.
Regulation of dopamine D1 receptor trafficking and desensitization by oligomerization with glutamate N-methyl-D-aspartate receptors . J Biol Chem.
2003; ; 278 : :20196.–20202. 11.
Yao
WD
,
Spealman, R.D
,
Zhang
J.
Dopaminergic signaling in dendritic spines . Biochem Pharmacol.
2008; ; 75 : :2055.–2069. 12.
Zhang
J
,
Xu
TX
,
Hallett
PJ
, et al.
PSD-95 uncouples dopamine-glutamate interaction in the D1/PSD-95/NMDA receptor complex . J Neurosci.
2009; ; 29 : :2948.–2960. 13.
Nash
JE
,
Johnston
TH
,
Collingridge
GL
, et al.
Subcellular redistribution of the synapse-associated proteins PSD-95 and SAP97 in animal models of Parkinson’s disease and L-DOPA-induced dyskinesia . FASEB J.
2005; ; 19 : :583.–585. 14.
Porras
G
,
Berthet
A
,
Dehay
B
, et al.
PSD-95 expression controls l-DOPA dyskinesia through dopamine D1 receptor trafficking . J Clin Invest.
2012; ; 122 : :3977.–3989. |