Le muscle cardiaque des mammifères est incapable de régénérer : le dogme tombe ! L’existence d’un renouvellement naturel des cardiomyocytes adultes au cours de la vie par différenciation de cellules progénitrices ou division de cardiomyocytes préexistants a récemment été mise en évidence, et nous en avons rendu compte dans une Synthèse publiée en décembre 2012 dans médecine/sciences [ 1, 2] (→).
(→) Voir m/s n° 12, vol. 28, page 1103
Néanmoins, ces processus restent encore trop limités pour permettre une amélioration fonctionnelle du cœur suffisante et durable après lésion du tissu cardiaque.
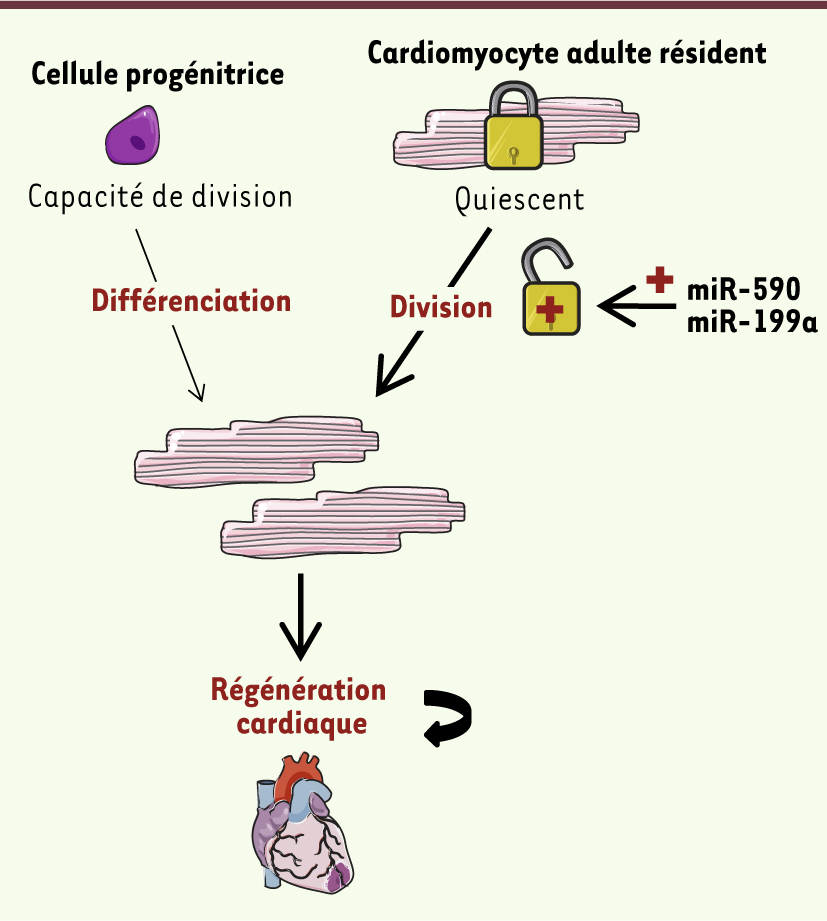
Des publications récentes montrent que, sous l’influence de différents facteurs mitogènes (la neuréguline [ 3], la périostine [ 4] et le facteur de croissance des fibroblastes FGF-1 [ 5]), les cardiomyocytes adultes résidents peuvent quitter leur état de quiescence pour ré-entrer dans le cycle cellulaire et se diviser, mais avec un index prolifératif bas. Bien que ces études démontrent un effet thérapeutique bénéfique de l’administration de ces molécules sur la fonction cardiaque après une atteinte ischémique, la pertinence in vivo et le lien causal entre l’effet protecteur de ces facteurs et la prolifération des cardiomyocytes résidents reste encore à établir précisément. Deux nouvelles études venant d’être publiées dans le journal Nature [ 6, 7] entrent finalement dans le vif du sujet et relancent concrètement l’espoir d’utiliser les cardiomyocytes résidents dans la régénération cardiaque. Ces deux études démontrent clairement : (1) que les cardiomyocytes adultes préexistants constituent la source essentielle de leur renouvellement ; et (2) qu’il est possible de moduler ce taux de renouvellement pour favoriser la régénération cardiaque (Figure 1).
• Ainsi, le groupe de Richard Lee [6] a utilisé une approche originale de marquage isotopique non radioactif et de spectrométrie de masse, le MIMS (multi-isotope imaging mass spectrometry) qui, couplée à la cartographie génétique, a permis de suivre simultanément le renouvellement et l’origine des cardiomyocytes adultes dans des conditions naturelles d’homéostasie ou en situation pathologique. En effet, suite à l’administration in vivo de [15N]-thymidine par pulse-chase, la technique de MIMS [ 8], en générant des images tissulaires quantitatives de très haute résolution subcellulaire, a permis de quantifier très finement le taux de réplication des cardiomyocytes présents dans le tissu cardiaque par l’identification précise de leurs noyaux ayant incorporé l’isotope. La stratégie de cartographie génétique, quant à elle, utilise un modèle de souris double transgéniques (MerCreMer-ZEG)1 [ 9, 10] qui permet de marquer les cardiomyocytes adultes de façon spécifique et irréversible en induisant l’expression de la protéine fluorescente verte GFP après un traitement par le tamoxifène. En utilisant ces souris, les auteurs ont ainsi pu discriminer précisément l’origine des cardiomyocytes néoformés, dérivant soit de cardiomyocytes adultes différenciés (GFP+), soit de la différenciation d’un pool de progéniteurs (GFP-). Les résultats de l’étude combinant les deux techniques sont très clairs et montrent ainsi que seule une majorité de cardiomyocytes préexistants sont capables d’initier spontanément un programme de division intrinsèque et se renouvellent dans des cœurs de souris jeunes, même si le taux de renouvellement reste faible (0,76 % par an) dans des conditions normales d’homéostasie et diminue avec l’âge. Ce résultat confirme une étude antérieure menée chez l’homme grâce à une technique similaire de marquage isotopique radioactif au 14C [ 11]. Dans une situation d’infarctus du myocarde, le taux de renouvellement des cardiomyocytes augmente mais n’atteint cependant que 3 % par an. De façon intéressante, dans ce cas précis, la majorité des cardiomyocytes résidents qui rompent leur état de quiescence et entrent à nouveau dans le cycle cellulaire en réponse aux dommages cardiaques ischémiques ne réalisent pas un cycle de division complet : ils se répliquent mais ne sont pas capables de finaliser l’étape terminale de cytokinèse, c’est-à-dire l’individualisation en deux cellules filles. Ces résultats confirment donc définitivement que le cœur possède un pouvoir naturel de régénération reposant essentiellement sur le renouvellement de ses cardiomyocytes différenciés préexistants, bien que ce processus reste trop limité et insuffisant pour réparer un tissu cardiaque endommagé. Cette étude redonne ainsi de l’élan aux stratégies d’utilisation des cardiomyocytes résidents pour stimuler la régénération cardiaque avec notamment l’espoir, dans le futur, de développer des outils permettant d’amplifier ce phénomène.
• La seconde étude [7], publiée par l’équipe de Mauro Giacca, répond directement à la question de la modulation du taux de renouvellement des cardiomyocytes. Elle applique une stratégie basée sur l’utilisation de microARN permettant de rompre l’état de quiescence postmitotique des cardiomyocytes adultes résidents et de stimuler leur division. À partir d’un crible aléatoire à grande échelle de 875 microARN, les auteurs en ont identifié 204 qui augmentent significativement la prolifération des cardiomyocytes néonataux de rats. Parmi ces 204 microARN, seuls 40 fonctionnent également chez la souris nouveau-né en favorisant l’incorporation d’EdU (un analogue de la thymidine qui s’incorpore dans l’ADN en cours de réplication) et le marquage Ki-67 (un marqueur de la prolifération) dans les cardiomyocytes. Les auteurs ont finalement sélectionné deux de ces microARN (hsa-miR-590-3p et hsa-miR-199a-3p) qui stimulent considérablement – de 13 à 20 % – l’incorporation d’EdU dans les cardiomyocytes de souris âgées de sept jours, âge auquel la prolifération des cardiomyocytes est généralement quasi-inexistante. La réintroduction de ces microARN, naturellement faiblement exprimés dans les cardiomyocytes adultes, réoriente de façon drastique les cardiomyocytes matures postnataux dans le cycle cellulaire et induit leur prolifération. Après un infarctus du myocarde, l’injection in vivo de ces microARN dans la zone péri-infarctus favorise de façon spectaculaire la régénération du tissu cardiaque ischémié : la taille de la zone nécrosée est réduite de 50 % et la fonction cardiaque s’améliore de façon significative, résultats en parfait accord avec les effets promitogènes de ces microARN sur les cardiomyocytes adultes. L’étude montre également que les effets bénéfiques de ces deux microARN dépendent de multiples cibles cellulaires qui semblent coopérer pour maintenir l’état de quiescence des cardiomyocytes. En effet, bien que l’analyse des transcrits modulés par ces microARN révèle une augmentation des gènes régulant le cycle cellulaire, la prolifération cellulaire et la réplication de l’ADN, l’invalidation individuelle de chacun de ces gènes ne permet pas de reproduire les effets mitogènes des deux microARN sur les cardiomyocytes. Les auteurs démontrent également que les effets promitogènes des deux microARN sont spécifiques aux cardiomyocytes puisqu’ils n’affectent pas d’autres types cellulaires cardiaques tels que les fibroblastes. À ce jour, aucune étude de médecine régénérative cardiaque n’a obtenu un tel succès thérapeutique chez les mammifères. Bien que les auteurs n’aient pu parvenir à identifier la cible protéique des microARN dans cette étude, ils montrent qu’il est possible de rompre la quiescence des cardiomyocytes. Ces résultats ouvrent donc un champ d’investigation très prometteur pour une future application chez l’homme. La recherche concernant la reprogrammation du cycle cellulaire des cardiomyocytes résidents prend désormais une importance considérable car elle pourrait pallier les problèmes classiquement rencontrés aujourd’hui dans les protocoles de thérapie cellulaire qui utilisent des cellules exogènes, et notamment la différenciation non contrôlée et inadaptée de ces cellules dans le cœur à long terme ainsi que les problèmes d’ordre éthique.
Le cœur de mammifère régénère… Cependant, la caractérisation précise des mécanismes moléculaires contrôlant l’état postmitotique des cardiomyocytes et de leurs modulateurs constitue maintenant un enjeu crucial pour le futur développement d’outils thérapeutiques en médecine régénérative cardiaque.