| |
| Med Sci (Paris). 2013 March; 29(3): 247–249. Published online 2013 March 27. doi: 10.1051/medsci/2013293006.Arfaptine-1 et biogenèse des granules de sécrétion Joëlle Morvan,1* Helmuth Gehart,1 and Roméo Ricci1 1Institut de génétique et de biologie moléculaire et cellulaire (IGBMC), Inserm-CNRS-université de Strasbourg, 1, rue Laurent Fries, 67404Illkirch Cedex, France MeSH keywords: Facteur-1 de ribosylation de l'ADP, physiologie, Protéines adaptatrices de la transduction du signal, Diabète de type 2, physiopathologie, Humains, Insuline, sécrétion, Phospholipase D, Vésicules de sécrétion, Réseau trans-golgien, ultrastructure |
Biogenèse des granules de sécrétion Le tri et l’empaquetage des protéines dans les vésicules de sécrétion au niveau du trans-Golgi network (TGN), ainsi que le détachement de ces dernières pour leur transport vers la surface cellulaire, requièrent des mécanismes extrêmement complexes et dynamiques [
1]. Ces étapes sont d’autant plus importantes dans les cellules sécrétrices spécialisées, comme les cellules pancréatiques qui sécrètent l’insuline. En effet, un défaut de sécrétion d’insuline conduit au développement de pathologies comme le diabète [
2]. Les granules de sécrétion contenant l’insuline sont formés au niveau du TGN ; ils y recrutent un ensemble de protéines qui leur permettent de bourgeonner et de se détacher. Ils sont ensuite acheminés jusqu’à la surface cellulaire où ils sont stockés. Lors d’une stimulation, comme l’élévation de la concentration extracellulaire en glucose, les granules fusionnent avec la membrane plasmique et libèrent leur contenu à l’extérieur de la cellule. L’ensemble de ces différentes étapes est appelé sécrétion. L’étape de ce processus la plus étudiée jusqu’à présent est l’étape de fusion des granules avec la membrane plasmique, ou exocytose. En effet, un défaut d’exocytose des granules d’insuline est observé dans de nombreux cas de diabète de type 2, la principale forme de la maladie diabétique. Ce mécanisme d’exocytose est régulé finement par des protéines SNARE (soluble N-ethylmaleimide-sensitive factor [NSF] attachment protein receptors) et ce de façon similaire qu’il s’agisse de la sécrétion d’insuline ou de neurotransmetteurs [
3,
15,
16]. Cependant, des études récentes suggèrent l’existence d’un mécanisme de régulation reliant directement l’exocytose induite par le glucose à la biogenèse des granules [
4,
5]. C’est cette nouvelle étape clé de la régulation de la sécrétion d’insuline au niveau du TGN que vient d’identifier notre équipe. |
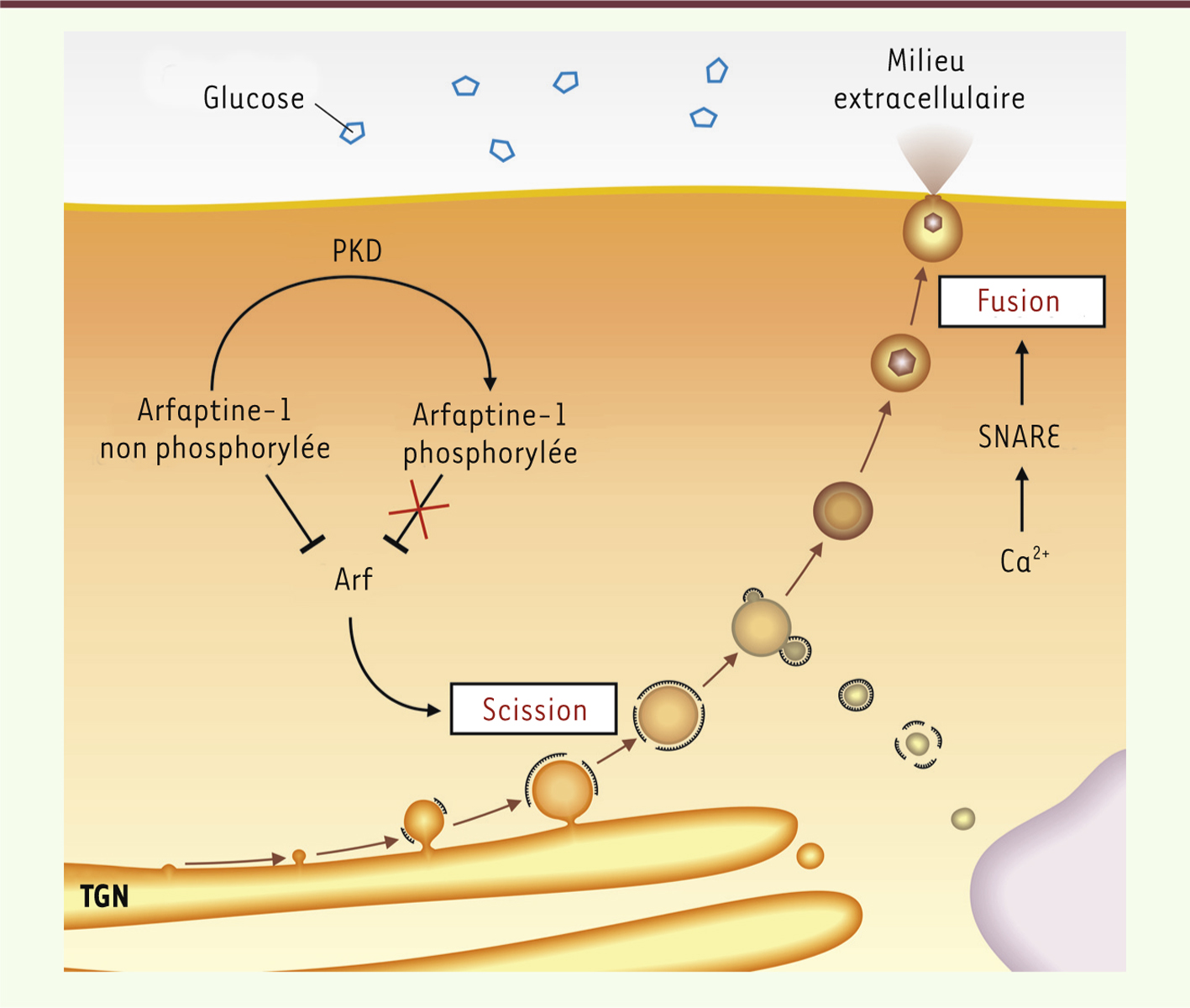
Le complexe PKD1-Arfaptine-1 régule l’activité des ADP-ribosylating factors (Arf) au niveau du Golgi Au niveau du réseau transgolgien, un complexe nécessaire à la scission des vésicules, composé entre autres de la petite GTPase Arf1 (ADP-ribosylating factor 1) et de la phospholipase D, est activé par la kinase PKD1 (protein kinase D1) [
6,
7]. La protéine kinase PKD1 fait partie de la famille des sérine/thréonine kinases dépendantes du calcium et de la calmoduline. PKD1 a été identifiée comme nécessaire à la biogenèse des vésicules de sécrétion [
8], et nous avons précédemment montré que cette kinase régule positivement la sécrétion d’insuline dans les cellules pancréatiques bêta [
9]. Nous avons maintenant identifié la protéine Arfaptine-1 comme étant un substrat de PKD1 [
10]. Arfaptine-1 est une protéine à domaine BAR (Bin1, amphiphysine, Rvs). Ces domaines ont la particularité de former des dimères et d’adopter une structure en croissant qui est capable d’interagir avec les membranes et de stabiliser leur courbure [15]. Nous avons montré que, dans les cellules pancréatiques bêta, Arfaptine-1 contrôle spécifiquement la scission des vésicules d’insuline. Arfaptine-1 interagit avec la protéine Arf1 au niveau du réseau transgolgien et empêche l’activation de ses effecteurs, comme la phospholipase D [
11]. La stimulation physiologique de l’activité de PKD1 conduit à la phosphorylation d’Arfaptine-1 et à sa redistribution dans le cytoplasme. La protéine Arf1 ainsi activée permet au complexe de scission de détacher les vésicules de sécrétion du réseau transgolgien et leur transport vers la surface cellulaire. Nous avons pu montrer, d’autre part, que la présence d’une forme non phosphorylable d’Arfaptine-1 (mutation de la sérine 132 en alanine) inhibe complètement la formation de vésicules de sécrétion in vitro à partir de l’appareil de Golgi purifié. |
Arfaptine-1 est essentielle à la sécrétion d’insuline De façon surprenante, la déplétion d’Arfaptine-1 dans les cellules pancréatiques bêta conduit à une abolition presque totale de la sécrétion d’insuline en réponse au glucose. Dans les cellules pancréatiques dépourvues d’Arfaptine-1, le nombre de vésicules de sécrétion d’insuline reste inchangé, mais leur taille est significativement réduite et leur localisation est altérée. En effet, contrairement aux cellules normales dans lesquelles les granules s’accumulent à la périphérie cellulaire à proximité de la membrane plasmique, dans les cellules dépourvues d’Arfaptine-1, les granules se localisent près de l’appareil de Golgi. Ces résultats démontrent le rôle majeur d’Arfaptine-1 dans le contrôle de la biogenèse des vésicules d’insuline. |
Un défaut de sécrétion d’insuline contribue au diabète de type 2. Dans de nombreux cas, il s’explique par un défaut d’exocytose des granules d’insuline [
12 ,
13]. C’est pourquoi les recherches se sont portées principalement sur cette étape du processus sécrétoire. Notre travail a permis de mettre en lumière une autre étape clé de régulation de la sécrétion d’insuline au niveau de l’appareil de Golgi. La protéine Arfaptine-1, sous le contrôle de la protéine kinase PKD1, assure la formation correcte des granules de sécrétion d’insuline. Il existe donc au moins deux niveaux importants de régulation de la sécrétion de l’insuline : l’étape de fusion des granules avec la membrane plasmique, et l’étape de détachement des granules de l’appareil de Golgi (Figure 1).
 | Figure 1.
Les deux points de contrôle de la sécrétion d’insuline. Le glucose présent dans la circulation sanguine conduit à une augmentation de la concentration intracellulaire en calcium (Ca2+) dans les cellules pancréatiques, ce qui induit la fusion des granules de sécrétion d’insuline avec la membrane plasmique en activant des protéines SNARE. D’autre part, l’activation de la kinase PKD1 au niveau du TGN (trans-Golgi network) va lever l’inhibition qu’exerce Arfaptine-1 sur la protéine Arf, permettant la scission des vésicules et leur détachement du TGN. |
L’importance de ce mécanisme est soulignée par le fait que des mutations dans le gène PRKD1 ont été identifiées dans des cohortes de patients obèses (IMC > 30) qui ont donc un risque accru de développer des pathologies comme le diabète ou les maladies cardiovasculaires [
14]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Kirchhausen
T.
Three ways to make a vesicle . Nat Rev Mol Cell Biol.
2000; ; 1 : :187.–198. 2.
Muoio
DM
,
Newgard
CB.
Mechanisms of disease: molecular and metabolic mechanisms of insulin resistance and beta-cell failure in type 2 diabetes . Nat Rev Mol Cell Biol.
2008; ; 9 : :193.–205. 3.
Gerber
SH
,
Sudhof
TC.
Molecular determinants of regulated exocytosis . Diabetes.
2002; ; 51 : :S3.–S11. 4.
Mziaut
H
,
Trajkovski
M
,
Kersting
S
, et al.
Synergy of glucose and growth hormone signalling in islet cells through ICA512 and STAT5 . Nat Cell Biol.
2006; ; 8 : :435.–445. 5.
Trajkovski
M
,
Mziaut
H
,
Altkruger
A
, et al.
Nuclear translocation of an ICA512 cytosolic fragment couples granule exocytosis and insulin expression in {beta}-cells . J Cell Biol.
2004; ; 167 : :1063.–1074. 6.
Yeaman
C
,
Ayala
MI
,
Wright
JR
, et al.
Protein kinase D regulates basolateral membrane protein exit from trans-Golgi network . Nat Cell Biol.
2004; ; 6 : :106.–112. 7.
Malhotra
V
,
Campelo
F.
PKD regulates membrane fission to generate TGN to cell surface transport carriers . Cold Spring Harb Perspect Biol.
2011 ; :3.. 8.
Liljedahl
M
,
Maeda
Y
,
Colanzi
A
, et al.
Protein kinase D regulates the fission of cell surface destined transport carriers from the trans-Golgi network . Cell.
2001; ; 104 : :409.–420. 9.
Sumara
G
,
Formentini
I
,
Collins
S
, et al.
Regulation of PKD by the MAPK p38delta in insulin secretion and glucose homeostasis . Cell.
2009; ; 136 : :235.–248. 10.
Gehart
H
,
Goginashvili
A
,
Beck
R
, et al.
The BAR domain protein arfaptin-1 controls secretory granule biogenesis at the trans-Golgi network . Dev Cell.
2012; ; 23 : :756.–768. 11.
Williger
BT
,
Provost
JJ
,
Ho
WT
, et al.
Arfaptin 1 forms a complex with ADP-ribosylation factor and inhibits phospholipase D . FEBS Lett.
1999; ; 454 : :85.–89. 12.
Ostenson
CG
,
Gaisano
H
,
Sheu
L
, et al.
Impaired gene and protein expression of exocytotic soluble N-ethylmaleimide attachment protein receptor complex proteins in pancreatic islets of type 2 diabetic patients . Diabetes.
2006; ; 55 : :435.–440. 13.
Andersson
SA
,
Olsson
AH
,
Esguerra
JL
, et al.
Reduced insulin secretion correlates with decreased expression of exocytotic genes in pancreatic islets from patients with type 2 diabetes . Mol Cell Endocrinol.
2012; ; 364 : :36.–45. 14.
Speliotes
EK
,
Willer
CJ
,
Berndt
SI
, et al.
Association analyses of 249, 796 individuals reveal 18 new loci associated with body mass index . Nat Genet.
2010; ; 42 : :937.–948. 15.
Drin
G
,
Bigay
J
,
Antonny
B.
Régulation du transport vésiculaire par la courbure membranaire . Med Sci (Paris).
2009; ; 25 : :483.–488. 16.
Galli
T
,
Martinez-Arca
S
,
Paumet
F.
Mécanisme de la fusion membranaire . Med Sci (Paris).
2002; ; 18 : :1113.–1119. |