| |
| Med Sci (Paris). 2013 April; 29(4): 389–395. Published online 2013 April 26. doi: 10.1051/medsci/2013294012.Les cellules natural killer
Adaptation et mémoire dans le système immunitaire inné Émilie Narni-Mancinelli,1,2,3 Sophie Ugolini,1,2,3 and Éric Vivier1,2,3,4* 1Centre d’immunologie de Marseille-Luminy, Aix-Marseille université UM2, campus de Luminy case 906, 13288Marseille, France 2Inserm U1104, Marseille, France 3CNRS, UMR7280, Marseille, France 4Assistance publique-hôpitaux de Marseille, hôpital de la Conception, 13385Marseille, France |
Vignette (Photo © Inserm – Jérôme Galon). Les cellules natural killer (NK) sont des grands lymphocytes granuleux qui appartiennent au système immunitaire inné. Elles participent à l’immunosurveillance tumorale et au contrôle précoce des infections microbiennes [
1]. Ces cellules sont capables de tuer des cellules tumorales tout en épargnant les cellules saines du soi. Elles produisent également des cytokines pro-inflammatoires, telles que l’interféron gamma (IFN-γ) qui participe à l’orientation de la réponse immunitaire adaptative. Les cellules NK produisent aussi d’autres cytokines pro-inflammatoires, mais aussi immunorégulatrices, telles que l’interleukine (IL) immunosuppressive IL-10, des facteurs de croissance, GM-CSF (granulocyte macrophage colony-stimulating factor) et G-CSF (granulocyte colony-stimulating factor), ainsi que des chimiokines, telles que CCL2, CCL3, CCL4, CCL5, XCL1 et CXCL81, [1–
3]. Alors que la fonction biologique des facteurs de croissance sécrétés par les cellules NK reste à clarifier, la sécrétion de chimiokines lors d’une inflammation permet la colocalisation des NK avec d’autres cellules hématopoïétiques, comme les cellules dendritiques [
4]. En interagissant avec les cellules dendritiques dans les ganglions lymphatiques, les cellules NK contribuent à façonner la réponse adaptative exercée par les lymphocytes T (LT) et B (LB). En tuant des cellules infectées et stressées, les cellules NK participent aussi au développement de la réponse adaptative en fournissant des débris cellulaires qui peuvent être cross-présentés aux LT CD8+ cytotoxiques [1]. Paradoxalement, la présence des cellules NK peut aussi avoir un effet négatif sur le développement de la réponse adaptative. Nous discuterons dans cette revue des avancées récentes concernant la régulation de la réactivité des cellules NK et de leurs fonctions lors d’une réponse immunitaire. |
Régulation du seuil d’activation des cellules NK Les cellules NK exercent leurs fonctions effectrices contre des cellules cibles tout en étant tolérantes au soi. L’adaptation des cellules NK au soi (« l’éducation » des cellules NK) est un thème émergent de ce domaine de recherche. La démonstration la plus frappante de l’adaptabilité des cellules NK à leur environnement est le mécanisme d’éducation des cellules NK par les molécules du complexe majeur d’histocompatibilité de classe I (CMH-I). |
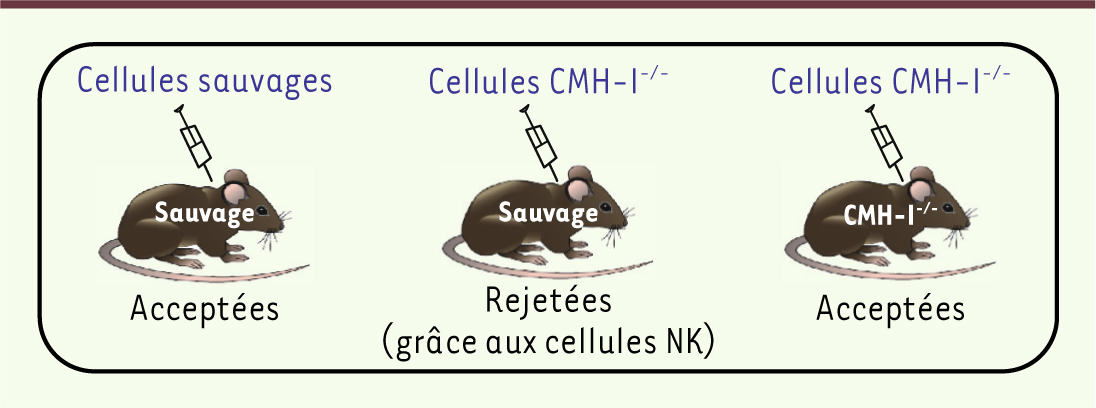
Le rôle des récepteurs inhibiteurs dans la calibration de la réactivité NK Les cellules NK expriment des récepteurs inhibiteurs qui reconnaissent les molécules du CMH-I. Cette reconnaissance contribue à déterminer le seuil de réactivité des cellules NK. Alors que les cellules NK d’une souris sauvage peuvent éliminer une greffe de cellules hématopoïétiques qui n’expriment pas les molécules du CMH-I, les cellules NK d’une souris déficiente pour le CMH-I sont incapables de le faire (Figure 1). D’ailleurs, il n’y a pas d’auto-immunité due aux cellules NK dans une souris déficiente pour les molécules du CMH-I. Le mécanisme sous-jacent à ces observations réside dans un défaut de réponse des cellules NK des souris déficientes pour les molécules du CMH-I, appelées cellules NK « non éduquées », contre leurs cibles classiques et en réponse à une stimulation de leurs récepteurs activateurs [1,
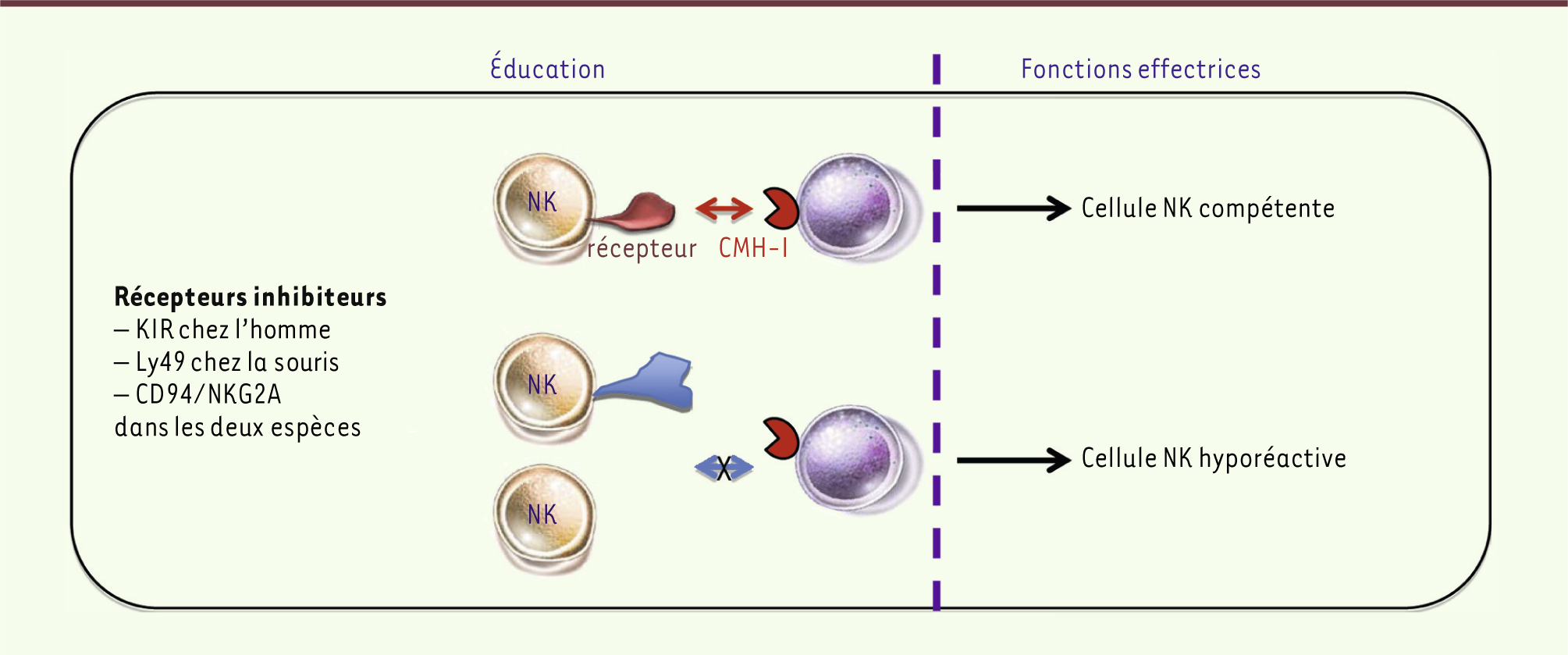
5] (Figure 2). Un phénotype similaire est observé pour une fraction des cellules NK dont les récepteurs inhibiteurs ne sont pas engagés par des molécules de CMH-I correspondantes dans des souris sauvages [
6–
8] (Figure 2). Toutefois, lors d’une stimulation avec du phorbol myristate acétate (PMA) et de la ionomycine in vitro, ou lors d’une infection in vivo, la réactivité des cellules NK non éduquées est restaurée [
9,
10]. D’autres études ont montré que la réactivité des cellules NK non éduquées est rétablie lors de leur transfert dans un hôte sauvage [
11,
12] et, réciproquement, les cellules NK d’une souris sauvage deviennent hyporéactives après transfert dans un hôte déficient pour les molécules du CMH-I [12].
 | Figure 1.
Les cellules NK éduquées reconnaissent l’absence des molécules du CMH-I. Les cellules NK d’une souris sauvage sont éduquées à reconnaître l’absence des molécules du CMH-I et peuvent éliminer une greffe de cellules hématopoïétiques déficientes pour les molécules du CMH-I. Sans cette éducation, les cellules NK d’une souris déficiente pour les molécules du CMH-I sont incapables d’éliminer la greffe. |
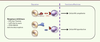 | Figure 2.
L’engagement des récepteurs inhibiteurs au cours de l’éducation des cellules NK calibre leur réactivité fonctionnelle. L’absence de reconnaissance des molécules du CMH-I par les récepteurs inhibiteurs conduit à l’hyporéactivité des cellules NK. |
|
Le rôle des récepteurs activateurs dans la calibration de la réactivité NK La calibration de la réactivité des cellules NK n’est cependant pas uniquement dépendante des signaux délivrés par l’engagement des récepteurs inhibiteurs lors de la reconnaissance des molécules de CMH-I. Ainsi, les cellules NK qui expriment les récepteurs activateurs NKG2D ou Ly49H peuvent devenir hyporéactives après avoir été transférées dans des souris transgéniques qui expriment des ligands de NKG2D ou de Ly49H, respectivement [
13,
14]. Dans ces modèles de souris, les cellules NK expriment encore le récepteur correspondant, mais elles sont tolérantes au ligand exprimé. De même, les cellules NK humaines qui expriment le récepteur activateur KIR2DS1, qui reconnaît spécifiquement le groupe C2 des allèles HLA-C, sont hyporéactives chez des donneurs homozygotes pour C2/C2, au contraire des donneurs qui possèdent au moins un allèle de type C1 [
15]. Ces études démontrent que la réactivité des cellules NK peut être aussi modulée par les récepteurs activateurs au cours de leur éducation (Figure 2). Dans ce contexte, il a été montré que, dans deux modèles de souris qui n’expriment pas le récepteur activateur NKG2D [
16] ou NKp46 (souris Noé) [
17], les cellules NK sont hyperréactives lors de différentes stimulations in vitro. In vivo, ces souris présentent une plus grande résistance aux infections virales. Les cellules NK des souris Noé, déficientes pour l’expression de surface de NKp46, ont un seuil d’activation plus bas que celles de souris sauvages. La complémentation génétique des souris Noé par un transgène NKp46 humain permet de rétablir la réactivité des cellules NK Noé à un niveau comparable à celui des cellules NK contrôles [17]. Ces résultats suggèrent donc que l’engagement du récepteur activateur NKp46 est nécessaire pour calibrer la réactivité des cellules NK. |
Importance du temps d’exposition à l’environnement dans la calibration de la réactivité des NK En plus de cette régulation de la réactivité des cellules NK par les récepteurs inhibiteurs et activateurs, il a été montré que les cellules NK d’un hôte neutropénique sont hyporéactives [
18]. Ces cellules retrouvent leur réactivité après transfert dans une souris receveuse sauvage ayant un nombre normal de polynucléaires neutrophiles. À l’inverse, les cellules NK sauvages perdent leur réactivité après transfert dans un hôte receveur neutropénique. En résumé, ces différents travaux ont montré que la réactivité des cellules NK est plastique, et que ces cellules s’adaptent à leur environnement en régulant leur seuil de réactivité (Figure 3).
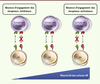 | Figure 3.
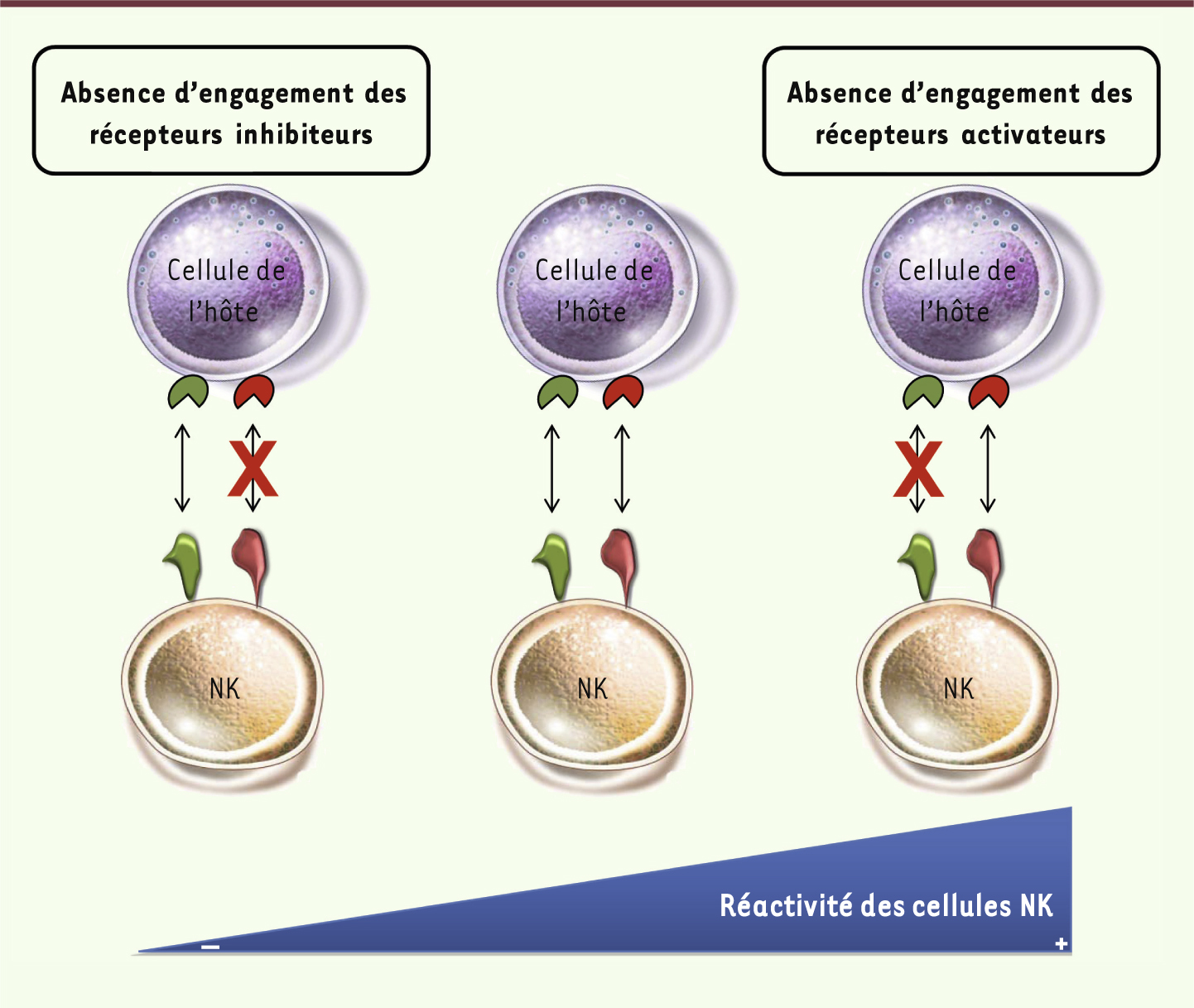
Illustration de la calibration du seuil de réactivité des cellules NK. En l’absence d’une interaction des récepteurs inhibiteurs (KIR, Ly49, CD94/NKG2A) des cellules NK avec les molécules du CMH-I (en rouge), les cellules NK sont hyporéactives (gauche). En l’absence d’une interaction des récepteurs activateurs (NKp46, NKG2D, Ly49H, KIR2DS1) des cellules NK avec leurs ligands (en vert), les cellules NK sont, au contraire, hyperréactives (droite). L’engagement des récepteurs inhibiteurs et activateurs est nécessaire à la calibration des cellules NK (centre). |
Une autre notion importante qui résulte de ces études est que le temps d’exposition des cellules NK à leur environnement dicte leur réactivité. Dans une situation inflammatoire aiguë, lorsqu’elles rencontrent des cellules tumorales ou infectées dont le niveau d’expression des molécules du CMH-I est diminué, ou qui expriment une quantité plus élevée de ligands reconnus par leurs récepteurs activateurs, les cellules NK sont activées et contribuent à l’élimination de ces cellules cibles. C’est lors d’une exposition chronique à l’absence de molécules du CMH-I ou à l’expression ubiquitaire d’un des ligands des récepteurs activateurs que les cellules NK s’adaptent à cet environnement modifié en ajustant leur seuil de réactivité et en devenant hyporéactives. |
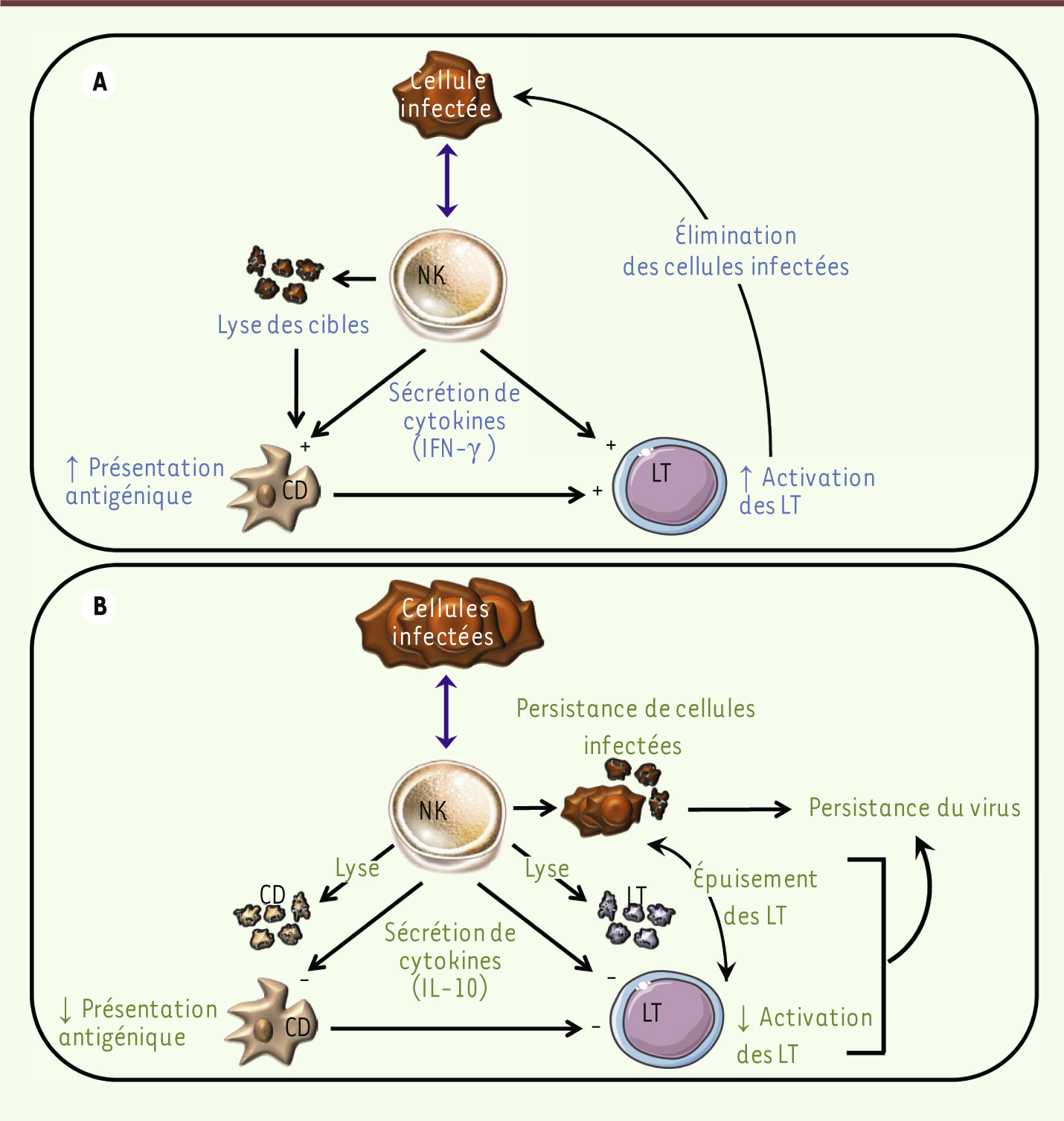
Un rôle immunorégulateur pour les cellules NK Les cellules NK contribuent précocement aux défenses antivirales via la lyse des cellules infectées et la production de cytokines (Figure 4A). Ces cellules peuvent également jouer un rôle dans l’élaboration de la réponse immunitaire adaptative (Figure 4A). Même si un grand nombre de données démontrent l’importance des interactions entre cellules NK et cellules dendritiques pour les fonctions des cellules NK et la maturation des cellules dendritiques [1] (Figure 4A), plusieurs études récentes ont réévalué le rôle des cellules NK dans l’immunité adaptative. La résistance précoce des souris C57BL/6 à l’infection par le cytomégalovirus murin (MCMV) est principalement assurée par les cellules NK. Dans ce modèle d’infection, les cellules NK sont activées à la suite de la reconnaissance par le récepteur activateur Ly49H d’une protéine virale m157 exprimée à la surface des cellules infectées [
19]. En plus de détruire les cellules infectées, les cellules NK Ly49H+ activées ont été décrites comme pouvant accélérer la réponse des lymphocytes T CD8+ (LT CD8+) [
20]. Dans ce système expérimental, l’activation des cellules NK via l’axe Ly49H-m157 pourrait limiter la production d’IFN de type I par les cellules dendritiques plasmacytoïdes qui est préjudiciable au maintien des cellules dendritiques conventionnelles et à l’activation des LT CD8+ anti-MCMV [
21]. À l’inverse, plusieurs études ont décrit que les cellules NK peuvent réguler négativement la réponse des lymphocytes T. Les cellules NK activées via l’axe Ly49H-m157 peuvent réduire le nombre de cellules infectées présentatrices d’antigènes, ce qui a pour conséquence de limiter l’activation des LT et de faciliter la persistance du virus dans les organes [
22] (Figure 4B). Ainsi, en prévenant l’activation des cellules NK Ly49H+ en utilisant un virus MCMV déficient pour la protéine virale m157, le nombre de LT CD8+ anti-MCMV généré est plus élevé [
23]. Par ailleurs, l’hyperréactivité des cellules NK des souris Noé affecte négativement la réponse des lymphocytes T et la génération d’une immunité mémoire protectrice [17]. Des résultats similaires ont également été obtenus dans un modèle de vaccination utilisant de l’ovalbumine en présence d’un adjuvant [
24]. Il a été également démontré, dans des souris déficientes pour la perforine, que les cellules NK Ly49H+ peuvent directement supprimer la réponse des lymphocytes T CD8 anti-MCMV en sécrétant de l’IL-10 [
25] (Figure 4B). En résumé, toutes ces études ont montré que l’activation des cellules NK a un impact sur l’immunité cellulaire T. Ces travaux suggèrent que par leur action sur (1) la charge antigénique, (2) la quantité et la fonctionnalité des cellules dendritiques conventionnelles, et (3) le niveau des cytokines inflammatoires, les cellules NK influencent positivement ou négativement l’activation des lymphocytes T.
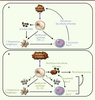 | Figure 4.
Rôles des cellules NK dans la réponse immunitaire. A. Effets positifs des cellules NK. Lors d’une infection, les cellules NK favorisent l’activation des cellules dendritiques (CD) et la présentation d’antigènes aux lymphocytes T (LT) grâce à la lyse des cellules infectées et la sécrétion de cytokines pro-inflammatoires. L’augmentation du nombre de LT activés contribue à une meilleure élimination des cellules infectées. B. Effets inhibiteurs des cellules NK. Dans certaines conditions infectieuses, infection chronique ou lors de fortes doses virales, les cellules NK peuvent sécréter des cytokines immunosuppressives et lyser les cellules dendritiques, ce qui diminue la présentation antigénique et le nombre de LT activés. La sécrétion de cytokines immunosuppressives peut aussi agir directement sur les LT et diminuer leur état d’activation. Les cellules NK peuvent également lyser les LT activés. La réduction du nombre de LT activés ainsi qu’une charge microbienne élevée conduisent à la persistance de cellules infectées ce qui, en retour, contribue à l’épuisement des LT et à la persistance du virus dans les organes infectées. |
Alors que la cytotoxicité des cellules NK contribue largement aux défenses antivirales, on peut s’interroger sur l’avantage biologique qu’il y a à limiter les réponses adaptatives. Chez des souris infectées par le virus de la chorioméningite lymphocytaire (LCMV), deux études récentes ont montré que les cellules NK peuvent détruire les LT CD4+ activés, ce qui affecte le développement et la fonctionnalité des LT CD8+ [
26,
27] (Figure 4B). En fonction de la dose de virus injectée, cette régulation négative de l’immunité adaptative par les cellules NK prévient efficacement le développement d’une pathologie auto-immune causée par les lymphocytes T. Les interactions moléculaires entre les cellules NK et les LT CD4+ restent encore à identifier, mais ces recherches pourraient conduire à l’élaboration de nouveaux modèles thérapeutiques dans le traitement de pathologies auto-immunes. |
Mémorisation par les cellules NK Un des dogmes de l’immunologie est que contrairement aux cellules du système immunitaire inné, les cellules du système immunitaire adaptatif sont capables de mémoriser une primo-infection et de protéger l’hôte plus efficacement lors d’une réinfection. À la suite d’une rencontre avec un antigène, les lymphocytes T et B spécifiques de l’antigène prolifèrent, se contractent et se différencient en cellules mémoires. Ces lymphocytes mémoires sont reprogrammés pour répondre plus efficacement lors d’une réexposition à l’antigène. Les cellules mémoires persistent dans presque tous les tissus et, généralement, tout au long de la vie de l’hôte. Lors d’une réexposition, la réponse secondaire est à la fois plus rapide, plus intense et plus efficace que la réponse primaire. Ce mécanisme de mémorisation est à la base du concept de la vaccination. Les cellules NK, qui appartiennent au système immunitaire inné, sont donc considérées comme n’étant pas capables de générer une mémoire immunologique. Cependant, plusieurs arguments suggèrent que les cellules NK pourraient exprimer des propriétés jusque-là attribuées uniquement aux lymphocytes T et B [
28]. La première démonstration d’une mémorisation par les cellules NK a été réalisée dans un modèle d’hypersensibilité de contact à un haptène dans des souris déficientes en cellules T et B, mais pas en cellules NK (souris déficientes pour la recombinase RAG-2) [
29] (Figure 5A). De façon inattendue, une réponse mémoire des cellules NK spécifique de l’haptène a pu être détectée un mois après la sensibilisation. Dans ce modèle expérimental, les cellules NK « mémoires » résident uniquement dans le foie des souris sensibilisées et expriment des niveaux élevés de Thy1 [29] et de CXCR6 [
30].
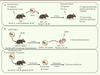 | Figure 5.
Démonstrations d’une mémorisation par les cellules NK. A. Le transfert de cellules NK issues du foie de souris RAG−/−
sensibilisées par un haptène (1) confère aux souris receveuses déficientes en LT, LB et NK (RAG−/−
γC−/−
) une hypersensibilité de contact spécifique de l’haptène utilisé pour la sensibilisation. Dans le cas d’une sensibilisation par des particules virales (2), le transfert de cellules NK confère une augmentation de l’immunité de protection spécifique du virus utilisé pour la sensibilisation. B. Le transfert de cellules NK Ly49H+ préalablement activées in vivo par le MCMV dans des souris nouveau-nées déficientes en LT, LB et NK leur confère une meilleure résistance à une infection par le MCMV que le transfert de cellules NK naïves. C. La restimulation de cellules NK préalablement activées in vitro par un mélange de cytokines (IL-12 + IL-18 + IL-15) et transférées chez des souris RAG−/−
entraîne une augmentation de leurs fonctions effectrices. |
La génération de cellules NK avec des propriétés de cellules mémoires a été également observée à la suite d’une infection virale par le MCMV [
31] (Figure 5B). Dans ces expériences, des cellules NK Ly49H+ transférées dans des souris infectées par le MCMV subissent une phase de prolifération, puis de contraction, et forment une population de cellules mémoires qui persistent au cours du temps dans la rate, les ganglions lymphatiques et le foie des souris infectées. En outre, ces cellules NK mémoires expriment plusieurs marqueurs de surface associés aux populations de lymphocytes T mémoires, et sécrètent plus de cytokines lors de leur restimulation. Les auteurs ont également démontré que l’efficacité de protection des cellules NK mémoires transférées chez des souris nouveau-nés est supérieure à celle fournie par des cellules NK naïves [31] (Figure 5B). La génération de cellules NK mémoires a été également observée chez des souris auxquelles on avait injecté des particules virales contenant des déterminants du virus de l’influenza, du VSV (vesicular stomatitis virus), du VIH-1 (virus de l’immunodéficience humaine) [30] et de la vaccine [
32] (Figure 5A). D’autres travaux ont aussi démontré que des cellules NK préactivées in vitro par un cocktail de cytokines et transférées dans un hôte naïf sont encore, trois semaines plus tard, hyperréactives [
33] (Figure 5C). Une étude récente a également montré qu’après trois semaines de stimulation par un mélange de cytokines, les cellules NK humaines stimulées sont plus efficaces que des cellules NK naïves pour éliminer des cellules tumorales K562 in vitro [
34]. Ces résultats suggèrent qu’une fois activées, les cellules NK acquièrent pour un temps beaucoup plus qu’anticipé une capacité de réponse améliorée à un stimulus. Cette qualité fonctionnelle est acquise de manière stable et transmise au cours des divisions, ce qui suggère, comme pour les lymphocytes T et B mémoires, l’influence de marques épigénétiques dans la persistance des capacités fonctionnelles des cellules NK mémoires. En résumé, ces travaux ont montré que les cellules NK, ou un sous-ensemble spécifique de cellules NK, possèdent la capacité intrinsèque de se différencier en cellules mémoires qui persistent à long terme. Il faut encore démontrer clairement leur génération et leur contribution relative lors d’une réponse immunitaire dans un hôte immunocompétent, mais ces nouvelles découvertes pourraient avoir des applications majeures en termes de vaccination. |
Au cours des dernières années, de nombreuses études ont montré que la réactivité des cellules NK est bien plus « plastique » qu’on ne le pensait [
36,
37]. Leur réactivité est régulée par leur microenvironnement et dépend de la durée d’exposition des cellules NK à cet environnement. Bien que les expériences récentes aient fourni quelques indices sur les mécanismes qui peuvent « calibrer » la réactivité des cellules NK, les bases moléculaires qui permettent cette fine régulation restent encore à clarifier [17,
35]. L’impact de la réponse des cellules NK sur l’immunité adaptative est également soumis aux conditions inflammatoires. D’une part, la cytotoxicité des cellules NK est un mécanisme de défense antivirale qui peut être essentiel à la survie de l’hôte dans des conditions d’infection aiguë. D’autre part, cette cytotoxicité a un impact négatif sur la réponse des lymphocytes T, car elle limite la mémoire immunitaire et favorise la persistance virale. Une telle atténuation de la réponse adaptative semble cependant particulièrement pertinente pour protéger l’hôte d’une immunopathologie auto-immune potentiellement sévère. Des investigations supplémentaires seront nécessaires pour apprécier le rôle immunorégulateur des cellules NK sur l’immunité adaptative. Au cours des dernières années, plusieurs études ont démontré que les cellules NK peuvent également développer une forme de mémoire immunitaire spécifique d’un antigène. Les cellules NK exercent donc des fonctions biologiques complexes qui sont à la fois des propriétés fonctionnelles de l’immunité innée, mais aussi de l’immunité adaptative. |
E. Vivier est co-fondateur et actionnaire d’Innate Pharma.
E. Narni-Mancinelli et S. Ugolini déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Vivier
E
,
Raulet
DH
,
Moretta
A
, et al.
Innate or adaptive immunity? The example of natural killer cells . Science.
2011; ; 331 : :44.–49. 2.
Fauriat
C
,
Long
EO
,
Ljunggren
HG
, et al.
Regulation of human NK-cell cytokine and chemokine production by target cell recognition . Blood.
2010; ; 115 : :2167.–2176. 3.
Murphy
WJ
,
Keller
JR
,
Harrison
CL
, et al.
Interleukin-2-activated natural killer cells can support hematopoiesis in vitro and promote marrow engraftment in vivo . Blood.
1992; ; 80 : :670.–677. 4.
Walzer
T
,
Vivier
E
. G-protein-coupled receptors in control of natural killer cell migration . Trends Immunol.
2011; ; 32 : :486.–492. 5.
Jaeger
BN
,
Vivier
E
. Natural killer cell tolerance: control by self or self-control?
Cold Spring Harb Perspect Biol.
2012; ; 4 : doi: 10.1101/cshperspect.a007229.
6.
Anfossi
N
,
Andre
P
,
Guia
S
, et al.
Human NK cell education by inhibitory receptors for MHC class I . Immunity.
2006; ; 25 : :331.–342. 7.
Fernandez
NC
,
Treiner
E
,
Vance
RE
, et al.
A subset of natural killer cells achieves self-tolerance without expressing inhibitory receptors specific for self-MHC molecules . Blood.
2005; ; 105 : :4416.–4423. 8.
Kim
S
,
Iizuka
K
,
Kang
HS
, et al.
In vivo developmental stages in murine natural killer cell maturation . Nat Immunol.
2002; ; 3 : :523.–528. 9.
Sun
JC
,
Lanier
LL
. Cutting edge: viral infection breaks NK cell tolerance to missing self . J Immunol.
2008; ; 181 : :7453.–7457. 10.
Tay
CH
,
Welsh
RM
,
Brutkiewicz
RR
. NK cell response to viral infections in beta 2-microglobulin-deficient mice . J Immunol.
1995; ; 154 : :780.–789. 11.
Elliott
JM
,
Wahle
JA
,
Yokoyama
WM
. MHC class I-deficient natural killer cells acquire a licensed phenotype after transfer into an MHC class I-sufficient environment . J Exp Med.
2010; ; 207 : :2073.–2079. 12.
Joncker
NT
,
Shifrin
N
,
Delebecque
F
, et al.
Mature natural killer cells reset their responsiveness when exposed to an altered MHC environment . J Exp Med.
2010; ; 207 : :2065.–2072. 13.
Sun
JC
,
Lanier
LL
. Tolerance of NK cells encountering their viral ligand during development . J Exp Med.
2008; ; 205 : :1819.–1828. 14.
Tripathy
SK
,
Keyel
PA
,
Yang
L
, et al.
Continuous engagement of a self-specific activation receptor induces NK cell tolerance . J Exp Med.
2008; ; 205 : :1829.–1841. 15.
Fauriat
C
,
Ivarsson
MA
,
Ljunggren
HG
, et al.
Education of human natural killer cells by activating killer cell immunoglobulin-like receptors . Blood.
2009; ; 115 : :1166.–1174. 16.
Zafirova
B
,
Mandaric
S
,
Antulov
R
, et al.
Altered NK cell development and enhanced NK cell-mediated resistance to mouse cytomegalovirus in NKG2D-deficient mice . Immunity.
2009; ; 31 : :270.–282. 17.
Narni-Mancinelli
E
,
Jaeger
BN
,
Bernat
C
, et al.
Tuning of natural killer cell reactivity by NKp46 and Helios calibrates T cell responses . Science.
2012; ; 335 : :344.–348. 18.
Jaeger
BN
,
Donadieu
J
,
Cognet
C
, et al.
Neutrophil depletion impairs natural killer cell maturation, function, and homeostasis . J Exp Med.
2012; ; 209 : :565.–580. 19.
Arase
H
,
Mocarski
ES
,
Campbell
AE
, et al.
Direct recognition of cytomegalovirus by activating and inhibitory NK cell receptors . Science.
2002; ; 296 : :1323.–1326. 20.
Robbins
SH
,
Bessou
G
,
Cornillon
A
, et al.
Natural killer cells promote early CD8 T cell responses against cytomegalovirus . PLoS Pathog.
2007; ; 3 : :e123.. 21.
Xie
X
,
Stadnisky
MD
,
Coats
ER
, et al.
MHC class I Dk expression in hematopoietic and nonhematopoietic cells confers natural killer cell resistance to murine cytomegalovirus . Proc Natl Acad Sci USA.
2010; ; 107 : :8754.–8759. 22.
Andrews
DM
,
Estcourt
MJ
,
Andoniou
CE
, et al.
Innate immunity defines the capacity of antiviral T cells to limit persistent infection . J Exp Med.
2010; ; 207 : :1333.–1343. 23.
Mitrovic
M
,
Arapovic
J
,
Jordan
S
, et al.
The NK cell response to mouse cytomegalovirus infection affects the level and kinetics of the early CD8+ T-cell response . J Virol.
2012; ; 86 : :2165.–2175. 24.
Soderquest
K
,
Walzer
T
,
Zafirova
B
, et al.
Cutting edge: CD8+ T cell priming in the absence of NK cells leads to enhanced memory responses . J Immunol.
2011; ; 186 : :3304.–3308. 25.
Lee
SH
,
Kim
KS
,
Fodil-Cornu
N
, et al.
Activating receptors promote NK cell expansion for maintenance, IL-10 production, and CD8 T cell regulation during viral infection . J Exp Med.
2009; ; 206 : :2235.–2251. 26.
Lang
PA
,
Lang
KS
,
Xu
HC
, et al.
Natural killer cell activation enhances immune pathology and promotes chronic infection by limiting CD8+ T-cell immunity . Proc Natl Acad Sci USA.
2012; ; 109 : :1210.–1215. 27.
Waggoner
SN
,
Cornberg
M
,
Selin
LK
, et al.
Natural killer cells act as rheostats modulating antiviral T cells . Nature.
2011; ; 481 : :394.–398. 28.
Bercovici
N
,
Caignard
A
. Rencontre avec un pathogène : les cellules natural killer se souviennent-elles ?
Med Sci (Paris).
2009; ; 25 : :559.–562. 29.
O’Leary
J G
,
Goodarzi
M
,
Drayton
DL
, et al.
T cell- and B cell-independent adaptive immunity mediated by natural killer cells . Nat Immunol.
2006; ; 7 : :507.–516. 30.
Paust
S
,
Gill
HS
,
Wang
BZ
, et al.
Critical role for the chemokine receptor CXCR6 in NK cell-mediated antigen-specific memory of haptens and viruses . Nat Immunol.
2010; ; 11 : :1127.–1135. 31.
Sun
JC
,
Beilke
JN
,
Lanier
LL
. Adaptive immune features of natural killer cells . Nature.
2009; ; 457 : :557.–561. 32.
Gillard
GO
,
Bivas-Benita
M
,
Hovav
AH
, et al.
Thy1+ NK cells from vaccinia virus-primed mice confer protection against vaccinia virus challenge in the absence of adaptive lymphocytes . PLoS Pathog.
2011; ; 7 : :e1002141.. 33.
Cooper
MA
,
Elliott
JM
,
Keyel
PA
, et al.
Cytokine-induced memory-like natural killer cells . Proc Natl Acad Sci USA.
2009; ; 106 : :1915.–1919. 34.
Romee
R
,
Schneider
SE
,
Leong
JW
, et al.
Cytokine activation induces human memory-like NK cells . Blood.
2012 : doi: 10.1182/blood-2012-04-419283
35.
Guia
S
,
Jaeger
BN
,
Piatek
S
, et al.
Confinement of activating receptors at the plasma membrane controls natural killer cell tolerance . Sci Signal.
2011; ; 4 : :ra21.. 36.
Rouzaire
P
,
Mayol
K
,
Viel
S
, et al.
Homéostasie des cellules natural killer . Med Sci (Paris).
2012; ; 28 : :403.–408. 37.
Iannello
A
,
Débbeche
O
,
Samarani
S
, et al.
Le naturel killer, fer de lance des futures immunothérapies anti-tumorales . Med Sci (Paris).
2007; ; 23 : :502.–508. |