| |
| Med Sci (Paris). 2013 May; 29(5): 463–468. Published online 2013 May 28. doi: 10.1051/medsci/2013295007.La métabolomique au service de la médecine L’exemple du carcinome rénal Valérian Dormoy1,2* and Thierry Massfelder1** 1Inserm U1113, équipe 3 « signalisation et communication cellulaires dans les cancers du rein et de la prostate », université de Strasbourg, faculté de médecine, 11, rue Humann, 67085Strasbourg, France 2Département de biologie développementale et cellulaire, université de Californie, Irvine, 4150 McGaugh Hall, 92697Irvine, CA, États-Unis MeSH keywords: Néphrocarcinome, métabolisme, Humains, Tumeurs du rein, Métabolomique |
Un nouveau membre de la famille « -omique » La métabolomique, qui représente une discipline nouvelle au sein de la grande famille « -omique », comporte de nouveaux outils à fort potentiel et suscite un vif intérêt dans la communauté scientifique, alors que les contraintes techniques semblaient infranchissables il y a seulement quelques années [
1,
2]. Que se cache-t-il derrière ce terme de métabolomique, élevé récemment au rang de science (Figure 1) ? Un métabolite est une substance de petite taille (en général moins d’un kilodalton) formée au cours du métabolisme, qu’il s’agisse du produit final ou d’un intermédiaire. La principale limitation à l’identification des métabolites se situe dans l’usage des techniques de détection. Il est classique de classer ces métabolites en deux catégories en fonction de leur origine : endogènes lorsqu’ils sont produits par l’organisme, exogènes lorsqu’ils proviennent de l’environnement extérieur.
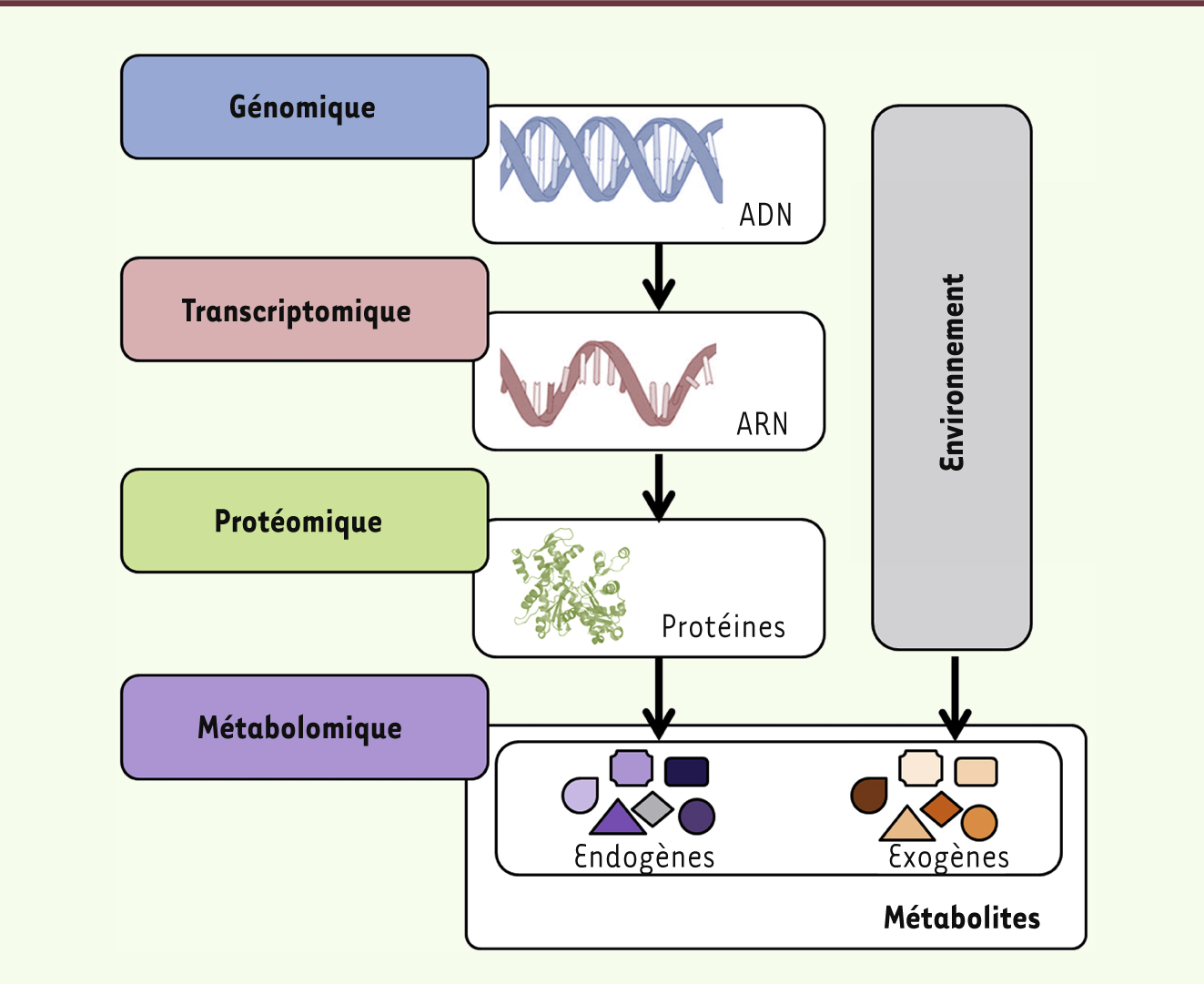
 | Figure 1.
La métabolomique, un nouveau membre de la famille « -omique ». La métabolomique, étude des métabolites issus de l’organisme ou provenant de l’environnement, se situe en aval de la génomique (étude de l’ensemble des gènes), de la transcriptomique (étude de l’ensemble des ARN messagers) et de la protéomique (étude de l’ensemble des protéines). |
La métabolomique, en tant que technique, apparaît au tout début du troisième millénaire, alors que la génomique, la transcriptomique et la protéomique (chefs de file de la famille « -omique ») ont déjà fait leurs preuves comme outils essentiels pour la caractérisation et la compréhension des organismes biologiques. Une définition de la métabolomique appliquée à la médecine serait : l’étude systématique de l’empreinte chimique unique laissée par les processus biologiques au cours du métabolisme. Ainsi, l’analyse des métabolites présents dans l’organisme ou rejetés avec les sécrétions naturelles, permettrait de constituer une signature métabolomique évoluant au cours de la vie, au rythme des mutations, des modifications de l’organisme et des maladies associées. Associée à l’étude des gènes et des protéines, elle complètera le rectangle des quatre « -omiques » au sein du cercle représenté par l’organisme. Le développement des outils d’analyse et de détection d’échantillons biologiques - comme la chromatographie et la spectrométrie de masse -, la découverte de l’impact crucial pour la compréhension des pathologies de certains des métabolites identifiés dans ces échantillons (par exemple les microARN), permettent aujourd’hui à la métabolomique de se développer et de trouver ses applications en médecine [
3]. |
Le rein et l’étude des métabolites Les trois principales sources de métabolites en biologie animale sont l’urine, le sang et les tissus, auxquelles s’ajoutent la salive, la respiration, les fluides cérébraux, les larmes et la transpiration, actuellement en cours d’exploration [
4]. Le choix du rein comme application privilégiée de la métabolomique s’est imposé : cet organe est responsable de la filtration sanguine et de la production d’urine, et toutes les pathologies rénales induisent une modification évidente de la signature métabolomique. Trois questions principales ont ainsi été explorées : la métabolomique peut-elle être utilisée en tant qu’outil diagnostic ? Peut-elle aider à définir des critères pronostiques, et/ou prédictifs ? Peut-elle identifier des cibles thérapeutiques ? Le but final de l’étude des métabolites étant d’obtenir une concordance entre le profil analysé dans les biofluides et la biochimie du tissu pathologique considéré, il est nécessaire de déterminer comment un profil métabolomique tissulaire se reflète dans la signature métabolomique des prélèvements sanguins ou urinaires (Figure 2). Nous rapportons ici l’exemple de l’étude métabolomique dans le cas d’un carcinome rénal, où on peut prédire que la tumeur et son métabolisme induisent des changements dans la composition du sang et de l’urine. Aussi, les cancers du rein sont devenus des modèles d’étude dans le cadre de la métabolomique.
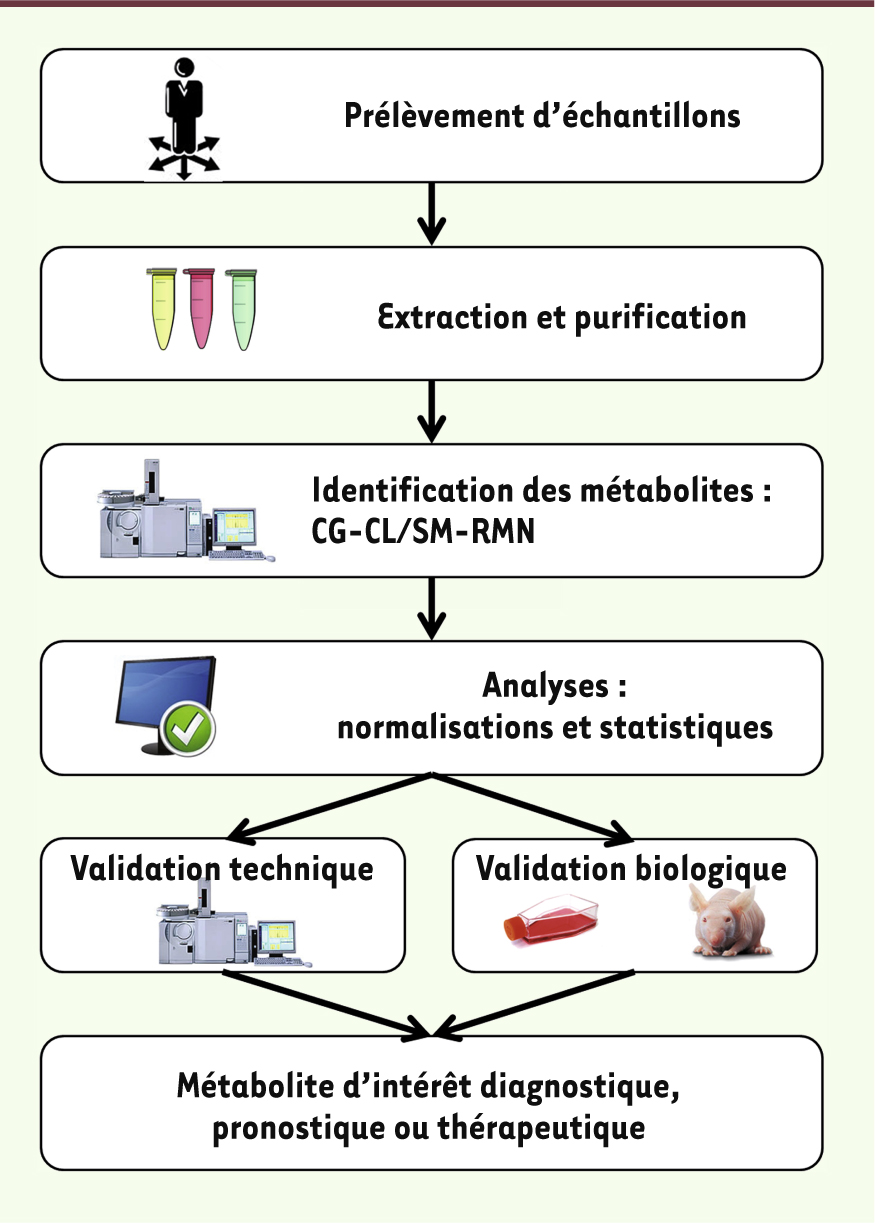
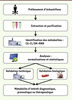 | Figure 2.
Le parcours métabolomique. La métabolomique débute avec le prélévement du matériel au sein d’une matrice choisie (sang, urine, tissu, etc.). Après extraction et purification des métabolites contenus dans les échantillons, les différentes signatures électrochimiques sont typiquement analysées par chromatographie et spectrométrie de masse (ou résonnance nucléaire magnétique). Des logiciels informatiques permettent ensuite l’identification précise et la titration des métabolites. Finalement, une validation technique démontrant la répétitivité des résultats et une validation biologique confirmant la valeur prédictive de l’approche permettent d’affirmer l’identification d’un métabolite d’intérêt diagnostique, pronostique ou thérapeutique. CG : chromatographie en phase gazeuse ; CL : chromatographie en phase liquide ; SM : spectrométrie de masse ; RMN : résonance magnétique nucléaire. |
|
La preuve de concept de l’intérêt de la métabolomique dans le carcinome rénal Aspects méthodologiques Parmi les études les plus récentes associant métabolomique et maladies du rein figure celle de R.H. Weiss ( University of California, Davis, États-Unis) [
5–
7]. En utilisant un modèle de xénogreffes tumorales (greffe de cellules cancéreuses rénales humaines chez des souris immunodéficientes), cette équipe a identifié une signature métabolomique unique en comparant les métabolites présents dans les échantillons de sang, d’urine ou de tissu des souris du groupe sain avec ceux du groupe ayant reçu la xénogreffe. D’un point de vue technique, l’approche expérimentale choisie a été centrée sur l’analyse des biofluides et des tissus avec des approches de séparation à haute résolution pour l’identification de composés chimiques de petites tailles (Figure 2). L’équipement de base associe la chromatographie (en phase gazeuse ou liquide) à la spectrométrie de masse ou à la résonance magnétique nucléaire en fonction des échantillons analysés. Si la chromatographie en phase gazeuse permet l’identification de composés volatiles, les métabolites analysés avec cette technique doivent également être thermostables et non polaires, propriétés qui limitent le nombre de molécules identifiables [
8]. Au contraire, la chromatographie en phase liquide sépare les molécules analysées en fonction de leurs propriétés physicochimiques, telles que la polarité, la charge ionique et le poids moléculaire [
9]. De plus, de nombreuses librairies de composés associés à la chromatographie en phase gazeuse sont disponibles, au contraire de la chromatographie en phase liquide pour laquelle peu de banques de données consultables sont disponibles pour le moment. Ainsi, une analyse optimale de métabolites combine les deux types de chromatographie. Les principaux critères de choix entre spectrométrie de masse ou résonance magnétique nucléaire sont : la quantité d’échantillons disponibles, la variabilité du pH ou encore la reproductibilité des résultats. Si la spectrométrie de masse était largement utilisée jusqu’en 2006, la résonance magnétique nucléaire - beaucoup plus résolutive - commence à supplanter le criblage à haut débit par spectrométrie [
10,
11]. Après cette première étape d’identification des métabolites dans un échantillon donné, des méthodes de normalisation dépendantes de la matrice ont été mises en œuvre pour permettre la comparaison des échantillons. Des biostatisticiens traitent ensuite les résultats et analysent les différences statistiques d’un échantillon à l’autre, d’une matrice à l’autre, etc. Finalement, une méthode de validation technique est mise en place, suivie d’une validation biologique. La première concerne la reproductibilité des résultats, la seconde permet l’analyse de la pertinence in vitro et in vivo des métabolites identifiés. Les résultats Les investigations de l’équipe de R.H. Weiss montrent une similitude dans la composition en métabolites d’une matrice à l’autre : il existe un lien très fort entre l’expression des métabolites retrouvés dans le sang et les tissus, moindre lorsque l’on compare l’expression des métabolites entre l’urine et le sang ou l’urine et le tissu. Au-delà de la simple description des profils métabolomiques dans cette situation pathologique, la finalité de l’investigation se trouve dans l’analyse comparée des trois matrices à la recherche de cibles moléculaires potentielles pour le traitement, le diagnostic ou le pronostic. Parmi tous les métabolites identifiés (267 pour les échantillons tissulaires et l’urine, 246 dans les analyses sanguines), 89 ont été détectés dans les trois matrices, et les deux tiers de ces métabolites communs variaient dans le même sens dans chaque matrice (Figure 3). Plusieurs métabolites et leurs modulateurs ont été ainsi identifiés, dont le rôle devra être précisément analysé et validé dans des expériences dédiées. Il s’agit de la cinnamoylglycine, du glucose, de la nicotinamide, de la phénylpropionoylglycine ou encore de la valine. Sachant que la cinnamoylglycine et la nicotinamide sont altérées par le catabolisme des peroxysomes, l’implication potentielle de PPAR-α (peroxysome proliferator-activated receptor-α) dans la régulation énergétique associée aux échanges d’électrons semblait pertinente pour tenter d’expliquer la signature métabolomique obtenue. En utilisant des approches expérimentales classiques d’inhibition - via des inhibiteurs pharmacologiques ou des petits ARN interférents - et de détection par Western blot, les auteurs confirment notamment l’implication du tryptophane et du récepteur PPAR-α dans la croissance du carcinome rénal.
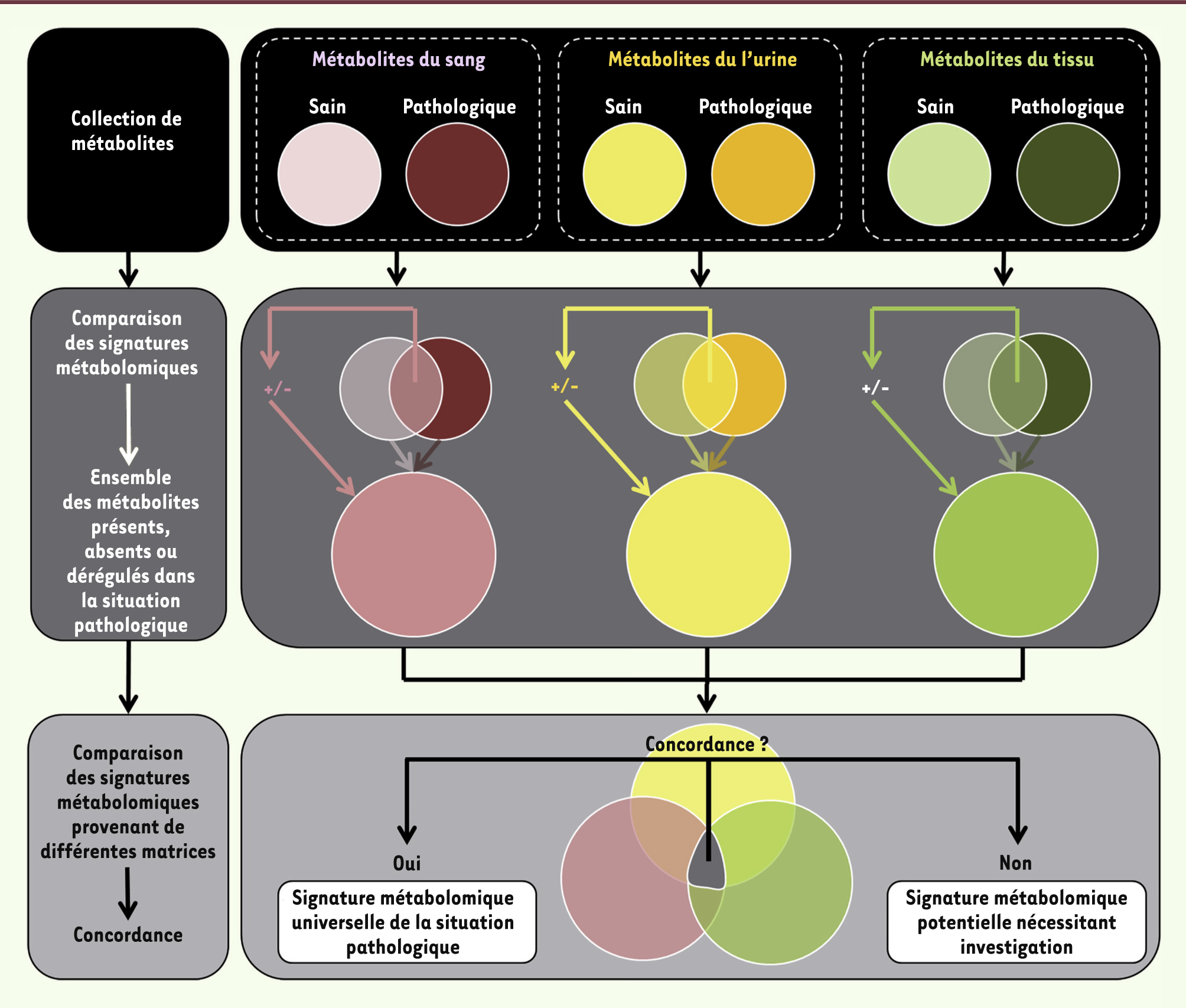
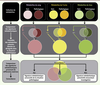 | Figure 3.
Définition d’une signature métabolomique pathologique à partir d’échantillons provenant de plusieurs matrices. Une collection de prélèvements provenant de sang, d’urine ou de tissu d’un patient permet l’identification d’un ensemble de métabolites ayant trois caractéristiques : (1) ils ne sont pas détectés dans une situation contrôle (ou chez le sujet sain), (2) ils sont présents uniquement dans la situation pathologique, ou (3) ils sont communs aux deux situations, mais présents dans des quantités significativement différentes. Ce groupe de métabolites constitue déjà une signature métabolomique d’une situation pathologique, mais la comparaison de ces groupes obtenus dans des matrices différentes permet finalement la description d’une signature métabolomique universelle de cette situation pathologique. +/- : métabolites surexprimés ou réprimés dans une comparaison d’échantillons. |
Dans cet exemple, la métabolomique a, d’une part, confirmé de nombreuses cibles impliquées dans les processus cancéreux et, d’autre part, identifié de nouvelles voies de signalisation potentiellement utiles dans une démarche thérapeutique ou diagnostique. Si elle s’avère un outil essentiel pour comprendre les pathologies rénales, l’analyse métabolomique est-elle généralisable à d’autres maladies ? Sans prétendre couvrir l’ensemble des pathologies humaines où cette application a été rapportée, une analyse de la littérature scientifique associant oncologie et métabolomique au cours de l’année 2012 révèle la présence de nombreuses revues discutant l’apport de la métabolomique en cancérologie ou encore l’intégration de la métabolomique au sein des autres membres de la famille « -omique », données qui pourraient s’avérer capitales pour de futures considérations en recherche fondamentale et clinique [
12–
16]. Citons des études de métabolomique dans les cancers gastroentérologiques [
17–
19], urologiques [
6,
20], ou encore du sein [
21,
22] (Tableau I).
Tableau I.
| Type de cancer |
Matrice |
Méthode d’analyse |
Titre résumé de l’analyse |
Métabolites d’intérêt identifiés |
Références |
| Œsophage |
Sang |
CG/SM |
La métabolomique : nouvelle approche diagnostique pour les cancers gastroentériques |
Acide malonique
L-sérine
|
[17] |
|
| Estomac |
Sang |
CG/SM |
La métabolomique : nouvelle approche diagnostique pour les cancers gastroentériques |
Acide 3-hydroxypropionique
Acide pyruvique
|
[17] |
|
| Colorectal |
Sang |
CG/SM |
La métabolomique : nouvelle approche diagnostique pour les cancers gastroentériques |
L-alanine
Lastose glucoronique
L-glutamine
|
[17] |
|
|
Sang |
CG/SM |
Nouvelle approche diagnostique basée sur la métabolomique pour le cancer colorectal |
a-hydroxybutyrate
Acide aspartique
Kynurénine
|
[
18] |
|
|
Sang |
RMN |
La métabolomique pour identifier et prédire la survie dans le cancer colorectal métastatique |
b-hydroxybutyrate
|
[19] |
|
| Vessie |
Sang |
RMN |
Analyse métabolomique du cancer de la vessie |
Glusose
Tyrosine
Phénylalanine
|
[20] |
|
| Sein |
Sang |
RMN CL/SM |
Approche métabolomique pour prédire la réponse à une chimiothérapie néoadjuvante pour le cancer du sein |
Thréonine
Isoleucine
Glutamine
Acide linolénique
|
[21] |
|
|
Tissus |
CG/SM |
Modifications du métabolisme central dans le cancer du sein invasif |
Cytidine monophosphate
Acide pentadécanoïque
|
[22] |
|
| Rein |
Tissus Sang Urine |
CG/CL/SM |
Identification de marqueurs rénaux tumoraux par analyses métabolomiques multimatricielles |
Cinnamoylglycine
Glucose
Nicotinamide
Phénylpropionoylglycine
Valine
|
[6] |
Tableau récapitulatif des études de métabolites dans des situations de cancers en 2012. CG : chromatographie en phase gazeuse ; CL : chromatographie en phase liquide ; SM : spectrométrie de masse ; RMN : résonance magnétique nucléaire. |
|
Limites et perspectives de la métabolomique La métabolomique émerge comme un outil non invasif, pertinent et prometteur dans le cadre de l’identification d’une signature caractéristique d’une situation biologique, potentiellement importante pour la découverte de nouvelles cibles thérapeutiques [20,
23]. Elle sera particulièrement utile pour enrichir la panoplie des autres « -omiques ». Cependant, les méthodes d’identification des métabolites étant toutes récentes, les limites techniques freinent actuellement l’expansion des applications de la métabolomique. Il faudra notamment : (1) abaisser les seuils de concentration pour la détection des métabolites, ce qui permettra un affinement de l’ébauche métabolomique humaine ; (2) standardiser les méthodes de prélèvement des échantillons dans le cadre d’une matrice donnée, ce qui améliorera la fiabilité, la reproductibilité et la pertinence des analyses métabolomiques. Pour faciliter l’identification des métabolites humains associés à une situation physiologique particulière et la diffusion des résultats, une base de données contenant déjà plus de 40 000 entrées uniques est mise à jour régulièrement1 [
24]. Elle permet également d’obtenir, pour chaque métabolite recherché, des informations biochimiques et cliniques, telles que le seuil de détection ou la pathologie concernée par une modification du niveau d’expression. La création d’une société savante2, et d’un journal international, Metabolomics
3, faciliteront ces échanges et valoriseront l’impact de la métabolomique au sein de la communauté scientifique mondiale, au bénéfice des futures applications et avancées techniques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Patti
GJ
,
Yanes
O
,
Siuzdak
G
. Innovation: metabolomics: the apogee of the omics trilogy . Nat Rev Mol Cell Biol.
2012; ; 13 : :263.–269. 2.
Ricquier
D
. Maladies héréditaires du métabolisme et apports de la métabolomique . Med Sci (Paris).
2005; ; 21 : :512.–516. 3.
Smolinska
A
,
Blanchet
L
,
Buydens
LM
,
Wijmenga
SS
. NMR and pattern recognition methods in metabolomics: from data acquisition to biomarker discovery: a review . Anal Chim Acta.
2012; ; 750 : :82.–97. 4.
Zhang
A
,
Sun
H
,
Wang
P
, et al.
Recent and potential developments of biofluid analyses in metabolomics . J Proteomics.
2012; ; 75 : :1079.–1088. 5.
Ganti
S
,
Taylor
SL
,
Abu Aboud
O
, et al.
Kidney tumor biomarkers revealed by simultaneous multiple matrix metabolomics analysis . Cancer Res.
2012; ; 72 : :3471.–3479. 6.
Weiss
RH
,
Kim
K
. Metabolomics in the study of kidney diseases . Nat Rev Nephrol.
2011; ; 8 : :22.–33. 7.
Ganti
S
,
Weiss
RH
. Urine metabolomics for kidney cancer detection and biomarker discovery . Urol Oncol.
2011; ; 29 : :551.–557. 8.
Mitrevski
BS
,
Kouremenos
KA
,
Marriott
PJ
. Accelerating analysis for metabolomics, drugs and their metabolites in biological samples using multidimensional gas chromatography . Bioanalysis.
2009; ; 1 : :367.–391. 9.
Vuckovic
D
. Current trends and challenges in sample preparation for global metabolomics using liquid chromatography-mass spectrometry . Anal Bioanal Chem.
2012; ; 403 : :1523.–1548. 10.
Lei
Z
,
Huhman
DV
,
Sumner
LW
. Mass spectrometry strategies in metabolomics . J Biol Chem.
2011; ; 286 : :25435.–25442. 11.
Barding
GA, Jr
,
Salditos
R
,
Larive
CK
. Quantitative NMR for bioanalysis and metabolomics . Anal Bioanal Chem.
2012; ; 404 : :1165.–1179. 12.
Casado-Vela
J
,
Cebrian
A
,
Gomez del Pulgar
MT
,
Lacal
JC
. Approaches for the study of cancer: towards the integration of genomics, proteomics and metabolomics . Clin Transl Oncol.
2011; ; 13 : :617.–628. 13.
D’Alessandro
A
,
Zolla
L
. Metabolomics and cancer drug discovery: let the cells do the talking . Drug Discov Today.
2011; ; 17 : :3.–9. 14.
Issaq
HJ
,
Fox
SD
,
Chan
KC
,
Veenstra
TD
. Global proteomics and metabolomics in cancer biomarker discovery . J Sep Sci.
2011; ; 34 : :3484.–3492. 15.
Metallo
CM
. Expanding the reach of cancer metabolomics . Cancer Prev Res (Phila).
2012; ; 5 : :1337.–1340. 16.
Claudino
WM
,
Goncalves
PH
,
di Leo
A
, et al.
Metabolomics in cancer: a bench-to-bedside intersection . Crit Rev Oncol Hematol.
2012; ; 84 : :1.–7. 17.
Ikeda
A
,
Nishiumi
S
,
Shinohara
M
, et al.
Serum metabolomics as a novel diagnostic approach for gastrointestinal cancer . Biomed Chromatogr.
2012; ; 26 : :548.–558. 18.
Nishiumi
S
,
Kobayashi
T
,
Ikeda
A
, et al.
A novel serum metabolomics-based diagnostic approach for colorectal cancer . PLoS One.
2012; ; 7 : :e40459.. 19.
Bertini
I
,
Cacciatore
S
,
Jensen
BV
, et al.
Metabolomic NMR fingerprinting to identify and predict survival of patients with metastatic colorectal cancer . Cancer Res.
2012; ; 72 : :356.–364. 20.
Cao
M
,
Zhao
L
,
Chen
H
, et al.
NMR-based metabolomic analysis of human bladder cancer . Anal Sci.
2012; ; 28 : :451.–456. 21.
Wei
S
,
Liu
L
,
Zhang
J
, et al.
Metabolomics approach for predicting response to neoadjuvant chemotherapy for breast cancer . Mol Oncol.
2012 pii: S1574–7891(12)00101–9.
22.
Budczies
J
,
Denkert
C
,
Muller
BM
, et al.
Remodeling of central metabolism in invasive breast cancer compared to normal breast tissue -a GC-TOFMS based metabolomics study . BMC Genomics.
2012; ; 13 : :334.. 23.
Eckhart
AD
,
Beebe
K
,
Milburn
M
. Metabolomics as a key integrator for «omic» advancement of personalized medicine and future therapies . Clin Transl Sci.
2012; ; 5 : :285.–288. 24.
Wishart
DS
,
Jewison
T
,
Guo
AC
, et al.
HMDB 3.0-The human metabolome database in 2013 . Nucleic Acids Res.
2013; ; 41 : :D801.–D807. |