| |
| Med Sci (Paris). 2013 June; 29(6-7): 570–572. Published online 2013 July 12. doi: 10.1051/medsci/2013296005.Signification et intérêt clinique de l’expression de PD-1 et PDL-1 dans les tumeurs Cécile Badoual,1 Pierre Combe,1 Alain Gey,1 Clémence Granier,1 Hélène Roussel,1 Éléonore De Guillebon,1 Stéphane Oudard,1 and Éric Tartour1* 1Inserm U970, Paris-Centre de recherche cardiovasculaire (PARCC), universityé Paris-Descartes ; hôpital européen Georges Pompidou, 20, rue Leblanc, 75015Paris, France MeSH keywords: Antigène CD274, biosynthèse, Humains, Tumeurs, métabolisme, Pronostic, Récepteur-1 de mort cellulaire programmée |
L’activation des lymphocytes T (LT) nécessite la reconnaissance par le récepteur T d’un complexe HLA-peptide, et un second signal délivré par différentes molécules de costimulation (CD28, OX40, etc.). Afin de réguler cette activation, des molécules de costimulation inhibitrices, telles que CTLA-4 (cytotoxic T lymphocyte antigen 4), PD-1 (programmed cell death protein 1), Tim-3 (T-cell immunoglobulin mucin domain-3), Lag3 (lymphocyte-activation protein 3) sont secondairement induites sur les LT et vont, après interaction avec leurs ligands, inhiber différentes fonctions lymphocytaires T. Au cours d’une stimulation antigénique chronique, comme dans certaines infections virales persistantes ou les cancers, les LT expriment des niveaux élevés de ces molécules de costimulation inhibitrices. Il en résulte une perte de la fonctionnalité de ces cellules et un état d’anergie ou d’épuisement (exhaustion) [
1]. |
Augmentation de l’expression de PD-1 dans les cancers de l’oropharynx associés aux papillomavirus (HPV) oncogéniques Nos travaux ont porté sur l’expression de PD-1 par les LT infiltrant les tumeurs de l’oropharynx associées aux papillomavirus (HPV) oncogéniques qui constituent un nouveau type de cancers induits par les virus, comme nous l’avons décrit récemment dans médecine/sciences [
2]. Notre hypothèse était qu’en raison de l’infection chronique, de la présence d’une tumeur et donc d’une activation chronique des LT, cette molécule inhibitrice devait être augmentée dans ce type de cancer. Nous avons effectivement confirmé l’augmentation de l’expression de PD-1 par les LT infiltrant les tumeurs de l’oropharynx associées à l’HPV par comparaison aux autres tumeurs de l’oropharynx [
3]. Par ailleurs, plus de 50 % des cellules tumorales exprimaient PDL-1, l’un des ligands de PD-1, et une forte interaction entre les LT exprimant PD-1 et les cellules tumorales positives pour PDL-1 a été montrée. |
PD-1 : un marqueur de bon pronostic dans les cancers de l’oropharynx associés à HPV Le résultat inattendu de cette étude a été la mise en évidence du bon pronostic des tumeurs de l’oropharynx dont les LT exprimaient PD-1 [3]. En effet, en raison de sa fonction inhibitrice sur les LT et d’études antérieures montrant une corrélation entre l’expression de PD-1 et un mauvais pronostic clinique, un rôle défavorable avait été attribué à PD-1 au cours des cancers [
4]. Le bon pronostic lié à l’expression de PD-1 dans notre étude s’explique parce que les LT exprimant PD-1 dans ces tumeurs HPV correspondaient plus à des LT activés qu’à des LT épuisés (exhausted). En effet, des marqueurs d’activation étaient fortement exprimés sur ces LT-PD1+. De plus, plus de la moitié de ces LT-PD1+ n’exprimaient pas Tim-3, une autre molécule de costimulation inhibitrice dont la coexpression avec PD-1 est une caractéristique des LT épuisés. Enfin, le fait de pouvoir réactiver ces cellules ex vivo à l’aide d’un anticorps neutralisant anti-PD-1 constituait un autre argument en défaveur de LT de type épuisé. Ce travail montrait donc que, contrairement à l’opinion répandue, l’expression de PD-1 dans une tumeur ne signe pas nécessairement la présence de LT épuisés, mais peut aussi correspondre à un marqueur d’activation. Il a été montré que des cytokines de la famille de l’IL-2, comme l’IL-15, augmentent l’expression de PD-1. Or, nos précédents travaux ont montré que l’IL-15 et la forme soluble de la chaîne alpha de son récepteur étaient fortement exprimées dans les tumeurs ORL où elles pouvaient donc participer à la régulation de l’activité PD-1 [
5]. De façon plus intéressante, la présence de ce marqueur sur les LT infiltrant les tumeurs pourrait aussi refléter une réponse antitumorale à l’origine du phénotype d’activation lymphocytaire. Chez un patient de notre étude, un anticorps anti-PD-1 a augmenté in vitro l’activation de LT contre des antigènes d’HPV, montrant que certains de ces LT-PD1+ sont des LT antitumoraux. Des observations similaires ont été rapportées par le groupe de Rosenberg qui avait observé un enrichissement de LT antitumoraux parmi les LT exprimant PD-1 [
6]. |
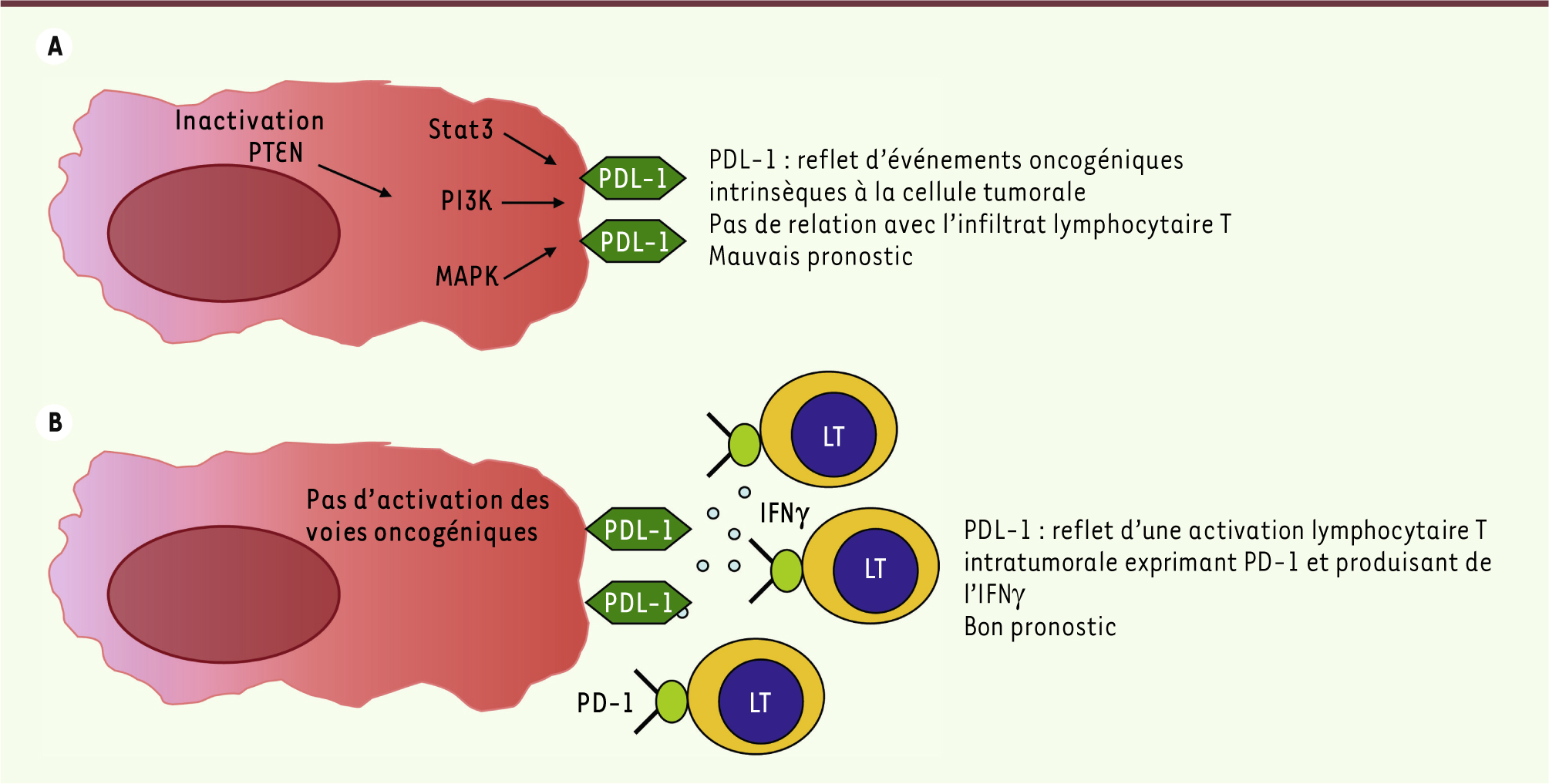
Expression de PDL-1 sur la cellule tumorale : reflet d’une réponse immunitaire antitumorale. PDL-1, le ligand de PD-1, peut être induit à la surface de la cellule tumorale suite à différents évènements oncogéniques (mutation ou délétion du gène suppresseur de tumeur PTEN (phosphatase and tensin homolog), activation de voies de signalisation protumorales impliquant la PI3 kinase et des MAPK (mitogen-activated protein kinase, MEK/ERK). Dans de nombreuses tumeurs où un lien entre des anomalies intrinsèques à la tumeur et l’expression de PDL-1 a été établi, celle-ci a été associée à un mauvais pronostic [
7] (Figure 1A).
 | Figure 1.
Expression de PDL-1 et PD-1 dans une tumeur : signification et pronostic clinique. A. L’expression de PDL-1 est secondaire à l’activation de différentes voies oncogéniques et non dépendante de l’infiltration par les lymphocytes T (LT). Elle est associée à un mauvais pronostic. PTEN : phosphatase and tensin homolog ; PI3K : phosphoinositide 3-kinase ; MAPK : mitogen-activated protein kinase. B. L’expression de PDL-1 est liée à la production d’IFNγ par les LT activés infiltrant la tumeur et qui expriment PD-1, reflet de leur activation. PDL-1 et PD-1, dans ce contexte, sont souvent corrélés à un bon pronostic clinique. |
PDL-1 est également régulée par de nombreuses cytokines, dont celles appartenant à la famille des interférons (IFNα, IFNγ, etc.). La production d’IFNγ est considérée comme le reflet d’une réponse adaptative impliquant les LT. Le groupe de Pardoll a montré, dans les mélanomes et plus récemment dans les cancers ORL, que l’expression de PDL-1 par les cellules tumorales étaient préférentiellement localisée dans des régions au contact direct des LT et produisant de l’IFNγ [
8,
9]. Dans ce contexte, il a été proposé que l’induction de PDL-1 par l’IFNγ produite par les LT infiltrant la tumeur constitue un mécanisme de résistance à la présence d’une immunité adaptative. Contrairement à la situation où l’expression de PDL-1 témoignait de l’activation de voies de signalisation oncogéniques, celle qui est induite en réponse à la production d’IFNγ par les LT a été associée à un bon pronostic dans les mélanomes (Figure 1B). Ces deux travaux montrent que l’expression d’une même molécule (PD-1 ou PDL-1) peut avoir des significations distinctes et être associée à un pronostic différent suivant le contexte tumoral et les mécanismes responsables de leur régulation. |
PD-1 et PDL-1 : marqueurs de sélection des patients à inclure dans des protocoles thérapeutiques impliquant un blocage de la voie PD-1/PDL-1 Des essais cliniques récents ont montré que des anticorps monoclonaux anti-PD-1 entraînaient des réponses cliniques objectives chez 20 à 30 % des patients atteints de cancers du poumon, de mélanomes et de cancers du rein [
10]. Il semble que cet anticorps n’induise pas une réponse antitumorale primaire, mais lève l’inhibition fonctionnelle de LT exprimant PD-1, possible reflet d’une réponse antitumorale préexistante. L’absence d’expression de PDL-1 par la tumeur est associée à une résistance tumorale à l’action de cet anticorps [10]. Nos travaux et ceux du groupe de Topalian suggèrent que l’expression de PD-1 par les LT infiltrant la tumeur et celle de PDL-1 associée à un infiltrat lymphocytaire sont des témoins d’une réponse antitumorale endogène et pourraient constituer de nouveaux marqueurs de sélection de patients. Au contraire, les patients dont la tumeur exprime PDL-1 en réponse à un évènement oncogénique intrinsèque, mais sans infiltration lymphocytaire T associée, risquent de ne pas répondre à cet anticorps anti-PD-1. La combinaison de ce traitement à une stratégie d’immunothérapie visant à induire une réponse immunitaire antitumorale (vaccin) pourrait être proposée à ce dernier groupe de patients. Nous avons validé dans un modèle préclinique cette hypothèse en montrant qu’une tumeur exprimant de façon intrinsèque PDL-1 et n’induisant pas de réponses immunitaires, n’est pas sensible à un anticorps anti-PDL-1. En revanche, la combinaison de cet anticorps avec un vaccin antitumoral, qui va provoquer l’induction de LT exprimant PD-1, agit en synergie pour entraîner la régression de la tumeur [3]. |
La signification et le rôle pronostique de l’expression de PD-1 et PDL-1 chez des patients atteints de cancer dépendent des mécanismes à l’origine de cette induction. Ces molécules, lorsqu’elles sont exprimées, pourraient constituer de nouveaux biomarqueurs prédictifs de la réponse thérapeutiques aux anticorps bloquant cette interaction PD-1/PDL-1. |
S. Oudard déclare participer à des essais cliniques pour l’entreprise BMS. C. Badoual, P. Combe, A. Grey, C. Granier, H. Roussel, E. de Guillebon, E. Tartour déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été financés et soutenus par l’ANR, le Labex d’immuno-oncologie, le programme CARPEM (Cancer research for personalized medicine), l’Institut national du cancer, et le Cancéropole-région Île-de-France.
|
1.
Wherry
EJ
. T cell exhaustion . Nat Immunol.
2011; ; 12 : :492.–499. 2.
Badoual
C
,
Pere
H
,
Roussel
H
, et al.
Les cancers des voies aérodigestives supérieures associés aux papillomavirus . Med Sci (Paris).
2013; ; 29 : :83.–88. 3.
Badoual
C
,
Hans
S
,
Merillon
N
, et al.
PD-1-Expressing tumor-infiltrating T cells are a favorable prognostic biomarker in HPV-associated head and neck cancer . Cancer Res.
2013; ; 73 : :128.–138. 4.
Thompson
RH
,
Dong
H
,
Lohse
CM
, et al.
PD-1 is expressed by tumor-infiltrating immune cells and is associated with poor outcome for patients with renal cell carcinoma . Clin Cancer Res.
2007; ; 13 : :1757.–1761. 5.
Badoual
C
,
Bouchaud
G
,
Agueznay Nel
H
, et al.
The soluble alpha chain of interleukin-15 receptor: a proinflammatory molecule associated with tumor progression in head and neck cancer . Cancer Res.
2008; ; 68 : :3907.–3914. 6.
Inozume
T
,
Hanada
K
,
Wang
QJ
, et al.
Selection of CD8+PD-1+ lymphocytes in fresh human melanomas enriches for tumor-reactive T cells . J Immunother.
2010; ; 33 : :956.–964. 7.
Sznol
M
,
Chen
L
. Antagonist antibodies to PD-1 and B7-H1 (PD-L1) in the treatment of advanced human cancer . Clin Cancer Res.
2013; ; 19 : :1021.–1034. 8.
Taube
JM
,
Anders
RA
,
Young
GD
, et al.
Colocalization of inflammatory response with b7-h1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape . Sci Transl Med 2012. ; 4 : :127.ra137. 9.
Lyford-Pike
S
,
Peng
S
,
Young
GD
, et al.
Evidence for a role of the PD-1:PD-L1 pathway in immune resistance of HPV-associated head and neck squamous cell carcinoma . Cancer Res.
2013; ; 73 : :1733.–1741. 10.
Topalian
SL
,
Hodi
FS
,
Brahmer
JR
, et al.
Safety, activity, and immune correlates of anti-PD-1 antibody in cancer . N Engl J Med.
2012; ; 366 : :2443.–2454. |