| |
| Med Sci (Paris). 2013 June; 29(6-7): 665–668. Published online 2013 July 12. doi: 10.1051/medsci/2013296022.Chroniques génomiques En route vers l’enfant parfait ! Bertrand Jordan1*** 1CoReBio PACA, case 901, parc scientifique de Luminy, 13288Marseille Cedex 9, France MeSH keywords: Syndrome de Down, diagnostic, génétique, Dépistage génétique, Humains, Diagnostic prénatal |

Des évolutions techniques récentes, reposant sur la généralisation des méthodes de séquençage à haut débit (NGS, new generation sequencing), élargissent considérablement les options offertes aux parents désireux de s’assurer une descendance de la meilleure « qualité » possible. Ces avancées, dont certaines sont déjà largement utilisées aux États-Unis tandis que d’autres n’en sont qu’à la démonstration de faisabilité, vont sans nul doute poser des questions éthiques inédites, ou tout au moins rendre bien plus aigus des problèmes jusque-là plutôt théoriques. Il me semble donc urgent d’en faire un rapide inventaire. |
L’invasion des tests non invasifs Ce vocable désigne les analyses réalisables à partir d’une simple prise de sang, par opposition à celles qui nécessitent une biopsie, une amniocentèse ou un prélèvement de villosités choriales. Dans le contexte de cette chronique, il s’agit du sang de la future mère, mais, naturellement, du génome de l’enfant qu’elle porte. Comme je l’ai déjà indiqué [
1], le sérum d’une femme enceinte contient un peu d’ADN fœtal. Celui-ci est inévitablement associé à de l’ADN maternel, en quantité dix ou vingt fois plus importante ; mais si l’on séquence ce mélange et que l’on procède ensuite à une analyse informatique appropriée, il devient possible - dans certaines limites - d’obtenir des informations sur le génome de l’enfant [
2]. |
L’application la plus facile techniquement est le test de paternité non invasif décrit ici l’an dernier [1]. Dans ce cas, il suffit de s’intéresser à des allèles absents chez la mère pour pouvoir dire à coup sûr si le père putatif est bien le géniteur. Il n’est même pas nécessaire de séquencer : on effectue une analyse de l’ADN plasmatique de la future mère à l’aide d’une puce à ADN examinant des centaines de milliers de snip, et (par voie informatique) on soustrait de ce profil celui de l’ADN maternel obtenu grâce aux lymphocytes isolés à partir du même prélèvement. Le profil de l’ADN du père supposé est alors comparé à celui du fœtus : comme on dispose de milliers de snip, il est aisé de décider si les allèles « non maternels » du fœtus proviennent, ou non, du géniteur putatif. Ce test est actuellement proposé par de nombreuses entreprises [
3], à des tarifs de l’ordre de mille dollars, et est sans doute largement utilisé, avec les problèmes éthiques et relationnels que l’on imagine. Bien entendu, il est totalement illégal dans notre pays,… ce qui n’empêche pas au moins une entreprise de le proposer1. |
Une application moins problématique du point de vue éthique, et déjà très largement employée aux États-Unis, consiste à effectuer le diagnostic de trisomie 21 par cette méthode. Pour ce faire, l’ADN isolé à partir de quelques millilitres de sang maternel est séquencé de manière relativement superficielle (à une redondance nettement inférieure à 1), et l’on compte le nombre de fois où des séquences spécifiques du chromosome 21 sont retrouvées, sans tenter de distinguer ce qui provient de la mère ou du fœtus. Bien que l’ADN maternel représente de 80 à 95 % de l’échantillon, il s’avère que la petite augmentation de la représentation du chromosome 21 due à la trisomie de l’embryon peut être détectée de manière fiable [
4,
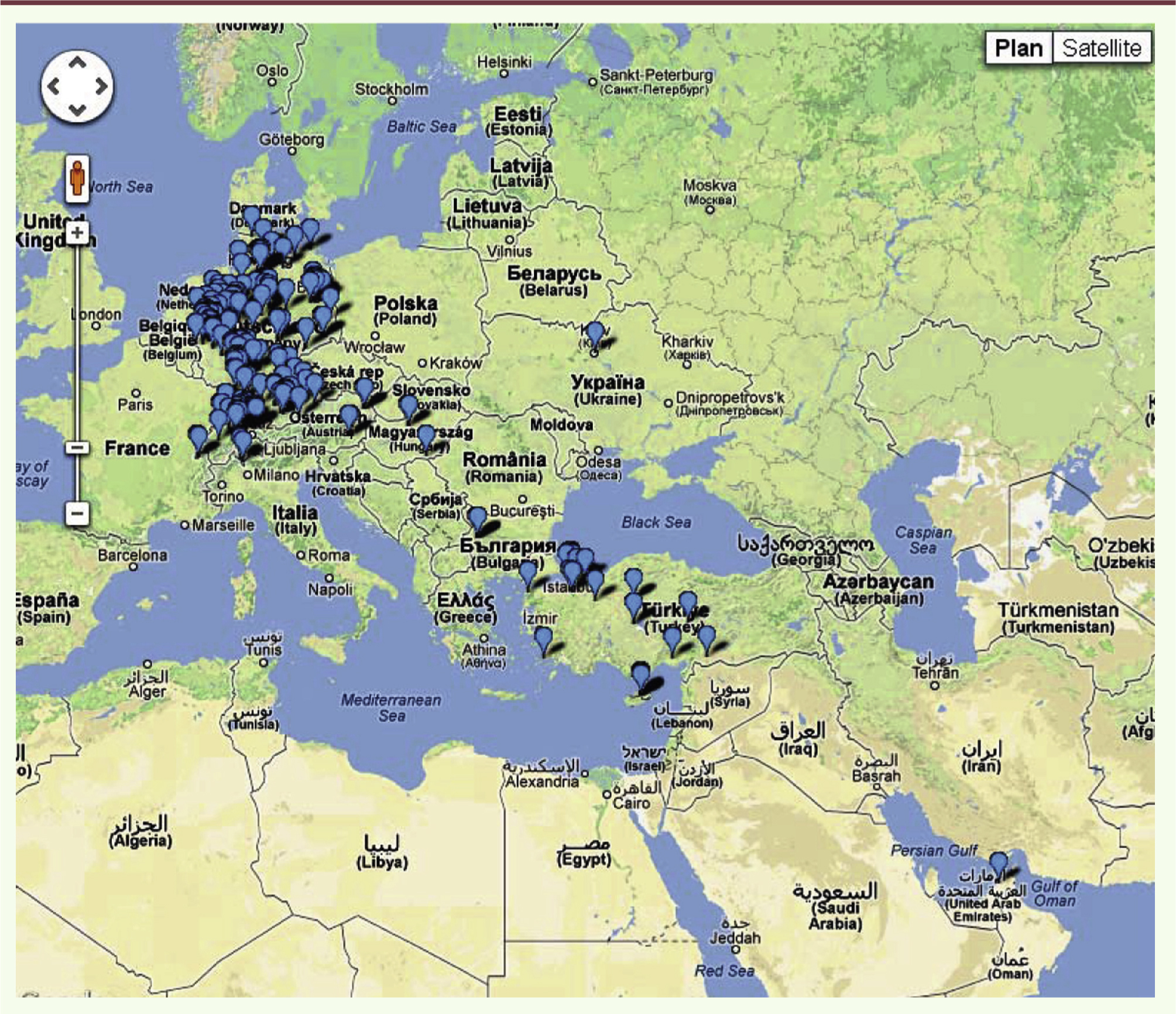
5] avec, dans le meilleur des cas, une sensibilité de 100 % et une spécificité de 97,9 % [4]. Naturellement, plus on séquence, plus le résultat est fiable ; d’un autre côté, on cherche à « multiplexer »2 le plus possible les analyses afin de réduire leur coût unitaire. Il y a là un compromis que le progrès continu des machines rend de moins en moins critique. Toujours est-il que ce test est effectivement commercialisé depuis plus d’un an par plusieurs entreprises aux États-Unis (Sequenom, Ariosa Diagnostics, Natera, et Verinata Health [récemment absorbée par Illumina]), ainsi que par Berry Genomics et BGI en Chine, et par LifeCodexx en Allemagne) (Figure 1).
 | Figure 1.
Cliniques partenaires de LifeCodexx pour le test non invasif de trisomie 21. On notera la trés faible représentation de la France, liée à notre législation. Données extraites de www.lifecodexx.com. |
Ce diagnostic rencontre un très grand succès, et son adoption a été extrêmement rapide : déjà plus de 100 000 analyses pratiquées en 2012 aux États-Unis, chiffre qui va considérablement augmenter cette année. Il est pour le moment proposé essentiellement aux femmes « à haut risque » du fait de leur âge ou de leurs antécédents, mais ses promoteurs espèrent qu’il devienne systématique, auquel cas le marché se chiffrerait en milliards de dollars. Le tarif va de mille à trois mille dollars environ, et nombre de compagnies d’assurance le prennent déjà en charge. Il constitue un véritable progrès, évitant un grand nombre de processus invasifs : c’est seulement si le résultat est positif que l’on procèdera à une amniocentèse ou à un prélèvement de villosités choriales, et on élimine ainsi plus de 90 % des analyses invasives. De plus, dans un contexte où, aux États-Unis, le recours à l’interruption de grossesse devient de plus en plus difficile, le fait que ce test puisse être pratiqué dès dix semaines de grossesse est un indéniable avantage. Notons aussi que, dès maintenant, d’autres trisomies (13 et 18) peuvent être détectées par le même procédé et font déjà partie de certains des tests proposés. À ma connaissance, ce type d’analyse n’est pas actuellement pratiqué en routine en France, même si des expérimentations sont sans doute en cours. Le Collège national des gynécologues et obstétriciens français (CNGOF) s’est prononcé pour sa mise en œuvre rapide pour les grossesses à risque [
6], mais je n’ai pas trouvé de trace d’une introduction prochaine. Pourtant, la demande va être forte, car les avantages sont évidents. |
… et maladies monogéniques ? On peut aller encore plus loin. La démonstration de faisabilité date déjà de plus de deux ans [
7] : Dennis Lo (toujours lui) et ses collaborateurs ont montré que l’on pouvait distinguer l’ADN fœtal (minoritaire) de l’ADN maternel grâce aux très nombreux marqueurs polymorphiques repérables, ouvrant ainsi la possibilité d’examiner l’état de n’importe quel gène fœtal à partir d’une prise de sang de la mère, et même de le séquencer intégralement. Déjà, l’entreprise Verinata a montré la détection de délétions couvrant une vingtaine de mégabases (soit une ou deux bandes chromosomiques), et rien ne s’oppose en principe à ce que le procédé soit utilisé pour le diagnostic prénatal d’affections mendéliennes. Bien sûr, il faut cette fois séquencer de manière beaucoup plus approfondie, car il s’agit d’accéder véritablement à la formule de l’ADN du fœtus, et non simplement de repérer des différences quantitatives au niveau d’un chromosome ou d’une région. Il faut également obtenir les mêmes données sur les ADN maternel et paternel. Comme l’ADN fœtal représente environ 10 % du prélèvement, cela impose une redondance globale de 1000x pour que la séquence du fœtus soit lue cent fois, ce qui est nécessaire pour atteindre la fiabilité requise. Si l’on considère que la région à examiner couvre une mégabase, il faudra donc une gigabase de séquence brute, deux ou trois en comptant les parents ; mais comme les machines actuelles en lisent plusieurs centaines par session, c’est tout à fait envisageable. Je suis prêt à parier que d’ici deux ans on annoncera un diagnostic prénatal non invasif pour la mucoviscidose. |
Extension au diagnostic préimplantatoire Nous n’avons envisagé jusqu’ici que les analyses effectuées pour éviter la naissance d’enfants porteurs d’une anomalie sérieuse, impliquant éventuellement une interruption de grossesse : le test n’est pas invasif, mais ses conséquences sont tout sauf anodines. On pense alors tout naturellement au diagnostic préimplantatoire (DPI). Il est aujourd’hui pratiqué pour repérer, parmi la dizaine d’embryons obtenus par fécondation in vitro chez un couple à risque, ceux qui ne sont pas porteurs de l’allèle pathogène, afin de transférer un (ou deux) de ceux-là dans l’utérus de la future mère. La loi française limite l’emploi de ce procédé aux cas où le couple est porteur d’une affection « d’une particulière gravité », qualificatif qui englobe, par exemple, la mucoviscidose, mais pas une forte prédisposition au diabète de type 1, à l’arthrite rhumatoïde ou à la maladie de Crohn3. Jusqu’à récemment, la très petite quantité d’ADN disponible à partir d’une unique cellule embryonnaire (6 picogrammes environ) restreignait les analyses envisageables à la recherche d’une ou deux mutations prédéfinies. Mais, plusieurs équipes se sont attaquées au Graal scientifique que représente l’analyse d’un génome à partir d’une seule cellule, et ont fait des progrès significatifs. L’élément critique est la mise au point d’une technique d’amplification très efficace et surtout la plus uniforme possible, afin d’éviter un fort déséquilibre entre la représentation de différentes régions dans le mélange amplifié que l’on va séquencer. Des progrès considérables ont été faits avec la mise au point de nouvelles techniques d’amplification plus performantes de ce point de vue que la PCR (polymerase chain reaction) classique : technique MDA (multiple displacement amplification) [
8] reposant sur un amorçage au hasard et une amplification isotherme ou technique MALBAC (multiple annealing and looping-based amplification cycles)[
9]. Dans un article récent [9], les auteurs parviennent à détecter 76 % des snip existants à partir d’une séquence réalisée sur l’ADN amplifié d’une seule cellule. Ce n’est pas assez, certes : il faudrait arriver très près de 100 %, puisque chacun de ces snip peut être l’une des mutations que l’on recherche, mais c’est un début prometteur. Une start-up chinoise, Yikon Genomics, annonce déjà l’emploi de cette méthode pour le criblage des embryons avant implantation. |
DPI plus NGS : l’arme absolue pour le choix d’embryons On peut donc facilement imaginer que, dans un futur proche, à l’échelle de quelques années, il soit techniquement possible de procéder au « contrôle de qualité » d’embryons obtenus par fécondation in vitro. Contrôle de qualité qui serait fondé sur l’examen de leur séquence intégrale, et permettrait non seulement d’éviter certaines anomalies, mais aussi de choisir le « meilleur » embryon en fonction des desiderata des parents : sexe bien sûr, mais aussi taille à l’âge adulte, autres caractéristiques physiques et, peut-être, tendances comportementales. Certes, comme je ne cesse de le souligner dans ces chroniques, notre capacité à définir le phénotype à partir de l’ADN est encore assez imparfaite, bien plus que ne l’imagine le public en général. Elle va néanmoins progresser au fur et à mesure de l’avancée des connaissances. Bien sûr, le procédé sera coûteux, quelques dizaines de milliers d’euros, du moins au début. Mais le marché existe sans nul doute, et il s’élargira au fil des années et de la baisse des prix. Le rêve (ou le cauchemar) d’Andrew Niccol dans « Bienvenue à Gattaca » [
10] et de Lee Silver dans Remaking Eden [
11] se rapproche : l’apparition au sein de l’humanité d’une couche privilégiée non seulement par ses revenus et son mode de vie, mais aussi par sa « qualité génétique », et sa séparation progressive du reste de la population. Nous n’en sommes pas là, évidemment, mais la marchandisation tous azimuts à laquelle on assiste aujourd’hui ne laisse guère de doute sur la probabilité d’une telle évolution. L’étape suivante serait l’amélioration génétique d’êtres humains, ce rêve des transhumanistes [
12,
13] pour lequel une étape de faisabilité a été franchie avec l’obtention de singes transgéniques il y a déjà plus de dix ans [
14]. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jordan, B
. On n’arrête pas le progrès : un test de paternité prénatal et non-invasif . Med Sci (Paris).
2012; ; 28 : :215.–217. 2.
Rossa
WK
,
Chiu
YM
,
Lo
D
. Non-invasive prenatal diagnosis by fetal nucleic acid analysis in maternal plasma: the coming of age . Semin Fetal Neonatal Med.
2011; ; 16 : :88.–93. 4.
Chiu
RW
,
Akolekar
R
,
Zheng
YW
, Non-invasive prenatal assessment of trisomy 21 by multiplexed maternal plasma DNA sequencing: large scale validity study . BMJ. , et al.
2011; ; 342 : :c7401.. 5.
Lau
TK
,
Chan
MK
,
Lo
PS
, et al.
Clinical utility of noninvasive fetal trisomy (NIFTY) test-early experience . J Matern Fetal Neonatal Med.
2012; ; 25 : :1856.–1859. 7.
Lo
YM
,
Chan
KC
,
Sun
H
, et al.
Maternal plasma DNA sequencing reveals the genome-wide genetic and mutational profile of the fetus . Sci Transl Med.
2010; ; 2 : :61.ra91. 8.
Dean
FB
,
Nelson
JR
,
Giesler
TL
,
Lasken
RS
. Rapid amplification of plasmid and phage DNA using Phi 29 DNA polymerase and multiply-primed rolling circle amplification . Genome Res.
2001; ; 11 : :1095.–1099. 9.
Zong
C
,
Lu
S
,
Chapman
AR
,
Xie
XS
. Genome-wide detection of single-nucleotide and copy-number variations of a single human cell . Science.
2013; ; 338 : :1622.–1626. 10.
Gattaca (Bienvenue à Gattaca). , film de Andrew Niccol. , 1997. 11.
Silver
LM.
Remaking eden: how genetic engineering and cloning will transform the american family . New York: : Avon Books; , 1997 : :400 p.. 13.
Stock
G.
, Redesigning humans: our inevitable genetic future . Boston: : Houghton Miffling; , 2002 . 14.
Chan
AW
,
Chong
KY
,
Martinovich
C
, et al.
Transgenic monkeys produced by retroviral gene transfer into mature oocytes . Science.
2000; ; 291 : :309.–312. |