| |
| Med Sci (Paris). 2013 August; 29(8-9): 693–695. Published online 2013 September 5. doi: 10.1051/medsci/2013298005.STAT5, une nouvelle cible thérapeutique contre les récidives de la leucémie myéloïde chronique ? Luana Casetti,1 Séverine Martin-Lannerée,1 Imen Najjar,1 and Isabelle Dusanter-Fourt1* 1Inserm U1016, Institut Cochin, Université Paris Descartes, 22, rue Méchain, 75014Paris, France MeSH keywords: Antinéoplasiques, Benzamides, usage thérapeutique, Survie cellulaire, Résistance aux médicaments antinéoplasiques, Protéines de fusion bcr-abl, antagonistes et inhibiteurs , physiologie, Gènes abl, génétique, Cellules souches hématopoïétiques, Humains, Mésylate d'imatinib, Leucémie myéloïde chronique BCR-ABL positive, traitement médicamenteux, Récidive tumorale locale, prévention et contrôle, Pipérazines, Inhibiteurs de protéines kinases, Protein-tyrosine kinases, Pyrimidines, Facteur de transcription STAT-5 |
La leucémie myéloïde chronique (LMC) représente un cas d’école en cancérologie : c’est le premier cancer à avoir été relié à une anomalie chromosomique, la translocation t(9:22). Cet échange entre les chromosomes 9 et 22 dans une cellule souche hématopoïétique (CSH) aboutit à la formation du gène de fusion BCRABL (BCR pour breakpoint cluster region et ABL pour abelson), dont le produit est une protéine à activité tyrosine kinase, constitutivement activée et responsable de la maladie. La découverte de BCRABL a conduit à l’identification d’un premier inhibiteur chimique de BCRABL, l’imatinib mesylate (IM, ou Glivec), et à la mise en place en 2001 de la première thérapie anticancéreuse ciblant uniquement la cellule tumorale (on parle d’une thérapie ciblée). L’IM/Glivec bloque sélectivement l’activité de BCRABL, et, par conséquence, la survie et la multiplication des cellules tumorales, conduisant à la rémission de la maladie. Cependant, des récidives surviennent chez une majorité des patients lors de l’arrêt du traitement, indiquant la persistance de cellules souches leucémiques capables de provoquer la rechute de la maladie (on parle de maladie résiduelle). Ces cellules sont intrinsèquement réfractaires à l’inhibiteur anti-BCRABL. Par ailleurs, environ 15 à 20 % des patients développent au cours du traitement des résistances à l’inhibiteur. Ces observations pointent la nécessité de découvrir les mécanismes qui sous-tendent ces différentes résistances et mettent en échec une guérison totale. |
Les molécules STAT : fonctions dans les cellules souches hématopoïétiques Les cellules du sang ont une durée de vie très limitée et doivent être en permanence renouvelées grâce à l’activité des CSH. Celles-ci s’adaptent aux besoins de l’organisme en fonction des informations qu’elles reçoivent des cellules de leur microenvironnement ou « niche », sous la forme de facteurs de croissance, cytokines et autres signaux. Cette niche assure aux CSH survie et protection contre divers stress, garantissant leur pérennité. Les informations de la niche sont relayées dans les CSH par un panel de molécules-messagers qui vont guider en conséquence le devenir de ces cellules. STAT5 (signal transducer and activator of transcription 5) est un de ces messagers. La molécule STAT5 existe à l’état latent et inactif dans la cellule et est activée à la réception de certaines informations à la surface de la CSH. Cette activation se traduit par une phosphorylation sur un acide aminé tyrosine particulier de STAT5, ce qui favorise la formation de paires de STAT5 capables de rejoindre le noyau de la cellule et de modifier directement l’expression de certains gènes cibles. STAT5 fait ainsi la navette entre la surface de la cellule - qui réceptionne les informations externes - et les gènes de la cellule dont elle adapte le niveau d’expression. L’expression de BCRABL dans les cellules de LMC déclenche la phosphorylation - et donc l’activation - permanente de STAT5, ce qui entraîne une croissance cellulaire continue, de caractéristique tumorale [
1]. STAT5 désigne deux molécules à 96 % identiques, STAT5A et STAT5B, codées par deux gènes différents dont on a longtemps cru qu’ils étaient interchangeables pour l’essentiel de leurs activités [
2]. Notre équipe a cherché à savoir si ces deux gènes jouaient effectivement le même rôle dans les propriétés des cellules souches de LMC. Des ARN interférents induisant la perte d’expression de STAT5A uniquement, ou de STAT5A et STAT5B simultanément, ont été identifiés et introduits de manière stable par le biais de vecteurs lentiviraux dans une population cellulaire (CD34+) enrichie en CSH humaines. La perte conjointe de STAT5A et STAT5B induit la perte des CSH cultivées en présence de cellules de leur microenvironnement naturel (la niche). Cette perte touche aussi bien les CSH issues de patients leucémiques que celles d’individus sains. Ainsi, les facteurs STAT5 permettent de maintenir en vie les CSH saines comme les cellules souches leucémiques, qui sont réfractaires au Glivec. Les CSH leucémiques ne sont donc pas tributaires de l’activité BCRABL mais de STAT5 pour leur survie, et seront préservées lors d’un traitement anti-BCRABL par le Glivec. |
STAT5A : un rôle protecteur contre le stress cellulaire Si la perte des deux facteurs STAT5 conduit à l’élimination des CSH saines et malades, la seule perte de STAT5A n’a pas d’impact sur la survie de ces cellules, ce qui reflète l’activité redondante des facteurs STAT5A et STAT5B pour cette fonction précise. Nous avons posé la question de l’implication des facteurs STAT5 dans d’autres activités cellulaires essentielles au bon fonctionnement des CSH. Les CSH saines doivent résister aux différentes sources de stress rencontrées, qui pourraient altérer leur patrimoine génétique et donc les propriétés biologiques transmises à toute leur descendance. La croissance massive des cellules leucémiques, quant à elle, nécessite une bonne élimination de composants toxiques issus de leur prolifération incontrôlée qui, sinon, détériore la cellule leucémique elle-même et déclenche sa mort. Nous avons analysé les conséquences de la seule perte d’expression de STAT5A sur les capacités de résistance des CSH à divers types de stress, tels que l’exposition à une source de réactifs oxygénés (H2O2) ou à une densité cellulaire excessive. L’absence de STAT5A accroît le stress de la CSH normale et de la CSH leucémique, comme l’attestent la présence de réactifs oxygénés supplémentaires, l’activation de la voie canonique de réponse au stress - la voie p53 -, et la présence de foyers de cassure de l’ADN génomique. La perte de STAT5A augmente également le niveau de base de stress cellulaire en l’absence de stimulus. Ces données suggèrent qu’une des fonctions, jusque là inconnue, de STAT5A est d’aider la CSH à endiguer les conséquences de l’exposition à diverses sources de stress, qu’elles soient exogènes ou endogènes. Des expériences supplémentaires ont montré que cette fonction de protection contre le stress de STAT5A n’est pas partagée par STAT5B. De plus, cette fonction semble être indépendante d’une régulation directe de l’expression de gènes. Ces observations élargissent les domaines d’intervention de la molécule STAT5A et posent la question de(s) mécanisme(s) qui sous-tendent cette nouvelle activité. |
STAT5A : un facteur de survie clé pour les cellules souches leucémiques résistantes au Glivec Une des sources majeures de stress à laquelle la cellule leucémique est confrontée est le traitement antitumoral qui induit son élimination. Notre équipe a analysé l’impact de l’activité de STAT5A sur les cellules leucémiques qui ont développé une résistance au Glivec. Ces processus de résistance sont souvent liés à l’émergence de formes mutantes de BCRABL qui ne sont plus inhibées par le traitement anti-BCRABL. Notre équipe s’est intéressée aux patients atteints de LMC qui ont développé une résistance au Glivec en l’absence de mutation dans le gène BCRABL et elle a analysé les conséquences de la seule perte de STAT5A dans les cellules leucémiques. Contrairement aux CSH normales et aux cellules souches leucémiques testées au moment du diagnostic, pour lesquelles la perte de STAT5A n’a pas de répercussion sur la croissance, les cellules de LMC résistantes au traitement sont devenues entièrement tributaires de STAT5A pour leur survie : la perte de STAT5A induit leur mort. Ces données confortent des travaux de la littérature qui ont identifié STAT5A - et non STAT5B - comme l’un des quatre gènes, avec les deux gènes codant les canaux transmembranaires ABCB1 et ABCC1 (qui favorisent le rejet de drogues hors de la cellule) et le gène codant le facteur RUNX3, dont l’expression corrèle avec l’acquisition de résistances secondaires au traitement par le Glivec [
3] (Figure 1).
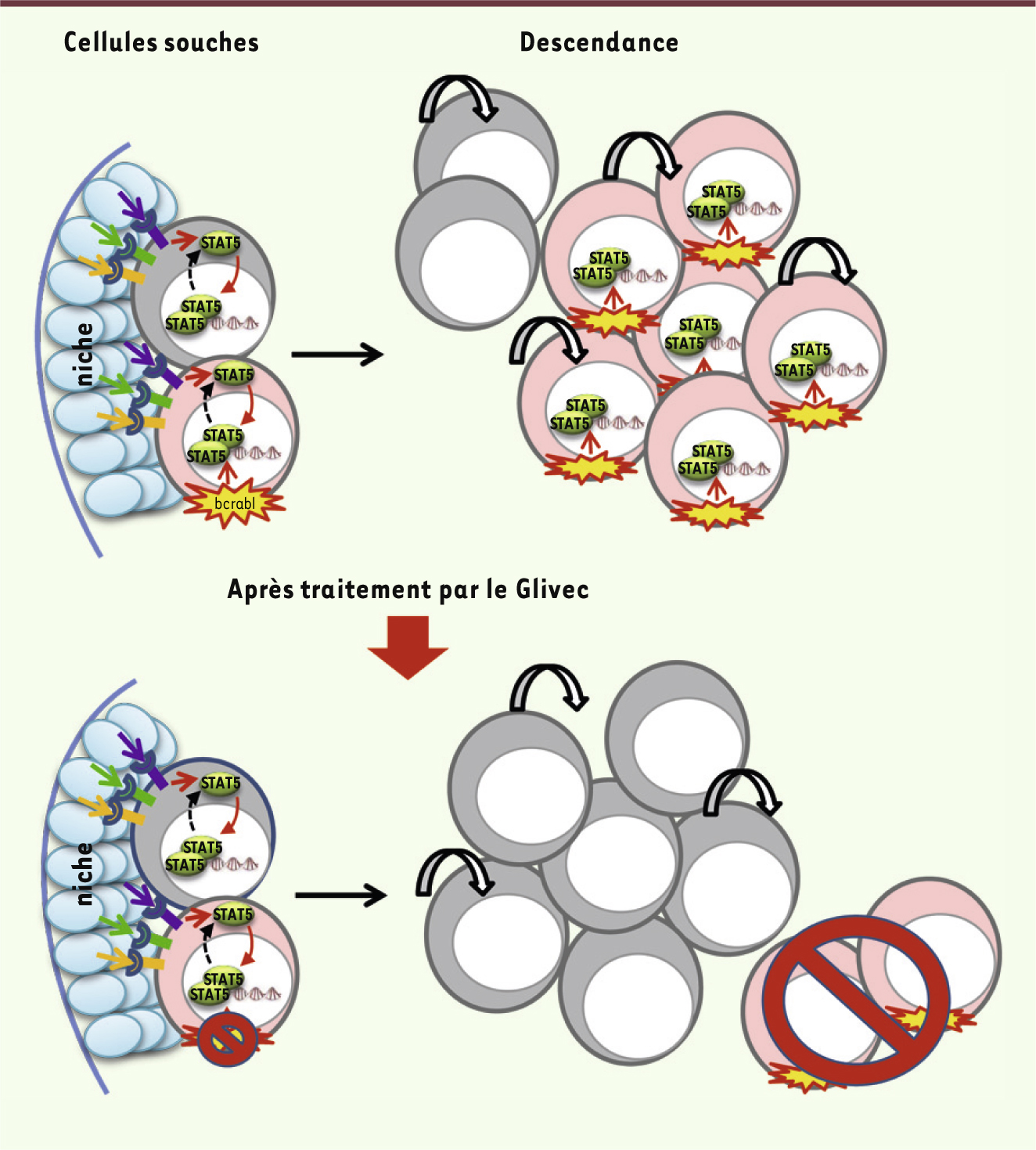
 | Figure 1.
Relation entre la niche hématopoïétique et l’activation de STAT5 dans la LMC. Le microenvironnement (niche) des cellules souches hématopoïétiques active STAT5 qui maintient ces cellules en vie et les protège de divers stress garantissant ainsi leur pérennité. En présence de traitement anti-BCRABL (Glivec), STAT5 n’est plus activée par BCRABL, ce qui conduit à la mort des cellules leucémiques. Seules les cellules souches leucémiques sont protégées par l’activité de STAT5 issue du microenvironnement avec lequel elles sont directement en contact, contrairement aux cellules plus matures. |
L’ensemble de ces données montrent que les facteurs STAT5, par leur double capacité à maintenir en vie les CSH saines ou leucémiques et leur faculté de les protéger contre différentes formes de stress cellulaire, pourraient constituer de nouvelles cibles thérapeutiques pour éradiquer les rares cellules souches leucémiques à l’origine de la maladie résiduelle et limiter le développement de résistances aux traitements anti-BCRABL [
4]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Yu
H
,
Jove
R
. The STATs of cancer: new molecular targets come of age . Nat Rev Cancer.
2004; ; 4 ::97.–105. 2.
Hennighausen
L
,
Robinson
GW
. Interpretation of cytokine signaling through the transcription factors STAT5A and STAT5B . Genes Dev.
2008; ; 22 : :711.–721. 3.
Zhang
WW
,
Cortes
JE
,
Yao
H
, et al.
Predictors of primary imatinib resistance in chronic myelogenous leukemia are distinct from those in secondary imatinib resistance . J Clin Oncol.
2009; ; 27 : :3642.–3649. 4.
Casetti
L
,
Martin-Lanneree
S
,
Najjar
I
, et al.
Differential contributions of STAT5A and STAT5B to stress protection and tyrosine kinase inhibitor resistance of chronic myeloid leukemia stem/progenitor cells . Cancer Res.
2013; ; 73 : :2052.–2058. |