| |
| Med Sci (Paris). 2013 August; 29(8-9): 729–735. Published online 2013 September 5. doi: 10.1051/medsci/2013298011.Le recrutement et l’activation d’adipocytes bruns et/ou BRITE
Une perspective réelle pour le traitement des maladies métaboliques ? Audrey Carrière,1 Yannick Jeanson,1 Béatrice Cousin,1 Emmanuelle Arnaud,1 and Louis Casteilla1* 1STROMALab, UMR5273 CNRS, université Paul Sabatier, établissement français du sang (EFS), Inserm U1031, CHU Rangueil, 1, avenue Jean Poulhès, 31403Toulouse Cedex, France |
Malgré leur propriété commune de stockage de l’énergie sous la forme de triglycérides, les tissus adipeux blanc et brun diffèrent par leur localisation anatomique, leur morphologie, leur fonction, ainsi que par leurs régulations moléculaires spécifiques (Tableau I). Alors que le tissu adipeux blanc, qui représente la principale réserve énergétique de l’organisme, libère cette énergie par le processus de lipolyse sous la forme d’acides gras libres (AGL), le tissu adipeux brun (TAB) possède la particularité de dissiper l’énergie sous forme de chaleur, par un processus appelé thermogenèse de non-frisson, par opposition à la thermogenèse de frisson assurée par le muscle. Cette thermogenèse de non-frisson est activée essentiellement par le système nerveux sympathique et permet de maintenir la température corporelle des mammifères lorsque ceux-ci sont exposés à des températures inférieures à la thermo-neutralité [
1]. La fonction thermogénique du TAB permet également de brûler l’excédent de calories dans des conditions de balance énergétique positive afin de maintenir l’homéostasie métabolique [1].
Tableau I.
| Caractéristiques |
Tissus adipeux blancs |
Tissus adipeux bruns |
|
Localisation
|
Profond
(mésentérique, périrénal, périgonadique, etc.) |
Sous-cutané
|
Interscapulaire, paravertébral, axilaire, perirénal, etc. |
|
Morphologie de l’adipocyte
|
Couleur du tissu |
Blanc, jaune, ivoire |
Brun |
| Forme |
Sphérique, ovale, polyhèdrique |
Polygonale |
| Taille |
25 – 200 µm (très variable) |
15 – 60 µm |
| Vésicules lipidiques |
Unique |
Multiple |
| Mitochondries |
Éparses |
Abondantes, rondes, avec de nombreuses crêtes parallèles |
|
|
Vascularisation
|
++ |
+++ |
|
|
Innervation
|
Système nerveux sympathique (++) et parasympathique (+) |
Système nerveux sympathique (+++) |
|
Expression génique
|
UCP1 |
− |
+/− |
+++ |
| PGC-1α |
+ |
+ |
+++ |
| Cidea |
− |
+/− |
+++ |
| Prdm16 |
− |
+/− |
+++ |
| DIO2 |
+ |
+ |
+++ |
| Aldh1a1 |
+++ |
++ |
+/− |
| Leptine |
+++ |
+++ |
− |
| Nrf2 |
++ |
+ |
++ |
| Tbx15 |
− |
++ |
+ |
Caractéristiques tissulaires, morphologiques, cellulaires et géniques des tissus adipeux blancs et bruns chez la souris. Les tissus blanc et brun peuvent se distinguer par leur localisation dans l’organisme, leur couleur, la morphologie des adipocytes ainsi que l’expression génique de certains marqueurs. Les niveaux d’expression génique relative ont été gradués de fort (+++) à absent (-). UCP1 : uncoupling protein 1 ; PGC-1α : peroxisome proliferator activated receptor gamma coactivator-1α ; Cidea : cell death-inducing DNA fragmentation factor, alpha subunit-like effector A ; Prdm16 : PR domain containing 16 ; DIO2 : deiodinase type 2 ; Aldhla : aldehyde dehydrogenase 1 membre 1A ; Nrf2 : nuclear receptor subfamily 2 ; Tbx15 : T-box 15. Cette liste n’est pas exhaustive ; pour des marqueurs additionnels voir [
5]. |
|
Adipocyte blanc, adipocyte brun : deux entités cellulaires distinctes Au sein de chacun des tissus adipeux, les adipocytes blancs et bruns matures diffèrent notamment par leur morphologie, la taille de leurs vésicules lipidiques ainsi que leur richesse en mitochondries (Tableau I). Les adipocytes bruns contiennent notamment un grand nombre de mitochondries, caractérisées par de nombreuses crêtes parallèles très développées, signant une activité respiratoire importante. L’expression spécifique dans les adipocytes bruns d’une protéine mitochondriale responsable de la production de chaleur, la protéine découplante UCP1 (uncoupling protein-1), représente une ultime signature phénotypique [
2,
3]. UCP1 découple le fonctionnement de la chaîne respiratoire de celui de l’ATP synthase, ce qui induit une augmentation des processus oxydatifs et une production de chaleur, aux dépens de la synthèse d’ATP (Figure 1). Cette activité découplante est inhibée par les nucléotides puriques di- et triphosphates, et activée par les AGL. La quantité de protéine UCP1 est contrôlée par des mécanismes transcriptionnels. Outre les hormones thyroïdiennes ou l’acide rétinoïque, le système nerveux sympathique, et en particulier les catécholamines, jouent un rôle activateur fondamental (Figure 1). La majorité des études se sont ainsi focalisées sur les processus oxydatifs des adipocytes bruns au détriment de ceux existant dans les adipocytes blancs, et ce bien que le potentiel oxydatif des mitochondries des adipocytes blancs soit loin d’être négligeable. Par ailleurs, si les adipocytes bruns sont métaboliquement plus actifs, ils sont présents en nombre bien plus faible que les adipocytes blancs. Ainsi, le potentiel oxydatif du tissu adipeux blanc est au moins équivalent à celui du TAB à l’échelle de l’organisme, au moins chez les rongeurs.
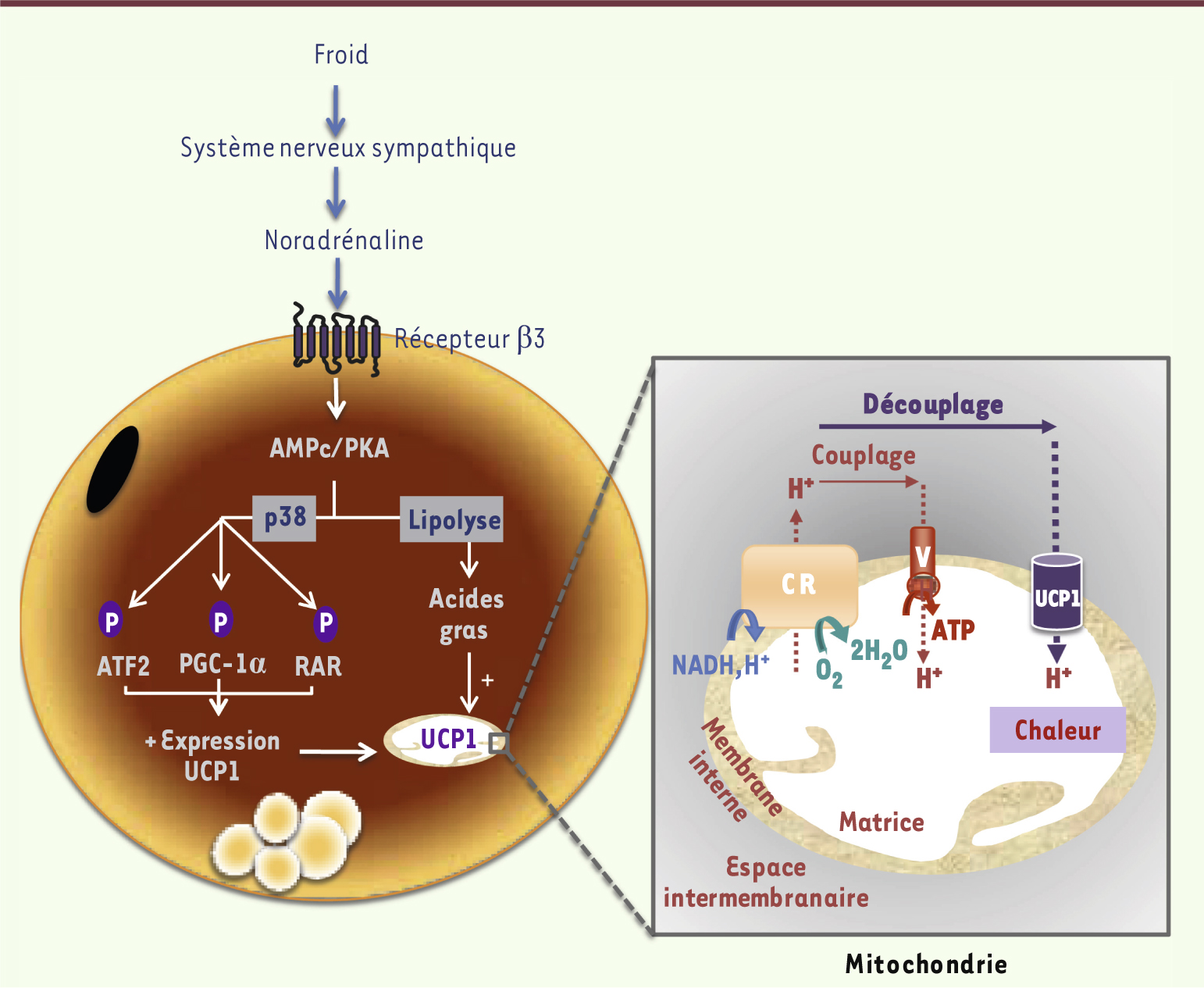
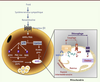 | Figure 1.
Régulation d’UCP1 par le système adrénergique dans les adipocytes bruns interscapulaires. Le système adrénergique, activé lors d’une exposition au froid, entraîne la libération de noradrénaline qui, en se fixant sur les récepteurs β3 adrénergiques, déclenche une augmentation des niveaux d’AMP cyclique (AMPc) et l’activation de la protéine kinase A (PKA). Celle-ci phosphoryle et active la protéine p38MAPK (p38, p38 mitogen activated protein kinase) qui contrôle l’expression d’UCP1 via la phosphorylation de transactivateurs d’UCP1, tels que ATF2 (activating transcription factor 2), PGC-lα (peroxisome proliferator activated receptor gamma coactivator- 1α) et RAR (retinoic acid response element). Par ailleurs, l’activation de la lipolyse par la PKA entraîne la libération d’acides gras qui sont non seulement des substrats pour l’oxydation, mais aussi des activateurs directs d’UCP1. UCP1 activée, en dissipant le gradient de protons existant de part et d’autre de la membrane interne mitochondriale, augmente fortement la capacité oxydative mitochondriale ce qui aboutit à la production de chaleur, aux dépens de la synthèse d’ATP. |
L’origine développementale des adipocytes blancs et bruns a fait l’objet de nombreuses études (pour revue voir [
4, 5]). Les adipocytes blancs auraient pour origine un précurseur présent dans la paroi vasculaire des capillaires, lui-même provenant d’un progéniteur mésodermique commun aux cellules endothéliales. Les adipocytes bruns du TAB, que l’on qualifiera de « classiques », dériveraient quant à eux de précurseurs myogéniques exprimant le facteur de transcription Myf5 (myogenic factor 5) [
6] et présents dans le dermomyotome (Figure 2). Cette origine développementale commune entre les cellules musculaires squelettiques et les adipocytes bruns est confortée par des études d’expression génique à grande échelle qui ont mis en évidence de fortes similitudes entre les deux types cellulaires [
7]. Le coactivateur transcriptionnel PRDM16 (PR domain containing 16) orienterait le devenir du précurseur commun en favorisant la différenciation en adipocyte brun tout en limitant celle en myoblaste [6].
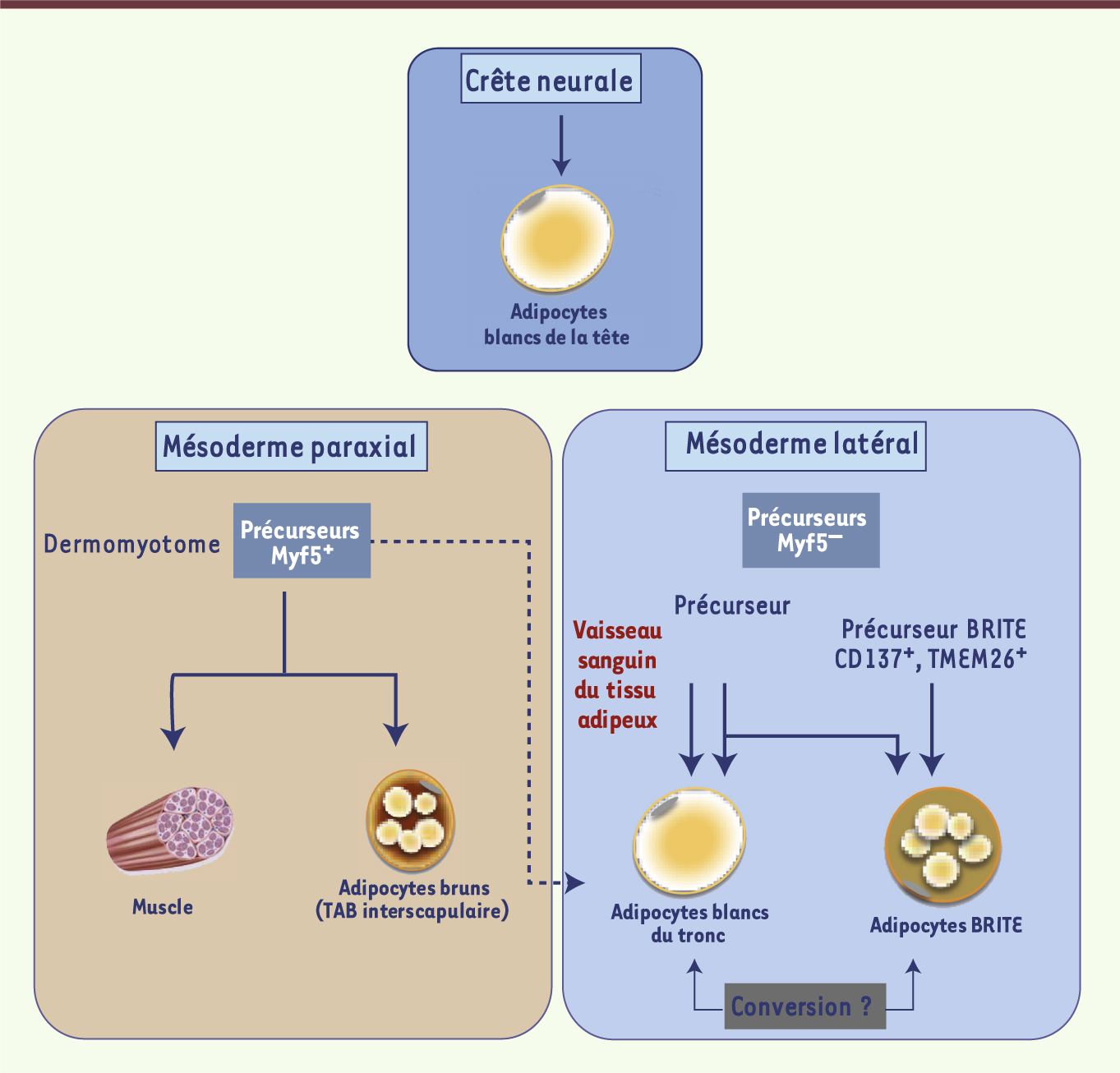
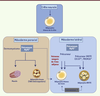 | Figure 2.
Origine développementale des différents adipocytes. Regroupement des différentes données et hypothèses quant aux origines développementales possibles des différents adipocytes, qu’ils soient blancs, bruns ou BRITE. Les adipocytes bruns classiques (présents dans le tissu adipeux interscapulaire) possèdent des origines communes avec les cellules musculaires squelettiques et proviennent d’un précurseur bipotent Myf5 +, contrairement aux adipocytes BRITE (présents dans les dépôts adipeux blancs) qui proviennent de précurseurs Myf5 −. Concernant les adipocytes blancs, on distingue au moins deux origines développementales différentes : la crête neurale pour les adipocytes de la tête, et le mésoderme latéral pour les adipocytes du tronc. Certaines cellules endothéliales présentes dans les capillaires des tissus adipeux seraient à l’origine des adipocytes blancs. Alors qu’il existerait un pool de progéniteurs spécifiques pour les adipocytes BRITE (TMEM26 +, CD137 +), certaines études ont montré l’existence de progéniteurs bipotents des adipocytes blancs et BRITE. Ce schéma est en perpétuelle évolution ; un article récent vient en effet de démontrer que certains adipocytes blancs dériveraient de progéniteurs Myf5 + [
31]. |
|
Plasticité des tissus adipeux : Le phénomène de browning et la découverte de l’adipocyte de troisième type, le BRITE On sait depuis plusieurs années qu’il existe, au sein même de certains dépôts adipeux blancs, quelques rares adipocytes multiloculaires, riches en mitochondries et qui expriment UCP1, leur nombre pouvant varier selon les conditions physiologiques, telles que l’exposition au froid [
8]. Cette transformation apparente, redécouverte aujourd’hui, a été désignée sous le terme de browning et ces adipocytes dénommés adipocytes BRITE (brown-in-white) ou beiges chez le rongeur. Ce phénomène de browning suscite une grande confusion, en partie parce que de nombreux expérimentateurs ne distinguent pas, et ne cherchent pas à distinguer, adipocytes bruns classiques et adipocytes BRITE, malgré les travaux du groupe de B. Spiegelman. Selon ce dernier, les adipocytes BRITE constitueraient une population cellulaire à part entière, ce que confirme leur signature moléculaire distincte de celle des adipocytes bruns classiques [
9]. Par ailleurs, contrairement aux adipocytes bruns classiques, ils ne dériveraient pas de précurseurs myogéniques. L’apparition de ces adipocytes BRITE dépend en partie du recrutement de précurseurs. Certains marqueurs identifieraient spécifiquement des progéniteurs BRITE, comme CD137 et la protéine transmembranaire TMEM26 (transmembrane protein 26), ce qui a permis de proposer l’existence de populations distinctes de progéniteurs pour les adipocytes BRITE et blancs [9]. Cependant, d’autres études ont démontré l’existence de populations communes aux adipocytes blancs et bruns/BRITE [
10,
11] (Figure 2). Quelle que soit l’origine des précurseurs, moins de 25 % des adipocytes BRITE qui émergent dans le tissu adipeux blanc seraient issus de ces précurseurs [11]. Il existerait donc des mécanismes alternatifs expliquant leur genèse, dont des mécanismes de conversion cellulaire [
12]. En effet, l’augmentation du nombre d’adipocytes BRITE serait associée à une baisse du nombre d’adipocytes blancs, le nombre total d’adipocytes restant inchangé. Le même type d’argument avait été utilisé pour expliquer la transformation apparente du TAB en tissu adipeux blanc après la naissance chez les ruminants [
13]. Cette hypothèse serait en accord avec les travaux de Cinti et al. selon lesquels les adipocytes BRITE présentent une morphologie et des profils mitochondriaux intermédiaires entre ceux des adipocytes blancs et bruns classiques [12]. Malgré ces données, la question d’une véritable conversion d’adipocytes blancs en adipocytes BRITE reste encore ouverte, notamment en raison du manque d’outils disponibles pour identifier et distinguer les différents types d’adipocytes. De plus, quelles que soient les stimulations « brunissantes », de nombreux adipocytes blancs subsistent en proportion variable selon les dépôts, ce qui indiquerait la présence d’adipocytes blancs réfractaires à tout changement phénotypique, et ce quelle que soit l’espèce. Afin de clarifier ce débat, il apparaît donc indispensable de mieux caractériser ces différents types cellulaires y compris les adipocytes blancs dont le phénotype est souvent identifié par défaut (absence d’expression d’UCP1, faible expression des marqueurs d’adipocytes bruns, etc.). Cette plasticité phénotypique tissulaire importante pourrait être un facteur d’adaptation aux conditions physiologiques ou pathologiques. La détermination des mécanismes moléculaires qui contrôlent l’apparition des adipocytes BRITE est donc fondamentale et très étudiée (pour revue voir [
14]). La
Figure 3
regroupe les différents acteurs endogènes et pharmacologiques impliqués à l’heure actuelle dans le contrôle du processus de browning. Outre l’exposition au froid qui est l’inducteur physiologique le mieux décrit des adipocytes BRITE, il semble que d’autres conditions physiologiques, telles que l’exercice physique, puissent induire un phénomène de browning via la sécrétion d’une hormone, l’irisin [
15]. Il y a cependant une certaine contradiction entre cette activation inattendue et le déficit énergétique associé à l’exercice. Il est possible que l’adipocyte BRITE puisse être activé et/ou recruté de manière adaptative, et que sa fonction de découplage participe avant tout à une amélioration du statut métabolique.
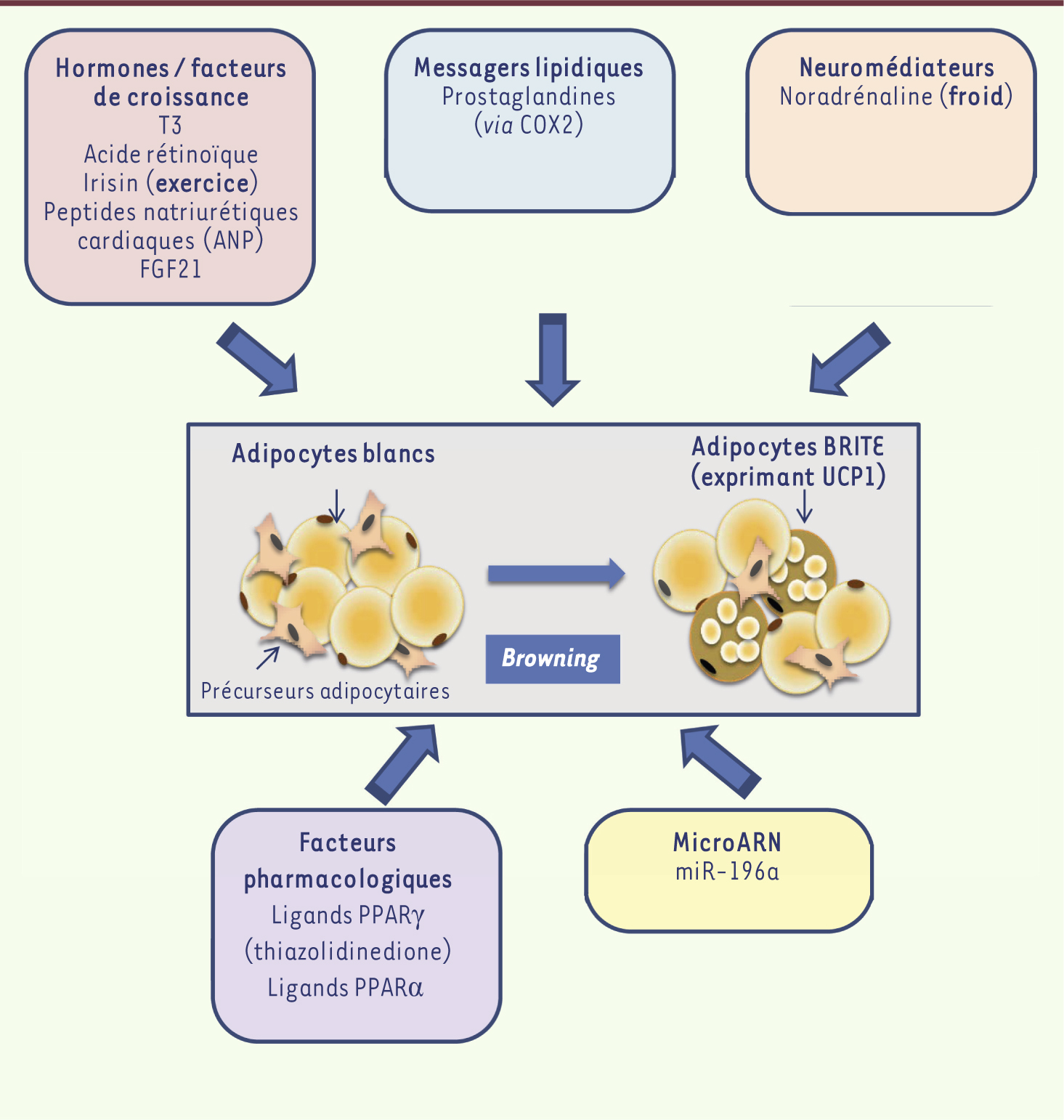
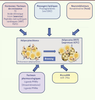 | Figure 3.
Facteurs impliqués dans l’induction du browning du tissu adipeux blanc. Le browning du tissu adipeux blanc chez la souris correspond à l’apparition d’adipocytes multiloculaires exprimant UCP1 au sein des dépôts blancs. L’apparition de ces adipocytes BRITE, qui est le résultat, soit d’un recrutement de précurseurs, soit de phénomènes de conversion cellulaire, peut être contrôlée par différents facteurs endogènes à l’organisme (neuromédiateurs, hormones, facteurs de croissance, messagers lipidiques et microARN) ou pharmacologiques. COX2 : cyclooxygénase 2 ; FGF21 : fibroblast growth factor 2 ; PPARγ : peroxisome proliferator-activated receptor γ ; PPARα : peroxisome proliferator-activated receptor α ; T3 : triiodothyronine (adapté de [ 14]). |
|
Tissu adipeux brun chez l’homme On a longtemps considéré que le TAB était présent chez l’homme uniquement chez le fœtus et le nouveau-né, et qu’il disparaissait dans les premières années de la vie. Chez l’adulte, ce tissu n’avait été identifié que chez des patients atteints de phéochromocytome (tumeur des glandes surrénales) ou chez des travailleurs exposés à des conditions de froid extrême [
16]. Très récemment, des techniques d’imagerie reposant sur l’utilisation d’un analogue du glucose marqué détecté par PET/CT-scan (positron emission tomography-computed tomography), associées à l’identification d’UCP1, ont révélé la présence de dépôts de TAB métaboliquement actifs chez l’adulte [
17]. La masse totale de ces dépôts pourrait atteindre 100 à 200 grammes [
18], ce qui représenterait jusqu’à 40 % du métabolisme de base si ces adipocytes bruns étaient pleinement fonctionnels. La quantité de TAB serait inversement proportionnelle à l’indice de masse corporelle [
19]. Une étude récente démontre que la signature génique des cellules de ces dépôts est comparable à celle des adipocytes BRITE murins plutôt qu’à celle des adipocytes bruns [9]. Il ne s’agirait donc pas de TAB « classique », ce qui pourrait suggérer des mécanismes d’activation particuliers (pouvant expliquer l’échec des stratégies d’activation β3-adrénergique chez l’homme). De plus, aucune étude fonctionnelle mesurant par exemple l’oxydation des substrats ou la dissipation d’énergie sous forme de chaleur de ce TAB particulier n’a été publiée à ce jour. Enfin, une population importante de progéniteurs adipocytaires bruns existerait dans le tissu musculaire, y compris chez l’homme adulte [
20], la taille de cette population variant selon les conditions physiopathologiques [
21]. L’ensemble de ces découvertes a induit un changement radical dans la vision du TAB et de son rôle chez l’homme. Ces résultats ont relancé nombre d’études visant à valider l’hypothèse, déjà énoncée dans le passé, selon laquelle l’activation du TAB permettrait de lutter contre le surpoids et l’obésité, ainsi que les maladies métaboliques associées [
22]. |
Adipocytes bruns/BRITE et maladies métaboliques Augmenter la dépense énergétique a depuis toujours été considéré comme une stratégie de choix pour traiter les maladies métaboliques. La nécessité de cibler spécifiquement les adipocytes bruns et d’activer leur recrutement a donné lieu à pléthore d’études, bien que ces stratégies puissent être toujours controversées. En effet, les adipocytes bruns activés constituent des sites majeurs d’utilisation et d’oxydation du glucose et des AGL, contrôlent la clairance des triglycérides [
23], et leur sensibilité à l’insuline serait 50 fois supérieure à celle des adipocytes blancs, au moins chez les rongeurs. Des souris dont le TAB est dépourvu de récepteur de l’insuline (invalidation génétique) développent d’ailleurs un diabète [
24]. Par ailleurs, l’inactivation de la fonction thermogénique du TAB chez la souris favorise bien l’apparition d’une obésité et d’un diabète [
25,
26], tandis que la transplantation de TAB permet de corriger les anomalies métaboliques liées au diabète [
27,
28]. Cet effet favorable du TAB serait aussi dû à son activité paracrine et notamment sa capacité à produire du FGF21 (fibroblast growth factor 21), un facteur de croissance qui contrôle fortement l’homéostasie glucidique et la sensibilité à l’insuline [
29], et à l’IL-6 [28]. De plus, l’observation, dans le muscle de souris résistantes à l’obésité, d’adipocytes exprimant UCP1 indique que des adipocytes bruns ectopiques pourraient jouer un rôle important dans le contrôle de l’homéostasie métabolique à l’échelle de l’organisme [
30]. Chez l’homme adulte, l’activation métabolique ou le recrutement des adipocytes à fort potentiel oxydatif représente une perspective thérapeutique qui suscite un regain d’intérêt certain depuis quelques années [22]. Il sera toutefois nécessaire de préciser à la fois la fonctionnalité de ces cellules selon leur localisation et les mécanismes cellulaires ou moléculaires qui pourraient leur être spécifiques avant de pouvoir envisager de les activer. |
L’ensemble des résultats récents, en particulier ceux concernant le lignage cellulaire, l’identification d’adipocytes de type brun chez l’homme, ainsi que la relecture de résultats anciens illustrent la complexité d’un panorama incomplètement décrit et compris. Ceci révèle le manque patent d’outils et/ou la nécessité d’une caractérisation plus fine, y compris fonctionnelle, des différents types adipocytaires. On peut penser que cette identification ouvrira des perspectives de stratégies thérapeutiques ciblées qui pourraient alors démontrer leur efficacité. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Himms-Hagen
J
. Brown adipose tissue thermogenesis : interdisciplinary studies . FASEB J.
1990; ; 4 : :2890.–2898. 2.
Nicholls
DG
,
Locke
RM
. Thermogenic mechanisms in brown fat . Physiol Rev.
1984; ; 64 : :1.–64. 3.
Ricquier
D.
Uncoupling protein 1 of brown adipocytes, the only uncoupler : a historical perspective . Front Endocrinol (Lausanne).
2011; ; 2 : :85.. 4.
Bouloumié
A
,
Sengenes
C
,
Galitzky
J
. Les progéniteurs adipeux blancs et bruns : pourra-t-on transformer la fourmi en cigale ?
Med Sci (Paris).
2009; ; 25 : :123.–125. 5.
Billon
N
,
Dani
C
. Developmental origins of the adipocyte lineage : new insights from genetics and genomics studies . Stem Cell Rev.
2012; ; 8 : :55.–66. 6.
Seale
P
,
Bjork
B
,
Yang
W
, et al.
PRDM16 controls a brown fat/skeletal muscle switch . Nature.
2008; ; 454 : :961.–967. 7.
Timmons
JA
,
Wennmalm
K
,
Larsson
O
, et al.
Myogenic gene expression signature establishes that brown and white adipocytes originate from distinct cell lineages . Proc Natl Acad Sci USA.
2007; ; 104 : :4401.–4406. 8.
Cousin
B
,
Cinti
S
,
Morroni
M
, et al.
Occurrence of brown adipocytes in rat white adipose tissue : molecular and morphological characterization . J Cell Sci.
1992; ; 103 : :931.–942. 9.
Wu
J
,
Boström
P
,
Sparks
LM
, et al.
Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human . Cell.
2012; ; 150 : :366.–376. 10.
Tran
KV
,
Gealekman
O
,
Frontini
A
, et al.
The vascular endothelium of the adipose tissue gives rise to both white and brown fat cells . Cell Metab.
2012; ; 15 : :222.–229. 11.
Lee
YH
,
Petkova
AP
,
Mottillo
EP
,
Granneman
JG
. In vivo identification of bipotential adipocyte progenitors recruited by beta3-adrenoceptor activation and high-fat feeding . Cell Metab.
2012; ; 15 : :480.–491. 12.
Smorlesi
A
,
Frontini
A
,
Giordano
A
,
Cinti
S.
, The adipose organ : white-brown adipocyte plasticity, metabolic inflammation . Obes Rev.
2012; ; 13 : (suppl 2)
:83.–96. 13.
Casteilla
L
,
Champigny
O
,
Bouillaud
F
, et al.
Sequential changes in the expression of mitochondrial protein mRNA during the development of brown adipose tissue in bovine and ovine species. Sudden occurrence of uncoupling protein mRNA during embryogenesis and its disappearance after birth . Biochem J.
1989; ; 257 : :665.–671. 14.
Bonet
ML
,
Oliver
P
,
Palou
A
. Pharmacological and nutritional agents promoting browning of white adipose tissue . Biochim Biophys Acta.
2013; ; 1831 : :969.–985. 15.
Boström
P
,
Wu
J
,
Jedrychowski
MP
, et al.
A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis . Nature.
2012; ; 481 : :463.–468. 16.
Bouillaud
F
,
Villarroya
F
,
Hentz
E
, et al.
Detection of brown adipose tissue uncoupling protein mRNA in adult patients by a human genomic probe . Clin Sci (Lond).
1988; ; 75 : :21.–27. 17.
Nedergaard
J
,
Bengtsson
T
,
Cannon
B
. Unexpected evidence for active brown adipose tissue in adult humans . Am J Physiol Endocrinol Metab.
2007; ; 293 : :E444.–E452. 18.
Ouellet
V
,
Labbé
SM
,
Blondin
DP
, et al.
Brown adipose tissue oxidative metabolism contributes to energy expenditure during acute cold exposure in humans . J Clin Invest.
2012; ; 122 : :545.–552. 19.
Van Marken Lichtenbelt
WD
,
Vanhommerig
JW
,
Smulders
NM
, et al.
Cold-activated brown adipose tissue in healthy men . N Engl J Med.
2009; ; 360 : :1500.–1508. 20.
Crisan
M
,
Casteilla
L
,
Lehr
L
, et al.
A reservoir of brown adipocyte progenitors in human skeletal muscle . Stem Cells.
2008; ; 26 : :2425.–2433. 21.
Russell
AP
,
Crisan
M
,
Léger
B
, et al.
Brown adipocyte progenitor population is modified in obese and diabetic skeletal muscle . Int J Obes (Lond).
2012; ; 36 : :155.–158. 22.
Boss
O
,
Farmer
SR.
, Recruitment of brown adipose tissue as a therapy for obesity-associated diseases . Front Endocrinol (Lausanne).
2012; ; 3 : :14.. 23.
0
Bartelt
A
,
Bruns
OT
,
Reimer
R
, et al.
Brown adipose tissue activity controls triglyceride clearance . Nat Med.
2011; ; 17 : :200.–205. 24.
Guerra
C
,
Navarro
P
,
Valverde
AM
, et al.
Brown adipose tissue-specific insulin receptor knockout shows diabetic phenotype without insulin resistance . J Clin Invest.
2001; ; 108 : :1205.–1213. 25.
Lowell
BB
,
S-Susulic
V
,
Hamann
A
, et al.
Development of obesity in transgenic mice after genetic ablation of brown adipose tissue . Nature.
1993; ; 366 : :740.–742. 26.
Feldmann
HM
,
Golozoubova
V
,
Cannon
B
,
Nedergaard
J
. UCP1 ablation induces obesity and abolishes diet-induced thermogenesis in mice exempt from thermal stress by living at thermoneutrality . Cell Metab.
2009; ; 9 : :203.–209. 27.
Gunawardana
SC
,
Piston
DW
. Reversal of type 1 diabetes in mice by brown adipose tissue transplant . Diabetes.
2012; ; 61 : :674.–682. 28.
Stanford
KI
,
Middelbeek
RJ
,
Townsend
KL
, et al.
Brown adipose tissue regulates glucose homeostasis and insulin sensitivity . J Clin Invest.
2013; ; 123 : :215.–223. 29.
Seo
JA
Kim
NH
. Fibroblast growth factor 21 : a novel metabolic regulator . Diabetes Metab J.
2012; ; 36 : :26.–28. 30.
Almind
K
,
Manieri
M
,
Sivitz
WI
, et al.
Ectopic brown adipose tissue in muscle provides a mechanism for differences in risk of metabolic syndrome in mice . Proc Natl Acad Sci USA.
2007; ; 104 : :2366.–2371. 31.
J
Sanchez-Gurmaches
,
CM
Hung
,
CA
Sparks
, et al.
PTEN loss in the Myf5 lineage redistributes body fat and reveals subsets of white adipocytes that arise from Myf5 precursors . Cell Metab.
2012; ; 16 : :348.–362. |