| |
| Med Sci (Paris). 2013 August; 29(8-9): 756–764. Published online 2013 September 5. doi: 10.1051/medsci/2013298015.Le stress du réticulum endoplasmique : de la physiologie à la pathogenèse du diabète de type 2
Mélissa Flamment 1,2* and Fabienne Foufelle 1,2 1Inserm, UMR-S 872, centre de recherches des Cordeliers, Paris, France 2Université Paris 6 Pierre et Marie Curie, UMR-S 872, Paris, France |
Le diabète est devenu un problème majeur de santé publique dans les pays industrialisés, mais également dans les pays en émergence. Ainsi, 285 millions de personnes sont atteintes de diabète au niveau mondial ; en France, leur nombre est estimé à 3 millions soit plus de 4 % de la population générale [
48] (→). Il existe deux grands types de diabète. Le diabète de type 1, qui représente environ 10 % des diabètes, se caractérise par un déficit de sécrétion d’insuline dû à une destruction auto-immune des cellules β sécrétrices d’insuline. Le diabète de type 2, qui est le plus fréquent, est souvent associé à un surpoids et à d’autres facteurs de risque comme l’hypertension et la dyslipidémie.
(→) Voir l’article de C. Franc, page 711 de ce numéro
Les diabétiques de type 2 présentent deux anomalies métaboliques majeures : un déficit de sécrétion d’insuline et une résistance à l’insuline hépatique et périphérique (tissu adipeux et muscles). L’évolution finale vers l’hyperglycémie résulte d’une incapacité des cellules β à produire suffisamment d’insuline pour compenser la résistance à l’insuline. Plusieurs hypothèses ont été évoquées pour expliquer la pathogenèse du diabète de type 2 comme le stress oxydant, la lipotoxicité, la glucotoxicité ou encore, plus récemment, l’inflammation. Tous ces mécanismes ont pour conséquence l’activation d’une voie cellulaire appelée stress du réticulum endoplasmique (RE). Ces dernières années, une littérature abondante a permis de démontrer le rôle majeur du stress du RE dans l’altération de la fonction pancréatique et de la sensibilité du stress du RE à l’insuline (Figure 1). Le but de cette revue, que nous avons focalisée sur le diabète de type 2, est de montrer à travers les exemples les plus démonstratifs comment le stress du réticulum endoplasmique pourrait participer à la pathogenèse de ce diabète.
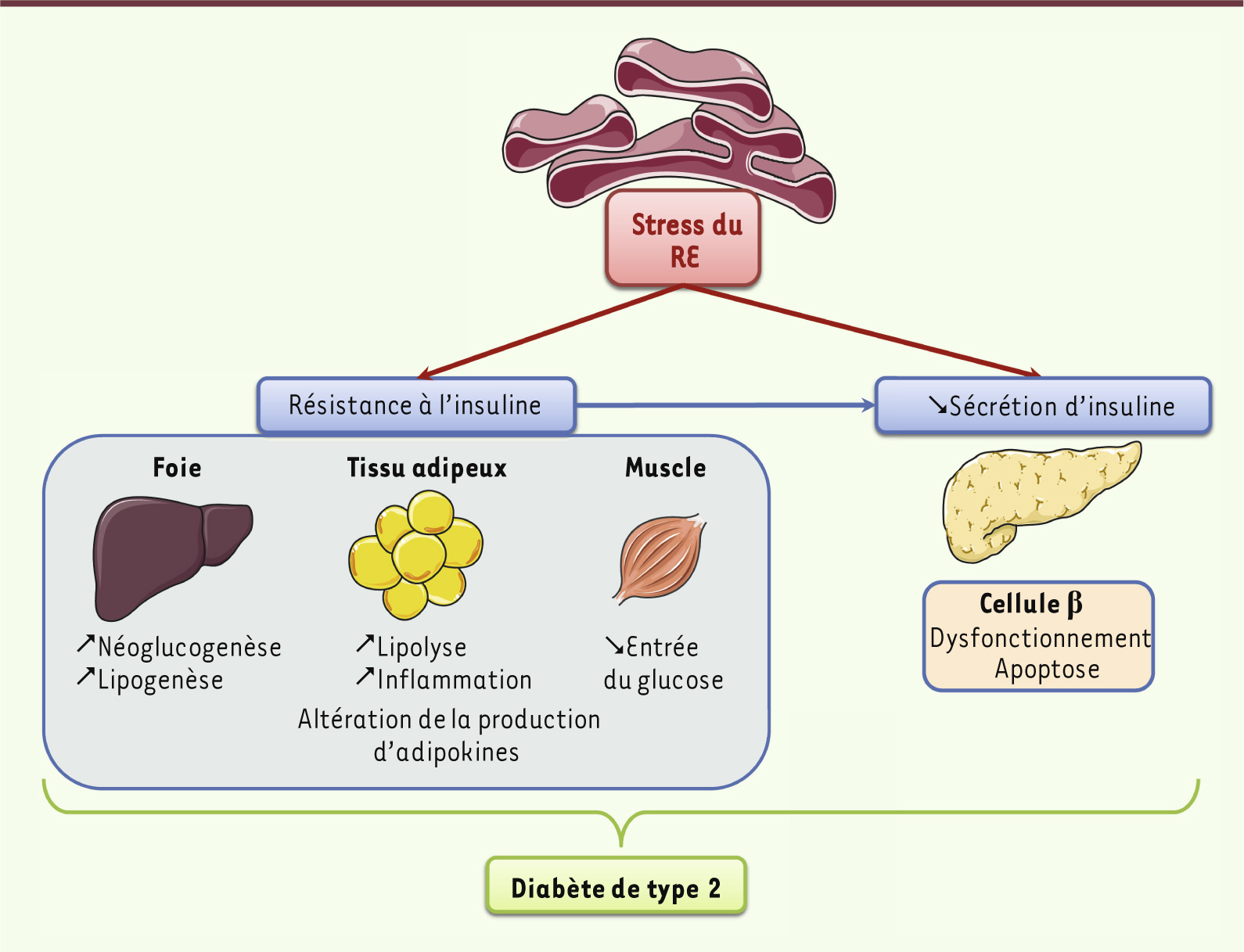
 | Figure 1.
Stress du RE et diabète de type 2. Dans les conditions d’obésité, le développement d’un stress du RE dans les tissus sensibles à l’insuline participe fortement à l’apparition de la résistance à l’insuline. Ceci aura pour conséquence une augmentation de la lipolyse et de la production de cytokines pro-inflammatoires au niveau adipocytaire, une diminution de l’entrée du glucose dans le muscle et une augmentation de la néoglucogenèse hépatique. Paradoxalement, le stress du RE et la résistance hépatique à l’insuline sont associés à une augmentation de la lipogenèse. Le stress du RE contribue également au dysfonctionnement et à l’apoptose des cellules β pancréatiques. Le stress du RE contribue ainsi au développement du diabète de type 2. |
|
Réticulum endoplasmique, stress du réticulum endoplasmique et réponse UPR Le RE est le siège de nombreuses fonctions cruciales au maintien de l’homéostasie cellulaire. Parmi ces fonctions, on peut citer le stockage du Ca2+ intracellulaire, la synthèse des macromolécules lipidiques, telles que les triglycérides, le cholestérol ou les phospholipides, ou encore la synthèse des protéines sécrétées ou membranaires. Ces protéines sont orientées au cours de leur traduction vers la lumière du RE, où elles vont subir des modifications post-traductionnelles (N-glycosylation, ajout de pont disulfures, oligomérisation, etc.) qui sont nécessaires à l’acquisition de leur structure et de leur fonction. Toute modification physiologique ou physiopathologique qui conduit à une altération des fonctions du RE (modification de l’homéostasie calcique, accumulation de lipides ou de protéines, etc.) est ressentie par ce dernier comme un stress qui entraîne l’apparition d’une réponse cellulaire appelée UPR (unfolding protein response) qui vise à en rétablir l’homéostasie [
1-
3]. Chez les mammifères, les médiateurs proximaux de la voie UPR sont les protéines PERK (PKR-like ER kinase), ATF6 (activating transcription factor 6) et IRE1 (inositol-requiring enzyme 1). Ces protéines sont des protéines transmembranaires du RE et sont maintenues dans un état inactif par la liaison de la protéine chaperone BiP (binding immunoglobulin protein) à leur domaine luminal. Lors d’un stress du RE, la protéine BiP se dissocie de ces protéines effectrices, entraînant leur activation. La dissociation de BiP conduit à l’homodimérisation et à l’autophosphorylation des kinases PERK et IRE1. Une fois activée, PERK phosphoryle le facteur d’initiation de la traduction eiF2α (eukaryotic translation initiation factor 2, subunit α) conduisant à une inhibition globale de la synthèse protéique qui diminue l’influx de protéines vers le RE. Paradoxalement, la traduction de certains ARNm possédant une structure particulière dans leur région 5’ non traduite est augmentée. C’est le cas, par exemple, du facteur de transcription ATF4 (activating transcription factor 4) qui joue un rôle important dans l’activation des gènes impliqués dans le métabolisme des acides aminés, l’autophagie, la réponse anti-oxydante et l’apoptose. L’activation par autophosphorylation de IRE1 permet de révéler son activité endoribonucléasique dont l’action la plus connue est l’épissage de l’ARNm du facteur de transcription XBP1 (X box-binding protein 1). L’activité endonucléase d’IRE1 permet également une dégradation de certains ARNm par un mécanisme appelé RIDD (regulated-IRE1 dependent decay). Le dernier acteur de la voie UPR est le facteur de transcription ATF6 qui est activé par clivage protéolytique d’une forme précurseur ancrée dans le RE. XBP1, ATF6 et ATF4 vont assurer la réponse transcriptionnelle de la voie UPR en activant une pléiade de gènes codant pour des protéines (chaperones, foldases) qui vont restaurer l’homéostasie du RE en aidant à la maturation des protéines. Ces facteurs vont également permettre la mise en place de l’ERAD (ER associated degradation) et de l’autophagie, deux voies cellulaires qui permettent de diminuer la charge protéique en dégradant les protéines incorrectement repliées. Enfin, si tous ces mécanismes ne parviennent pas à rétablir l’homéostasie du RE, la voie UPR va induire l’apoptose. Ce processus d'apoptose fait intervenir notamment l’activation de la protéine pro-apoptotique CHOP (C/EBP homologous protein) par la voie PERK ou l’activation de la kinase JNK (c-Jun N-terminal kinase) par la voie IRE1 (Figure 2).
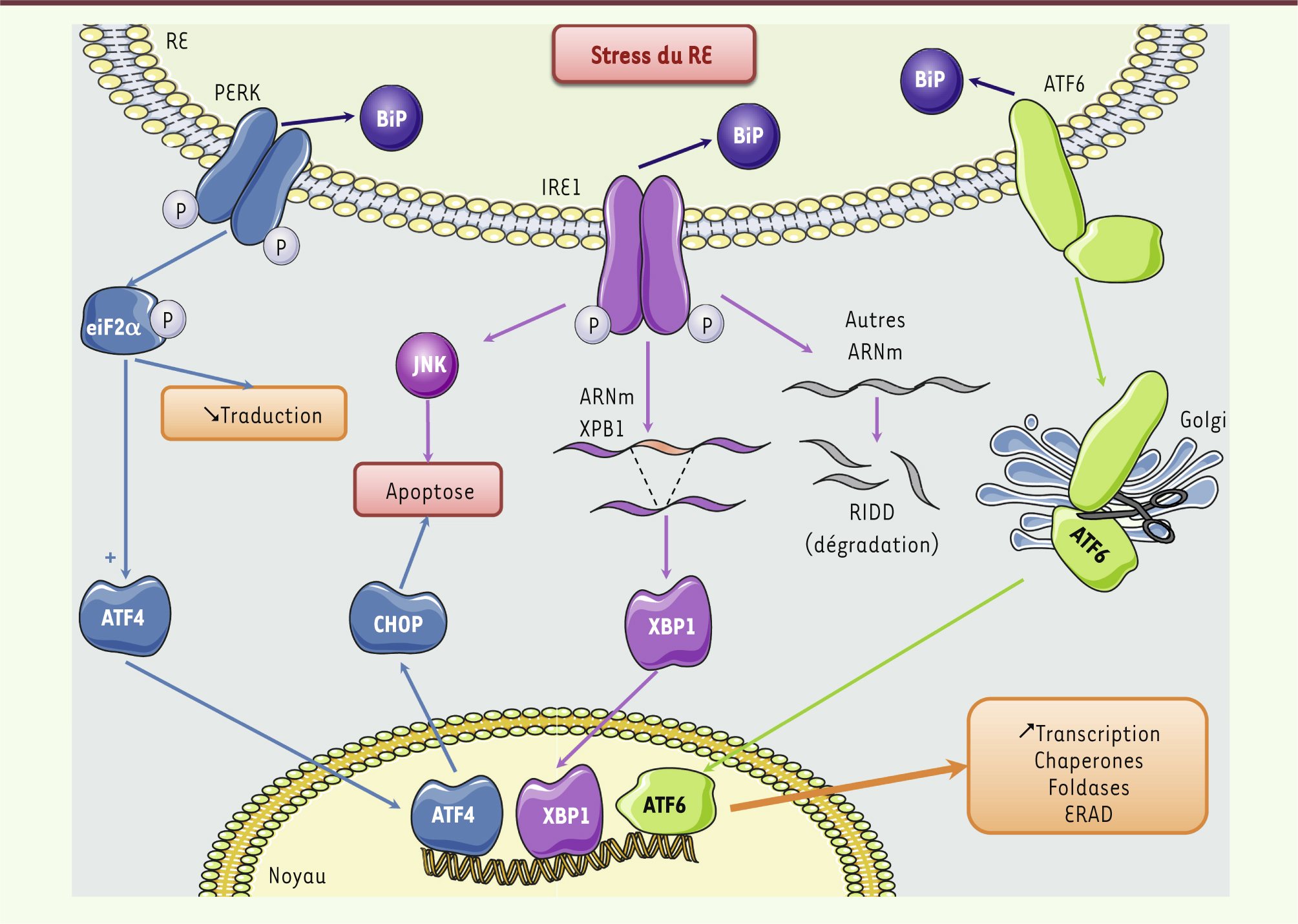
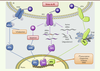 | Figure 2.
La voie UPR. Des perturbations de l’homéostasie du RE entraînent la mise en place d’une réponse UPR qui conduira à l’activation des trois protéines effectrices de cette voie : PERK (PKR-like ER kinase), ATF6 (activating transcription factor 6) et IRE1 (inositol-requiring enzyme 1), après dissociation de la protéine chaperone BiP. PERK, après homodimérisation et autophosphorylation, phosphoryle eiF2α (eukaryotic translation initiation factor 2, subunit α), conduisant à une inhibition globale de la traduction. Paradoxalement, la phosphorylation d’eiF2α s’accompagne d’une augmentation de la traduction du facteur de transcription ATF4 (activating transcription factor 4). L’activation par autophosphorylation de IRE1 permet de révéler son activité endoribonucléase dont l’action principale est l’épissage de l’ARNm du facteur de transcription XBP1 (X box-binding protein 1). L’activité endonucléase d’IRE1 permet également une dégradation de certains ARNm afin de diminuer leur traduction par un mécanisme appelé RIDD (regulated-IRE1 dependent decay). Le facteur de transcription ATF6 est activé par clivage protéolytique d’une forme précurseur ancrée dans le RE. ATF4, XBP1 et ATF6 vont contribuer de manière coordonnée à l’augmentation de la transcription de protéines impliquées dans la maturation des protéines. Enfin, si l’ensemble de ces mécanismes ne parviennent pas à rétablir l’homéostasie du RE, la voie UPR induit l’apoptose, entre autres par l’activation de la protéine pro-apoptotique CHOP (C/EBP homologous protein) par la voie PERK ou l’activation de la kinase JNK par la voie IRE1. |
L’accumulation de protéines dans la lumière du RE étant un élément majeur dans l’activation du stress du RE, la voie UPR va jouer un rôle très important dans les cellules à forte activité sécrétoire. Ceci est particulièrement vrai pour la cellule β pancréatique et les hépatocytes, mais aussi les adipocytes, qui sont capables de synthétiser des quantités importantes de protéines de nature diverse. La réponse UPR qui se met en place dans ces tissus doit avant tout être considérée comme une réponse physiologique destinée à faire face à une demande cellulaire ponctuelle impliquant le RE. Ceci permet d’éviter l’agrégation des protéines au niveau de la lumière du RE, qui serait fatale à la cellule. Cependant, si le stress du RE persiste et n’est pas résolu par la voie UPR, la réponse UPR est alors perçue comme pathologique, puisqu’elle conduira à terme à la mort de la cellule. La décision de vie ou de mort pour la cellule dépend de la nature, de la sévérité et de la durée du stress auquel elle est exposée. Si le stress peut être résolu, l’UPR entraînera la cellule vers la survie. Au contraire, en cas de stress sévère, l’UPR activera les effecteurs de mort et conduira la cellule vers l’apoptose. Ce double rôle de la réponse UPR est traduit par les trois effecteurs PERK, IRE1 et ATF6 qui, selon les conditions, induisent la survie et l’adaptation ou, au contraire, la mort de la cellule [
4]. |
Stress du RE et réponse UPR dans la cellule β pancréatique La cellule β pancréatique est continuellement exposée à des conditions qui perturbent l’homéostasie de son RE. En effet, en réponse aux variations de glycémie, cette cellule est capable d’augmenter rapidement et fortement sa sécrétion d’insuline. Ceci est d’autant plus vrai dans des conditions d’obésité où elle doit produire suffisamment d’insuline pour compenser la résistance à l’insuline des tissus périphériques. L’insuline, qui représente à elle seule près de 50 % des protéines sécrétées par la cellule β, génère au niveau de la lumière du RE une charge en protéines qui entraîne la mise en place d’une réponse UPR [
5]. Le rôle physiologique de l’UPR prend alors tout son sens dans cette cellule qui est capable de sécréter un million de molécules d’insuline par minute lors d’un stimulus glucidique. La branche PERK/eiF2α de l’UPR joue un rôle majeur dans cette activité puisqu’elle permet de ralentir la synthèse protéique et d’éviter l’engorgement du RE par les protéines en cours de maturation. Ce rôle crucial est illustré par le phénotype des animaux invalidés de manière globale pour PERK, ou surexprimant une forme non phosphorylable d’eiF2α, qui développent un diabète néonatal très sévère suite à un stress du RE puissant et non résolu, ayant pour conséquence l’apoptose des cellules β [
6,
7]. Chez l’homme, des mutations pertes de fonction de PERK sont à l’origine du syndrome de Wolcott-Rallison qui conduit au développement d’un diabète néonatal, conséquence d’une mort des cellules β [
8]. Les souris diabétiques Akita illustrent le rôle clé de l’accumulation de la pro-insuline dans le déclenchement du stress du RE. Chez ces souris, un des gènes codant pour l’insuline est muté, empêchant la formation d’un des deux ponts disulfures de cette hormone. Ceci conduit à une accumulation de pro-insuline mutée dans le RE et au déclenchement de la réponse UPR. Ce stress du RE est à l’origine de l’apoptose des cellules β et du développement d’un diabète chez ces souris. Des études génétiques ont révélé la présence de mutations similaires dans le gène de l’insuline humaine qui sont à l’origine d’une forme de diabète précoce nommée MIDY (mutant INS-gene-induced diabetes of the youth). Ces formes d’insuline mutantes exprimées in vitro induisent un stress du RE et une réponse UPR qui pourraient être à l’origine de l’apoptose des cellules β et de l’apparition du diabète [
9,
10]. La protéine PERK, qui est très exprimée dans les cellules β, joue donc un double rôle dans l’UPR : son activation régule négativement la biosynthèse d’insuline permettant de diminuer la charge protéique dans le RE et, par ce biais, protège la cellule β de l’apoptose. À l’inverse, l’activation soutenue de PERK conduit à l’activation des facteurs pro-apoptotiques, comme la protéine CHOP. Le rôle fondamental de CHOP dans l’apoptose des cellules β au cours du diabète de type 2 est étayé par de nombreuses études montrant que l’invalidation de CHOP permet de retarder l’apparition du diabète dans différents modèles animaux [
11]. De la même manière que PERK, le couple IRE1/XBP1 joue un rôle positif et négatif dans la survie de la cellule β. XBP1 permet d’augmenter la synthèse de protéines du RE, comme les chaperones qui vont aider au repliement des protéines, et d’induire la synthèse de composants de la machinerie ERAD. Parallèlement au clivage de l’ARNm d’XBP1, IRE1 est capable de dégrader par RIDD les ARNm associés au RE et, notamment, celui de l’insuline [
12], permettant ainsi de diminuer la charge protéique dans le RE. IRE1 peut également promouvoir la mort cellulaire principalement par deux mécanismes : l’activation de la JNK [
13] et l’activation de la caspase 12 [
14]. IRE1 et PERK activent également la protéine TXNIP (thioredoxin-interacting protein), qui joue un rôle majeur dans les phénomènes de glucotoxicité, de stress oxydant et d’inflammation conduisant à la mort de la cellule β [
15,
16]. |
Les facteurs responsables de l’activation d’un stress du RE dans la cellule β Glucose et glucotoxicité De nombreuses causes physiologiques ou environnementales contribuent à l’activation d’un stress du RE dans les cellules β (Figure 3). Le glucose, par exemple, est à l’origine d’un stress physiologique qui peut devenir pathologique s’il n’est pas résolu. Il a été montré que l’exposition aiguë ou chronique d’îlots pancréatiques à de fortes concentrations de glucose s’accompagne, aussi bien in vitro qu’ in vivo, d’une activation du stress RE et, particulièrement, de la voie IRE1/XBP1 [
17,
18]. Une élévation chronique de la glycémie (glucotoxicité) est également à l’origine d’un stress oxydant qui se manifeste par l’accumulation d’espèces réactives de l’oxygène (ROS), qui peuvent également induire un stress du RE [
19].
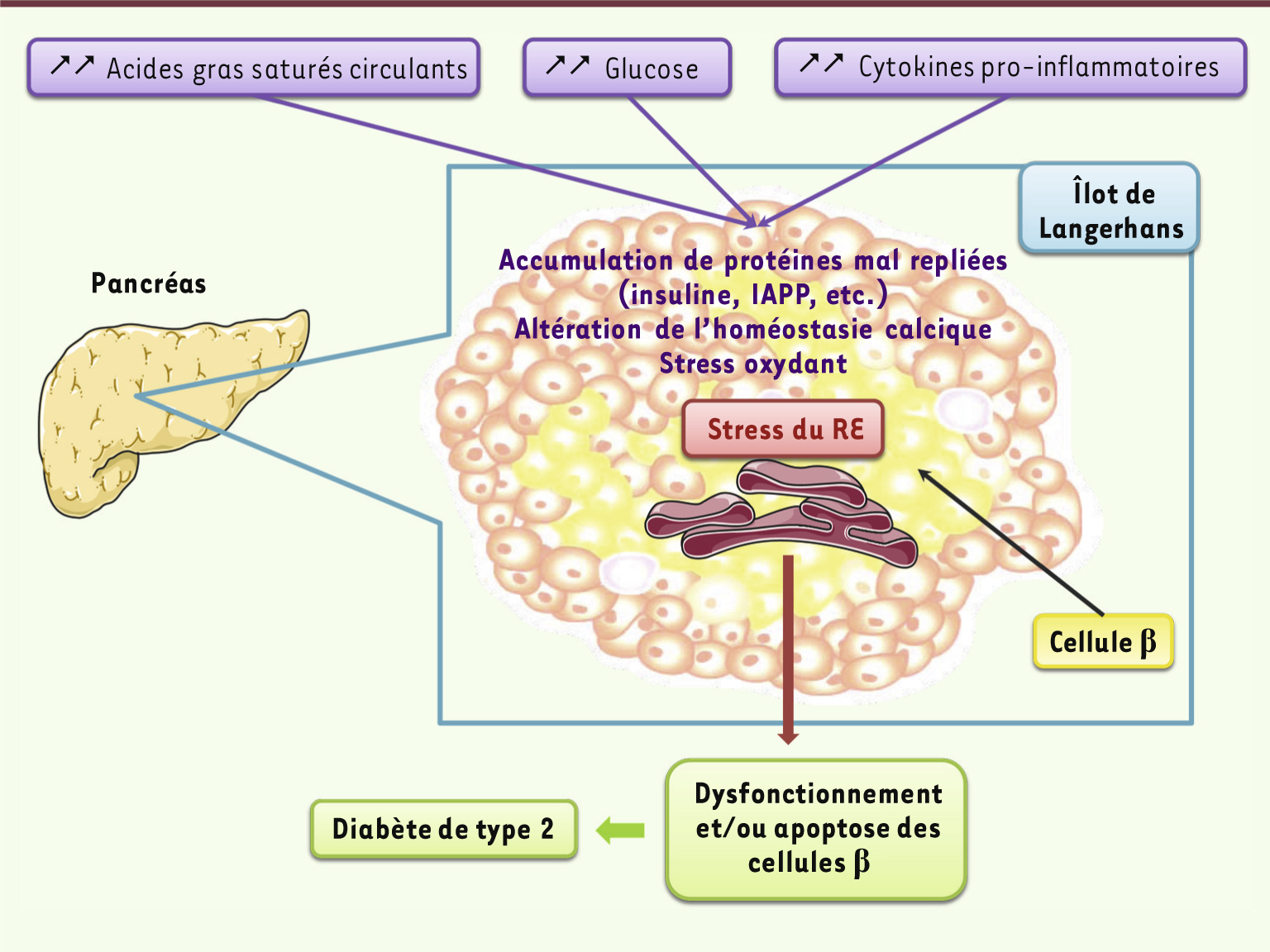
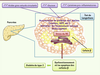 | Figure 3.
Causes du stress du RE dans la cellule β pancréatique. En conditions d’obésité et de résistance à l’insuline, les altérations métaboliques observées (hyperlipidémie, hyperglycémie, inflammation) perturbent l’homéostasie du RE dans les cellules β, en induisant notamment l’accumulation de protéines mal repliées, une altération de l’homéostasie calcique et un stress oxydant, qui concourent au développement d’un stress du RE. De nombreuses données ont mis en évidence que ce stress du RE contribue au dysfonctionnement des cellules β et à leur apoptose, participant ainsi à la survenue d’un diabète de type 2. |
Acides gras et lipotoxicité Les acides gras, et particulièrement les acides gras saturés, sont des activateurs majeurs du stress du RE dans la cellule β pancréatique [
20,
21]. Le traitement d’îlots pancréatiques de rongeurs avec du palmitate induit les trois effecteurs de la voie UPR. L’inhibition du stress RE par la surexpression de la chaperone moléculaire BiP protège la cellule β du stress du RE et de l’apoptose induite par les lipides [
22]. Le (ou les) mécanisme(s) par le(s)quel(s) le palmitate induit un stress du RE dans les cellules β semblent impliquer une perturbation de l’homéostasie calcique, une dérégulation du transport protéique ER-Golgi et également une altération de la composition lipidique des membranes du RE [
24-
26,
49] ( →). De manière intéressante, l’augmentation de la désaturation des acides gras via la surexpression de la stéaroyl-CoA désaturase (SCD) diminue l’apoptose des cellules β induite par le palmitate [ 26]. À l’inverse, l’invalidation du gène codant pour la SCD augmente cette apoptose [
27]. Enfin, la lipotoxicité semble contribuer à une altération de l’autophagie, voie qui permet notamment la dégradation des protéines et des organites cellulaires. En effet, l’induction de l’autophagie dans les cellules β permet de diminuer le stress du RE et l’apoptose [
28].
(→) Voir l’article de A.D. Mancini et V. Poitout, page 715 de ce numéro
Inflammation Plusieurs cytokines proinflammatoires comme l’interleukine-1β (IL-1β) ou l’interféron-γ (IFN-γ), peuvent activer un stress du RE et une réponse UPR dans les cellules β [
29], mais il n’existe pas de preuves formelles démontrant que l’apoptose des cellules β en réponse à ces cytokines est dépendante du stress du RE. Ces deux cytokines conduisent à la production d’oxyde nitrique (NO) par la cellule β [
30]. Le NO est capable d’inhiber l’expression de la pompe Ca 2+ ATPase du RE, conduisant à une perturbation de l’homéostasie calcique et à l’induction d’un stress du RE [ 29]. Peptide amyloïde Hormis l’insuline, d’autres protéines peuvent s’accumuler dans le RE et causer un stress. C’est le cas de l’IAPP ( islet amyloid polypeptide), qui est co-exprimée et co-sécrétée avec l’insuline, et dont l’accumulation sous forme d’oligomères induit un stress du RE et une apoptose des cellules β [
31]. |
Rôle du stress du RE dans le développement de la résistance à l’insuline En période postprandiale, l’insuline permet l’utilisation et le stockage du glucose dans ses tissus cibles (foie, muscle squelettique et tissu adipeux). Ce rôle anabolique de l’insuline est relayé par une voie de signalisation intracellulaire commune à tous les tissus sensibles à l’insuline dans ses premières étapes (Figure 4). Dans des conditions d’obésité, l’accumulation ectopique de lipides dans les tissus comme le foie et le muscle conduit à une altération du signal insulinique que l’on qualifie de résistance à l’insuline. Il est maintenant bien documenté que les dérivés lipidiques, comme les céramides et les diacylglycérols, jouent un rôle majeur dans l’installation de la résistance à l’insuline. Ces derniers activent des kinases de stress comme la JNK (c-jun N-terminal kinase) et l’IKK (inhibitor of K kinase), ou encore des formes de PKC (protéine kinase C) atypiques qui vont phosphoryler les résidus sérine des principaux acteurs de la voie insulinique : IRS (insulin receptor substrate) ou PKB (protéine kinase B), conduisant à une inhibition de la signalisation insulinique. Certaines données de la littérature montrent que le stress du RE pourrait jouer un rôle important dans l’installation de la résistance à l’insuline [
32]. Un des premiers arguments vient de travaux du groupe de Hotamisligil qui montrent la présence d’un stress du RE dans les tissus résistants à l’insuline (foie, tissu adipeux blanc) de rongeurs obèses [
33], observation qui a par la suite été confirmée dans les tissus de patients humains obèses [
34,
35]. À partir de ces données, il a été proposé que le stress du RE pourrait contribuer à l’altération de la sensibilité à l’insuline de deux façons : une action directe de la voie UPR sur la voie de signalisation insulinique, et une action indirecte via l’activation de la synthèse et du stockage des lipides, qui sont eux-mêmes responsables de la résistance à l’insuline. Concernant la voie directe, il a été montré que le stress du RE pouvait, par l’intermédiaire de IRE1, activer les kinases de stress JNK et IKK [13], qui inhibent les protéines de la voie de signalisation insulinique en les phosphorylant sur les résidus sérine (Figure 5). Toutefois, ce mode d’action a été remis en question par plusieurs études qui montrent que l’activation de IRE1 et/ou de la JNK n’est pas forcément corrélée à la présence d’une résistance à l’insuline. Des souris invalidées pour le gène codant pour XBP1, alimentées avec un régime diabétogène, améliorent leur sensibilité à l’insuline, malgré l’activation d’un stress du RE et de la JNK [
36]. Dans le muscle, l’induction d’une résistance à l’insuline par le palmitate est bien corrélée à une activation du stress du RE et de la JNK. Toutefois, l’inhibition du stress du RE par des chaperones moléculaires ou chimiques ne permet pas de restaurer la sensibilité à l’insuline [
37,
38].
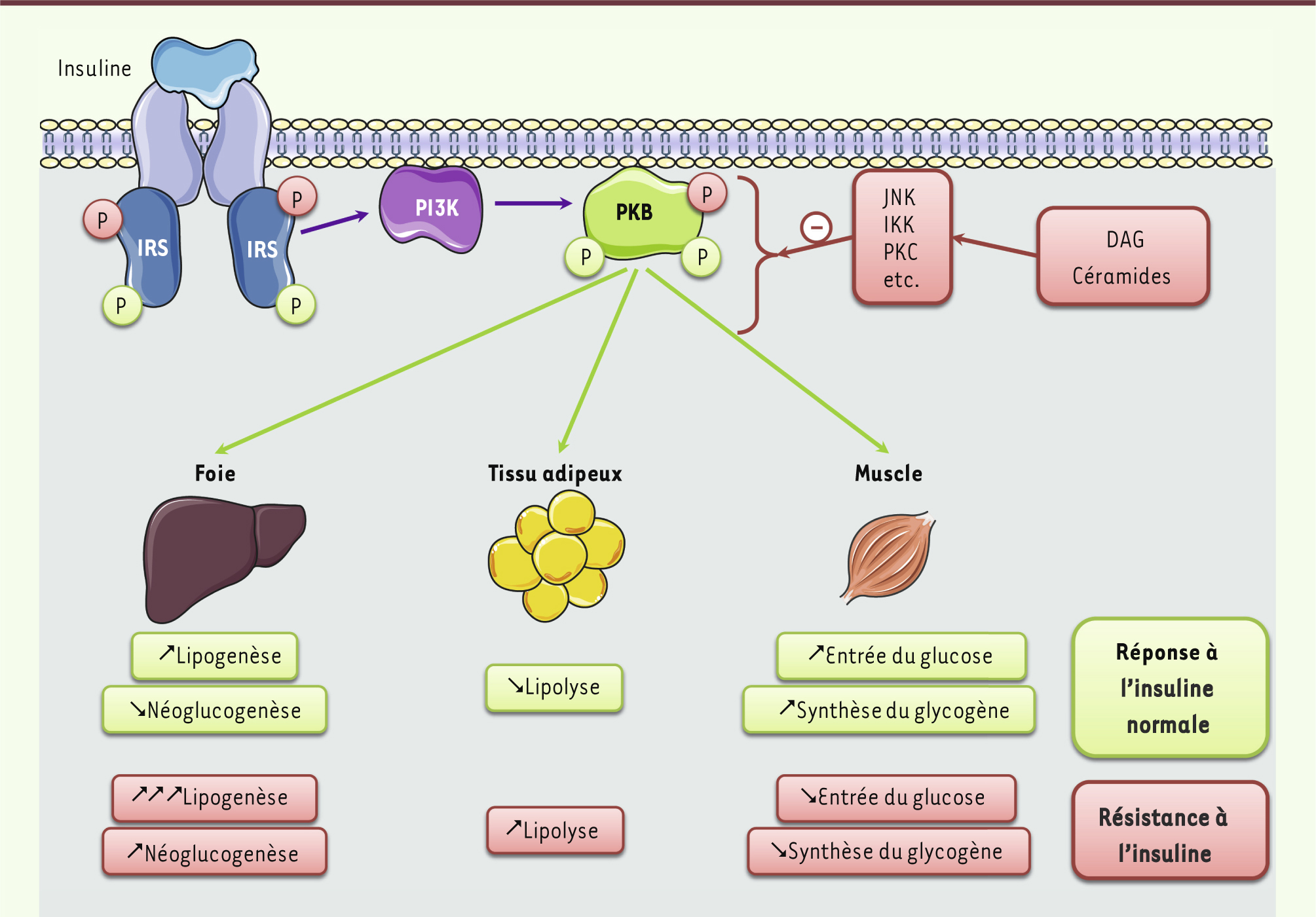
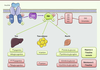 | Figure 4.
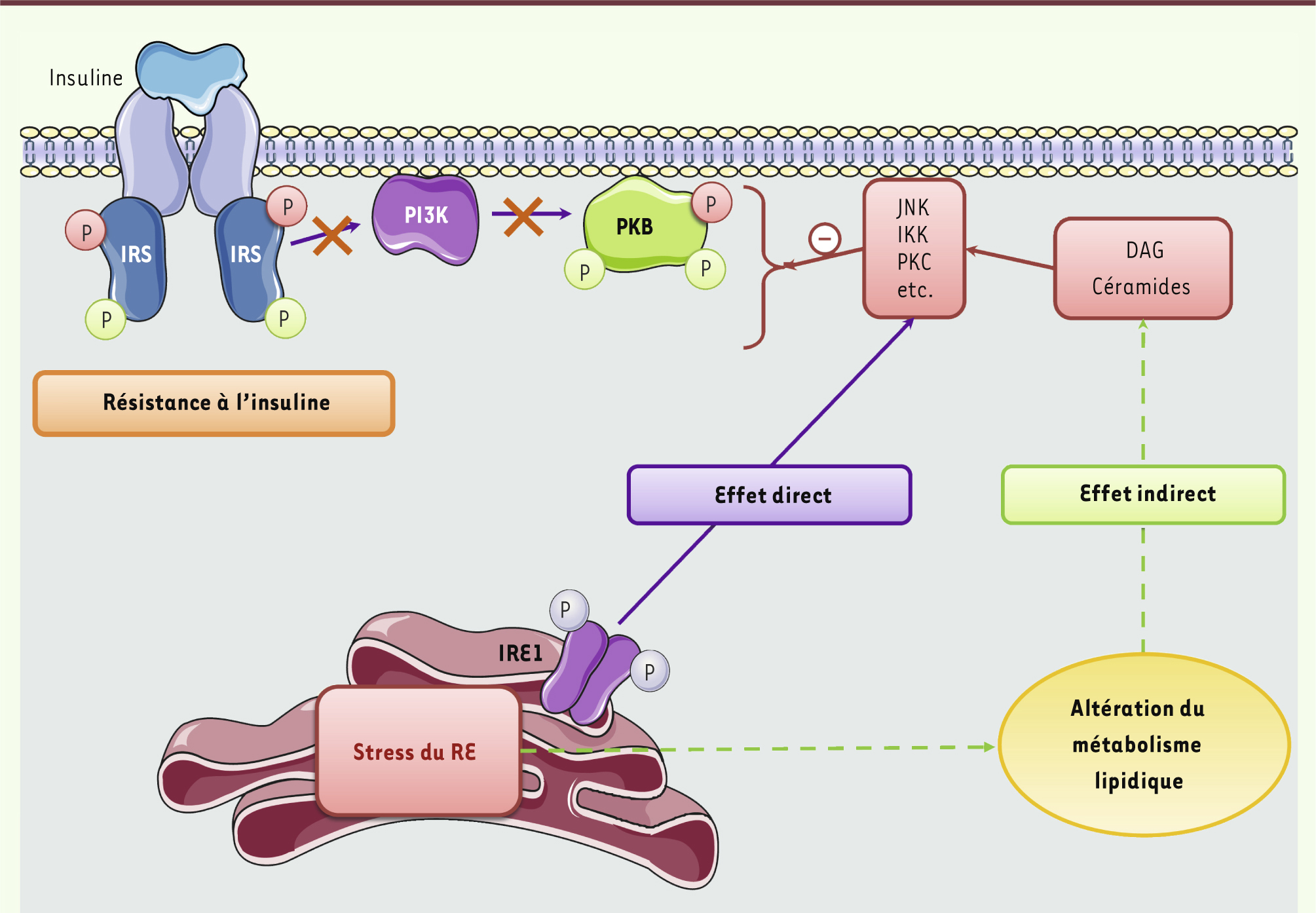
Signalisation de l’insuline et résistance à l’insuline. L’insuline, en se fixant sur son récepteur, va permettre l’activation des IRS par phosphorylation des résidus tyrosine qui vont ainsi interagir avec la PI-3 kinase (PI3K) et l’activer. En phosphorylant certains phospholipides membranaires, la PI-3 kinase permet le recrutement de la protéine kinase B (PKB) et son activation par phosphorylation. La PKB va ensuite phosphoryler différents substrats selon les tissus et relayer les effets métaboliques de l’insuline. En condition d’obésité, l’accumulation cellulaire d’espèces lipidiques délétères, comme le diacylglycérol (DAG) et les céramides, contribue à l’activation de kinases de stress (JNK, IKK, PKC, etc.) qui vont inhiber la signalisation de l’insuline, notamment, en phosphorylant les IRS sur des résidus sérine et en ciblant la PKB. |
Concernant la voie indirecte, le stress du RE pourrait contribuer au développement de la résistance à l’insuline en augmentant la synthèse d’espèces lipidiques délétères pour la voie de la signalisation insulinique. Ceci a été particulièrement étayé dans le foie où il a été montré que l’activation de l’UPR entraîne le développement d’une stéatose hépatique principalement par deux mécanismes (Figure 5). D’une part, le stress du RE active le facteur de transcription SREBP-1c (sterol regulatory element binding protein-1c) qui est un des régulateurs majeurs de la lipogenèse hépatique [
39,
40]. Le facteur de transcription de l’UPR, XBP1, a également été impliqué dans le contrôle de la lipogenèse de manière dépendante ou indépendante de SREBP-1c [
41]. D’autre part, le stress du RE diminue l’export d’acides gras en diminuant la synthèse des VLDL (very low density lipoprotein) [
42]. Ainsi, en favorisant la synthèse et le stockage d’acides gras au niveau du foie, le stress du RE pourrait entraîner l’accumulation d’espèces lipidiques néfastes à la signalisation insulinique. Chez des souris obèses avec une stéatose hépatique, l’inhibition du stress du RE, à l’aide de la chaperone BiP, entraîne une diminution de la lipogenèse et de la stéatose et une amélioration très nette de la sensibilité à l’insuline [39].
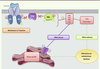 | Figure 5.
Induction de la résistance à l’insuline par le stress du RE. Le stress du RE participe à l’apparition de la résistance à l’insuline de deux manières principales : d’une manière directe, par l’intermédiaire d’IRE1 qui est capable d’activer les kinases de stress JNK et IKK, qui régulent négativement la signalisation de l’insuline ; et d’une manière indirecte, en favorisant l’accumulation d’espèces lipidiques néfastes qui, elles-mêmes, activent les kinases de stress. |
|
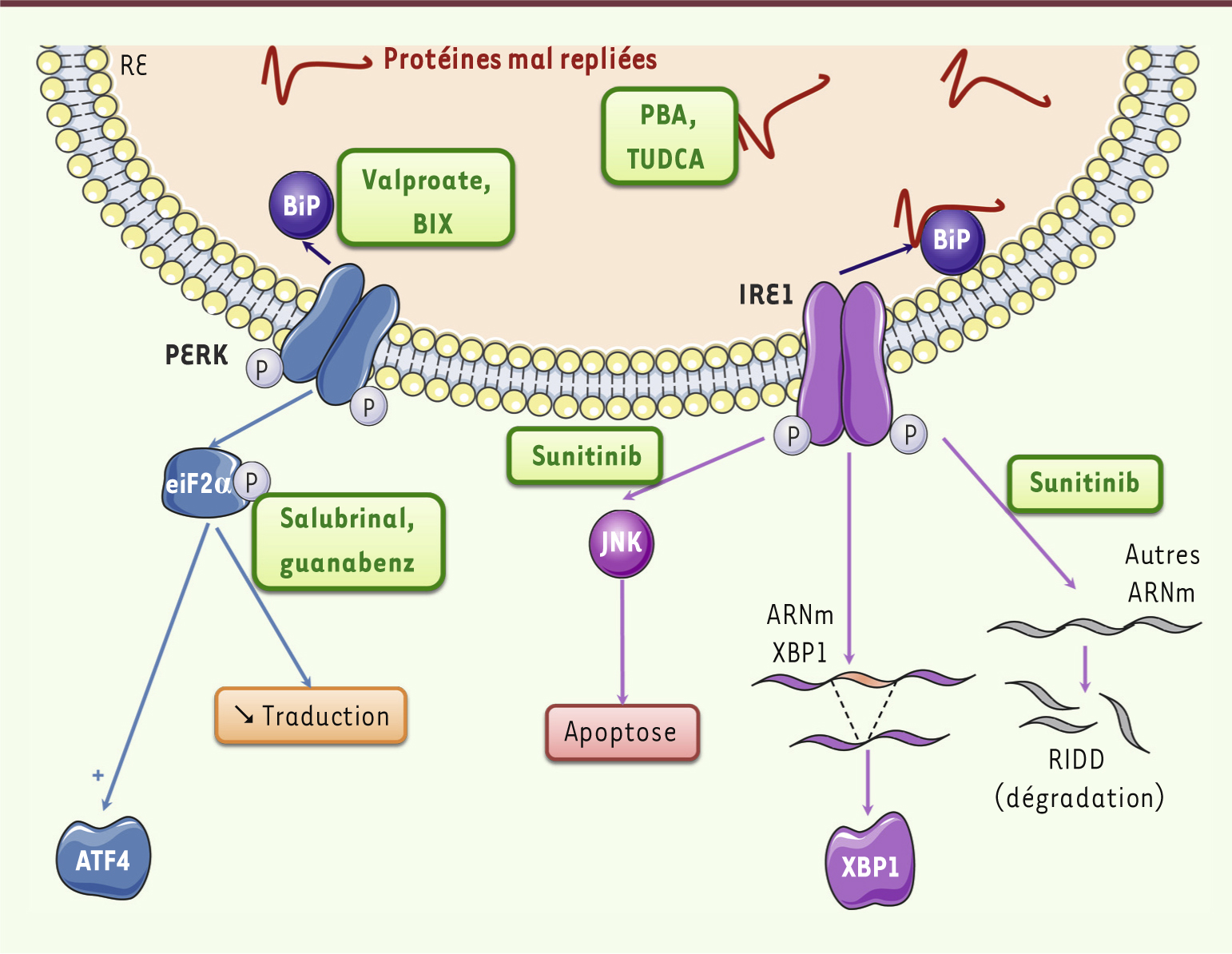
L’inhibition de la voie UPR peut-elle être efficace dans le traitement du diabète de type 2 ? La relation très forte qui existe entre le stress du RE et le diabète de type 2 a stimulé une recherche intense de molécules pouvant cibler la voie UPR ou les protéines en cours de repliement, dans une perspective thérapeutique du diabète de type 2. Plusieurs stratégies se sont déjà révélées efficaces dans des modèles animaux et, pour certaines, dans des études cliniques (Figure 6). La première approche vise à développer des chaperones chimiques qui empêchent le mauvais repliement et l’agrégation des protéines, en stabilisant des intermédiaires de repliement protéique. Parmi ces chaperones, le TUDCA (tauroursodéoxycholate) et le PBA (4-phénylbutyrate) ont montré leur efficacité dans l’amélioration de la sensibilité à l’insuline et de la stéatose hépatique chez la souris et chez l’homme obèses [
43,
44]. Ces chaperones ont l’inconvénient d’être non spécifiques, et l’avenir dans ce domaine réside dans le développement de chaperones dites pharmacologiques permettant de cibler une protéine précise, comme par exemple l’insuline [
50]. Un deuxième type de petites molécules permet de cibler spécifiquement des protéines de la voie UPR. Certaines permettent d’augmenter l’expression de la protéine chaperone BiP comme le valproate ou le composé BIX (BiP inducer X). D’autres molécules (salubrinal, guanabenz) agissent sur eiF2α en le maintenant dans un état phosphorylé, afin de limiter la synthèse protéique globale [
45]. Une recherche très performante a été réalisée sur IRE1 et a permis d‘identifier des composés (sunitinib) affectant l’activité endonucléase RIDD d’IRE1 et son activité apoptotique (activation de JNK), sans toucher à l’activation de XBP1 qui joue un rôle protecteur dans les cellules β [
46]. Finalement, les dernières approches utilisées ciblent des protéines impliquées dans l’homéostasie calcique et l’autophagie. Enfin, pour illustrer l’intérêt thérapeutique de la voie UPR, il faut souligner que les analogues du GLP1 (glucagon-like peptide 1) qui ont largement démontré leur efficacité dans le traitement du diabète de type 2, agissent entre autres en inhibant le stress du RE [
47].
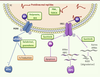 | Figure 6.
La voie UPR, une cible thérapeutique pertinente. De nombreuses molécules ont été décrites comme ciblant la voie UPR. Parmi celles-ci, on trouve les chaperones chimiques (TUDCA, PBA) qui vont empêcher le mauvais repliement des protéines. D’autres molécules ciblent spécifiquement des acteurs de la voie UPR : (1) en augmentant l’expression de la chaperone BiP (valproate et BIX) ; (2) en maintenant eiF2α phosphorylé (salubrinal, guanabenz) ; (3) en inhibant l’activité RIDD et l’activité apoptotique d’IRE1 sans altérer l’activation de XBP1. |
|
Les nombreuses données publiées dans la littérature au cours de ces dernières années ont permis de faire émerger le stress du RE comme un acteur clé de la pathogenèse du diabète de type 2. Ainsi, l’inhibition ou l’atténuation de ce stress pourrait devenir une voie thérapeutique prometteuse permettant de protéger les cellules β de l’apoptose ou les tissus périphériques de la résistance à l’insuline induite par les lipides. Il faut toutefois garder à l’esprit que la voie UPR étant avant tout une voie physiologique indispensable au maintien de l’homéostasie du RE, la perspective d’une inhibition globale de cette voie apparaît illusoire, car dangereuse. Une stratégie plus fine visant à inhiber certains effecteurs de la voie ou à ralentir certaines branches de l’UPR apparait comme plus appropriée. De ce fait, la recherche visant à décrypter l’implication des voies de l’UPR dans la pathogenèse du diabète de type 2 doit se poursuivre afin d’affiner une éventuelle cible thérapeutique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiés dans cet article.
|
1.
Foufelle
F
,
Ferre
P
. La réponse UPR . Med Sci (Paris).
2007; ; 23 : :291.–296. 2.
Back
SH
,
Kaufman
RJ
. Endoplasmic reticulum stress and type 2 diabetes . Annu Rev Biochem.
2012; ; 81 : :767.–793. 3.
Wang
S
,
Kaufman
RJ
. The impact of the unfolded protein response on human disease . J Cell Biol.
2012; ; 197 : :857.–867. 4.
Fonseca
SG
,
Gromada
J
,
Urano
F
. Endoplasmic reticulum stress and pancreatic β-cell death . Trends Endocrinol Metab.
2011; ; 22 : :266.–274. 5.
Goodge
KA
,
Hutton
JC
. Translational regulation of proinsulin biosynthesis and proinsulin conversion in the pancreatic beta-cell . Semin Cell Dev Biol.
2000; ; 11 : :235.–242. 6.
Harding
HP
,
Zeng
H
,
Zhang
Y
, et al.
Diabetes mellitus and exocrine pancreatic dysfunction in perk-/- mice reveals a role for translational control in secretory cell survival . Mol Cell.
2001; ; 7 : :1153.–1163. 7.
Scheuner
D
,
Song
B
,
McEwen
E
, et al.
Translational control is required for the unfolded protein response and in vivo glucose homeostasis . Mol Cell.
2001; ; 7 : :1165.–1176. 8.
Delepine
M
,
Nicolino
M
,
Barrett
T
, et al.
EIF2AK3, encoding translation initiation factor 2-alpha kinase 3, is mutated in patients with Wolcott-Rallison syndrome . Nat Genet.
2000; ; 25 : :406.–409. 9.
Hodish
I
,
Liu
M
,
Rajpal
G
, et al.
Misfolded proinsulin affects bystander proinsulin in neonatal diabetes . J Biol Chem.
2010; ; 285 : :685.–694. 10.
Liu
M
,
Haataja
L
,
Wright
J
, et al.
Mutant INS-gene induced diabetes of youth: proinsulin cysteine residues impose dominant-negative inhibition on wild-type proinsulin transport . PLoS One.
2010; ; 5 : :e13333.. 11.
Song
B
,
Scheuner
D
,
Ron
D
, et al.
Chop deletion reduces oxidative stress, improves beta cell function, and promotes cell survival in multiple mouse models of diabetes . J Clin Invest.
2008; ; 118 : :3378.–3389. 12.
Lipson
KL
,
Ghosh
R
,
Urano
F.
, The role of IRE1alpha in the degradation of insulin mRNA in pancreatic beta-cells . PLoS ONE.
2008; ; 3 : :e1648.. 13.
Urano
F
,
Wang
X
,
Bertolotti
A
, et al.
Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1 . Science.
2000; ; 287 : :664.–666. 14.
Yoneda
T
,
Imaizumi
K
,
Oono
K
, et al.
Activation of caspase-12, an endoplastic reticulum (ER) resident caspase, through tumor necrosis factor receptor-associated factor 2-dependent mechanism in response to the ER stress . J Biol Chem.
2001; ; 276 : :13935.–13940. 15.
Lerner
AG
,
Upton
JP
,
Praveen
PV
, et al.
IRE1alpha induces thioredoxin-interacting protein to activate the NLRP3 inflammasome and promote programmed cell death under irremediable ER stress . Cell Metab.
2012; ; 16 : :250.–264. 16.
Oslowski
CM
,
Hara
T
,
O’Sullivan-Murphy
B
, et al.
Thioredoxin-interacting protein mediates ER stress-induced beta cell death through initiation of the inflammasome . Cell Metab.
2012; ; 16 : :265.–273. 17.
Elouil
H
,
Bensellam
M
,
Guiot
Y
, et al.
Acute nutrient regulation of the unfolded protein response and integrated stress response in cultured rat pancreatic islets . Diabetologia.
2007; ; 50 : :1442.–1452. 18.
Lipson
KL
,
Fonseca
SG
,
Ishigaki
S
, et al.
Regulation of insulin biosynthesis in pancreatic beta cells by an endoplasmic reticulum-resident protein kinase IRE1 . Cell Metab.
2006; ; 4 : :245.–254. 19.
Robertson
RP
,
Harmon
J
,
Tran
PO
, et al.
Glucose toxicity in beta-cells: type 2 diabetes, good radicals gone bad, and the glutathione connection . Diabetes.
2003; ; 52 : :581.–587. 20.
Cnop
M
,
Ladriere
L
,
Hekerman
P
, et al.
Selective inhibition of eukaryotic translation initiation factor 2 alpha dephosphorylation potentiates fatty acid-induced endoplasmic reticulum stress and causes pancreatic beta-cell dysfunction and apoptosis . J Biol Chem.
2007; ; 282 : :3989.–3997. 21.
Karaskov
E
,
Scott
C
,
Zhang
L
, et al.
Chronic palmitate but not oleate exposure induces endoplasmic reticulum stress, which may contribute to INS-1 pancreatic β-cell apoptosis . Endocrinology.
2006; ; 147 : :3398.–3407. 22.
Laybutt
DR
,
Preston
AM
,
Åkerfeldt
MC
, et al.
Endoplasmic reticulum stress contributes to beta cell apoptosis in type 2 diabetes . Diabetologia.
2007; ; 50 : :752.–763. 23.
Borradaile
NM
,
Han
X
,
Harp
JD
, et al.
Disruption of endoplasmic reticulum structure and integrity in lipotoxic cell death . J Lipid Res.
2006; ; 47 : :2726.–2737. 24.
Boslem
E
,
MacIntosh
G
,
Preston
AM
, et al.
A lipidomic screen of palmitate-treated MIN6 beta-cells links sphingolipid metabolites with endoplasmic reticulum (ER) stress and impaired protein trafficking . Biochem J.
2011; ; 435 : :267.–276. 25.
Cunha
DA
,
Hekerman
P
,
Ladriere
L
, et al.
Initiation and execution of lipotoxic ER stress in pancreatic beta-cells . J Cell Sci.
2008; ; 121 : :2308.–2318. 26.
Green
CD
,
Olson
LK
. Modulation of palmitate-induced endoplasmic reticulum stress and apoptosis in pancreatic beta-cells by stearoyl-CoA desaturase and Elovl6 . Am J Physiol Endocrinol Metab.
2011; ; 300 : :E640.–E649. 27.
Thorn
K
,
Hovsepyan
M
,
Bergsten
P.
, Reduced levels of SCD1 accentuate palmitate-induced stress in insulin-producing beta-cells . Lipids Health Dis.
2010; ; 9 : :108.. 28.
Bachar-Wikstrom
E
,
Wikstrom
JD
,
Ariav
Y
, et al.
Stimulation of autophagy improves endoplasmic reticulum stress-induced diabetes . Diabetes.
2013; ; 62 : :1227.–1237. 29.
Cardozo
AK
,
Ortis
F
,
Storling
J
, et al.
Cytokines downregulate the sarcoendoplasmic reticulum pump Ca2+ ATPase 2b and deplete endoplasmic reticulum Ca2+, leading to induction of endoplasmic reticulum stress in pancreatic β-cells . Diabetes.
2005; ; 54 : :452.–461. 30.
Akerfeldt
MC
,
Howes
J
,
Chan
JY
, et al.
Cytokine-induced beta-cell death is independent of endoplasmic reticulum stress signaling . Diabetes.
2008; ; 57 : :3034.–3044. 31.
Huang
CJ
,
Lin
CY
,
Haataja
L
, et al.
High expression rates of human islet amyloid polypeptide induce endoplasmic reticulum stress mediated beta-cell apoptosis, a characteristic of humans with type 2 but not type 1 diabetes . Diabetes.
2007; ; 56 : :2016.–2027. 32.
Flamment
M
,
Hajduch
E
,
Ferre
P
, et al.
New insights into ER stress-induced insulin resistance . Trends Endocrinol Metab.
2012; ; 23 : :381.–390. 33.
Ozcan
U
,
Cao
Q
,
Yilmaz
E
, et al.
Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes . Science.
2004; ; 306 : :457.–461. 34.
Gregor
MF
,
Yang
L
,
Fabbrini
E
, et al.
Endoplasmic reticulum stress is reduced in tissues of obese subjects after weight loss . Diabetes.
2009; ; 58 : :693.–700. 35.
Puri
P
,
Mirshahi
F
,
Cheung
O
, et al.
Activation and dysregulation of the unfolded protein response in nonalcoholic fatty liver disease . Gastroenterology.
2008; ; 134 : :568.–576. 36.
Jurczak
MJ
,
Lee
AH
,
Jornayvaz
FR
, et al.
Dissociation of inositol-requiring enzyme (IRE1alpha)-mediated c-Jun N-terminal kinase activation from hepatic insulin resistance in conditional X-box-binding protein-1 (XBP1) knock-out mice . J Biol Chem.
2012; ; 287 : :2558.–2567. 37.
Hage-Hassan
R
,
Hainault
I
,
Vilquin
JT
, et al.
Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells . Diabetologia.
2012; ; 55 : :204.–214. 38.
Rieusset
J
,
Chauvin
MA
,
Durand
A
, et al.
Reduction of endoplasmic reticulum stress using chemical chaperones or Grp78 overexpression does not protect muscle cells from palmitate-induced insulin resistance . Biochem Biophys Res Commun.
2012; ; 417 : :439.–445. 39.
Kammoun
HL
,
Chabanon
H
,
Hainault
I
, et al.
GRP78 expression inhibits insulin and ER stress-induced SREBP-1c activation and reduces hepatic steatosis in mice . J Clin Invest.
2009; ; 119 : :1201.–1215. 40.
Ferre
P
,
Foufelle
F
. Hepatic steatosis: a role for de novo lipogenesis and the transcription factor SREBP-1c . Diabetes Obes Metab.
2010; ; 12 : :83.–92. 41.
Lee
AH
,
Scapa
EF
,
Cohen
DE
, et al.
Regulation of hepatic lipogenesis by the transcription factor XBP1 . Science.
2008; ; 320 : :1492.–1496. 42.
Ota
T
,
Gayet
C
,
Ginsberg
HN
. Inhibition of apolipoprotein B100 secretion by lipid-induced hepatic endoplasmic reticulum stress in rodents . J Clin Invest.
2008; ; 118 : :316.–332. 43.
Xiao
C
,
Giacca
A
,
Lewis
GF
. Sodium phenylbutyrate, a drug with known capacity to reduce endoplasmic reticulum stress, partially alleviates lipid-induced insulin resistance and beta-cell dysfunction in humans . Diabetes.
2011; ; 60 : :918.–924. 44.
Kars
M
,
Yang
L
,
Gregor
MF
, et al.
Tauroursodeoxycholic acid may improve liver and muscle but not adipose tissue insulin sensitivity in obese men and women . Diabetes.
2010; ; 59 : :1899.–1905. 45.
Cao
SS
,
Kaufman
RJ
. Targeting endoplasmic reticulum stress in metabolic disease . Expert Opin Ther Targets.
2013; ; 17 : :437.–448. 46.
Bouchecareilh
M
,
Higa
A
,
Fribourg
S
, et al.
Peptides derived from the bifunctional kinase/RNase enzyme IRE1alpha modulate IRE1alpha activity and protect cells from endoplasmic reticulum stress . FASEB J.
2011; ; 25 : :3115.–3129. 47.
Yusta
B
,
Baggio
LL
,
Estall
JL
, et al.
GLP-1 receptor activation improves beta cell function and survival following induction of endoplasmic reticulum stress . Cell Metab.
2006; ; 4 : :391.–406. 48.
Franc
C
. Le diabète : des chiffres alarmants . Med Sci (Paris).
2013; ; 29 : :711.–714. 49.
Mancini
AD
,
Poitout
V
. Les récepteurs membranaires aux acides gras de la cellule β. De nouvelles cibles thérapeutiques pour le traitement du diabète de type 2 . Med Sci (Paris).
2013; ; 29 : :715.–721. 50.
Mendre
C
,
Mouillac
B
. Chaperons pharmacologiques . Med Sci (Paris).
2013; ; 29 : :627.–635. |