| |
| Med Sci (Paris). 2013 October; 29(10): 836–839. Published online 2013 October 18. doi: 10.1051/medsci/20132910008.Traitement antiviral Pour ou contre l’interféron de type I ? Piers Whitehead,1 Béatrice Drouet,1 Daniel Zagury,1 and Armand Bensussan2* 1Neovacs, 3-5, impasse Reille, 75014Paris, France 2Inserm U976, université Paris-Diderot, Hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France. MeSH keywords: Antiviraux, effets indésirables, usage thérapeutique, Maladies auto-immunes, immunologie, thérapie, Études cas-témoins, Maladie chronique, Humains, Immunité innée, physiologie, Immunothérapie, méthodes, Interféron de type I, Lupus érythémateux disséminé, génétique, Analyse sur microréseau, Transcriptome, Maladies virales, traitement médicamenteux |
Le rôle antiviral de l’interféron (IFN) de type I est largement référencé depuis sa découverte il y a plus de 50 ans par Isaacs et Lindenmann [
1]. Alors que la communauté scientifique s’intéresse de plus en plus au rôle de cette cytokine dans les infections, mais aussi dans les maladies auto-immunes comme le lupus érythémateux disséminé [
2], deux articles publiés simultanément dans la revue Science viennent de mettre en lumière une nouvelle caractéristique de l’IFN [
3]. Ils montrent, sans ambiguïté, son rôle immunosuppresseur, proviral, dans un modèle d’infection virale chronique, paradoxe pour une molécule utilisée jusqu’à maintenant dans les traitements antiviraux. |
Interféron de type I : première ligne de défense contre l’attaque virale Détectés par des récepteurs spécifiques PRR (pattern-recognition receptor), les composants viraux ou bactériens induisent rapidement une forte production d’IFN de type I qui active les réponses immunes innée et adaptative pour combattre l’infection. Essentiellement produits par les cellules dendritiques plasmacytoïdes (pDC), les IFN de type I comprennent majoritairement les IFNα et -β, qui reconnaissent un même récepteur (IFNR) hétérodimérique. Une fois activé, ce récepteur stimule un ensemble de protéines cytoplasmiques pour former un complexe hétérotrimérique. Celui-ci migre dans le noyau et se fixe sur des séquences ADN spécifiques, permettant la transcription de nombreux gènes impliqués dans différentes fonctions cellulaires, telles que la réponse antivirale, mais également les réactions immunitaires. L’ensemble de ces gènes exprimés donne un profil spécifique appelé « signature interféron ». |
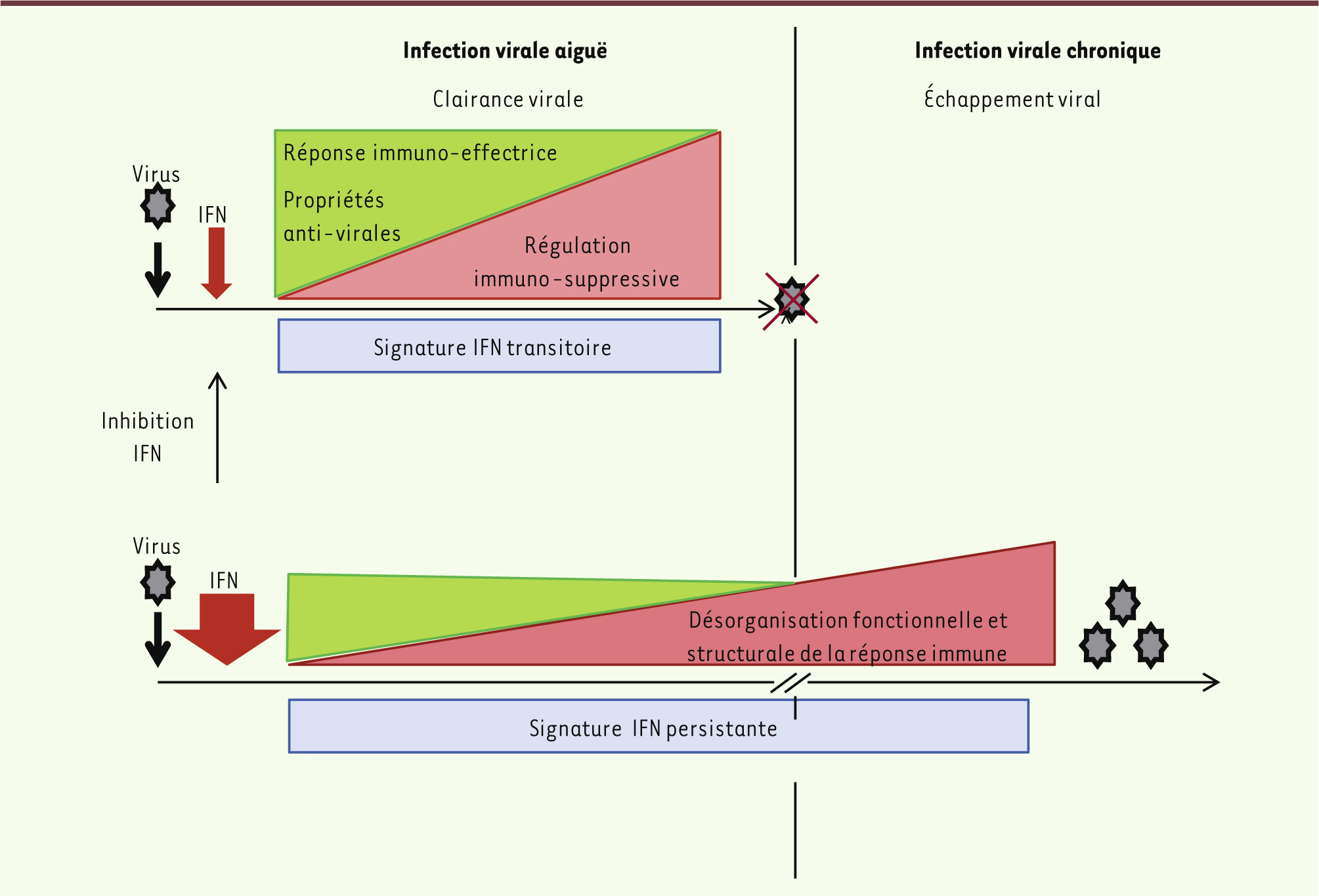
Effet délétère de l’IFN dans les infections virales chroniques Il vient d’être démontré que, contrastant avec ses propriétés antivirales, l’IFN avait un rôle délétère dans les infections virales chroniques [
4,
5]. En effet, deux équipes ont comparé chez la souris la réponse immune et la clairance virale en utilisant deux souches du virus LCMV (lymphocytic choriomeningitis virus) : l’une déclenche une infection aiguë, induisant une forte réponse de lymphocytes cytotoxiques, qui est rapidement éliminée en 8 à 10 jours ; la seconde provoque une infection chronique avec une charge virale prolongée pendant 90 jours (Figure 1). Lors de l’infection chronique, les auteurs observent une expression persistante d’IFN de type 1 (α et β), accompagnée d’une signature IFN proche d’un profil inflammatoire et immunosuppresseur, et d’une désorganisation architecturale et fonctionnelle des organes lymphoïdes.
 | Figure 1.
L’IFN est la première cytokine produite lors de l’attaque virale. Lors d’une infection aiguë, la réponse immune activée par l’IFN va être stoppée une fois le virus éliminé. Cette immunorégulation devient délétère lorsque la souche virale, résistante aux attaques précoces anti-virales de l’hôte, stimule de façon chronique l’IFN. La persistance de la signature IFN est source de dysfonctionnement pathologique du système immunitaire. |
Ces perturbations sont liées à la présence d’IFN puisqu’elles n’existent pas si la voie IFN est inhibée avec un anticorps monoclonal dirigé contre le récepteur IFNR, ou chez des souris transgéniques dont le gène IFNR a été invalidé. L’inhibition de l’IFN s’accompagne également d’une réduction des cellules effectrices régulatrices de la réponse immune. Les auteurs ont ainsi démontré que la stimulation persistante par l’IFN perturbe la réponse immune plutôt qu’elle ne l’améliore. En d’autres termes, si le virus n’est pas éliminé rapidement, un « environnement IFN » s’installe, inefficace pour éliminer le virus et caractérisé par une désorganisation des organes lymphoïdes, siège de la réponse immune. Il apparaît donc que les propriétés antivirales précoces de l’IFN deviennent délétères à long terme. Ce modèle murin chronique est similaire à ce que l’on peut observer chez certains patients souffrant d’hépatite C où une signature IFN avec une absence de clairance virale est détectée, prédictive d’une non-réponse au traitement IFN [
6,
7]. Or, si la majorité des patients traités par l’IFN pégylé guérissent, un certain nombre d’entre eux restent infectés et évoluent à long terme vers une cirrhose létale ou un hépatocarcinome nécessitant une transplantation hépatique. La persistance de l’IFN dans l’infection par le virus VIH (virus de l’immunodéficience humaine) a également été mise en évidence dans les années 1990, conduisant à des essais cliniques visant à inhiber la cytokine par immunisation active anti-IFN. L’essai de phase II/III avait montré l’innocuité de la préparation, la disparition de l’IFNα circulant et un bénéfice clinique chez les patients traités [
8]. Le rôle immunosuppresseur de l’IFN dans l’infection VIH a été confirmé plus récemment par l’équipe de Siliciano [
9]. |
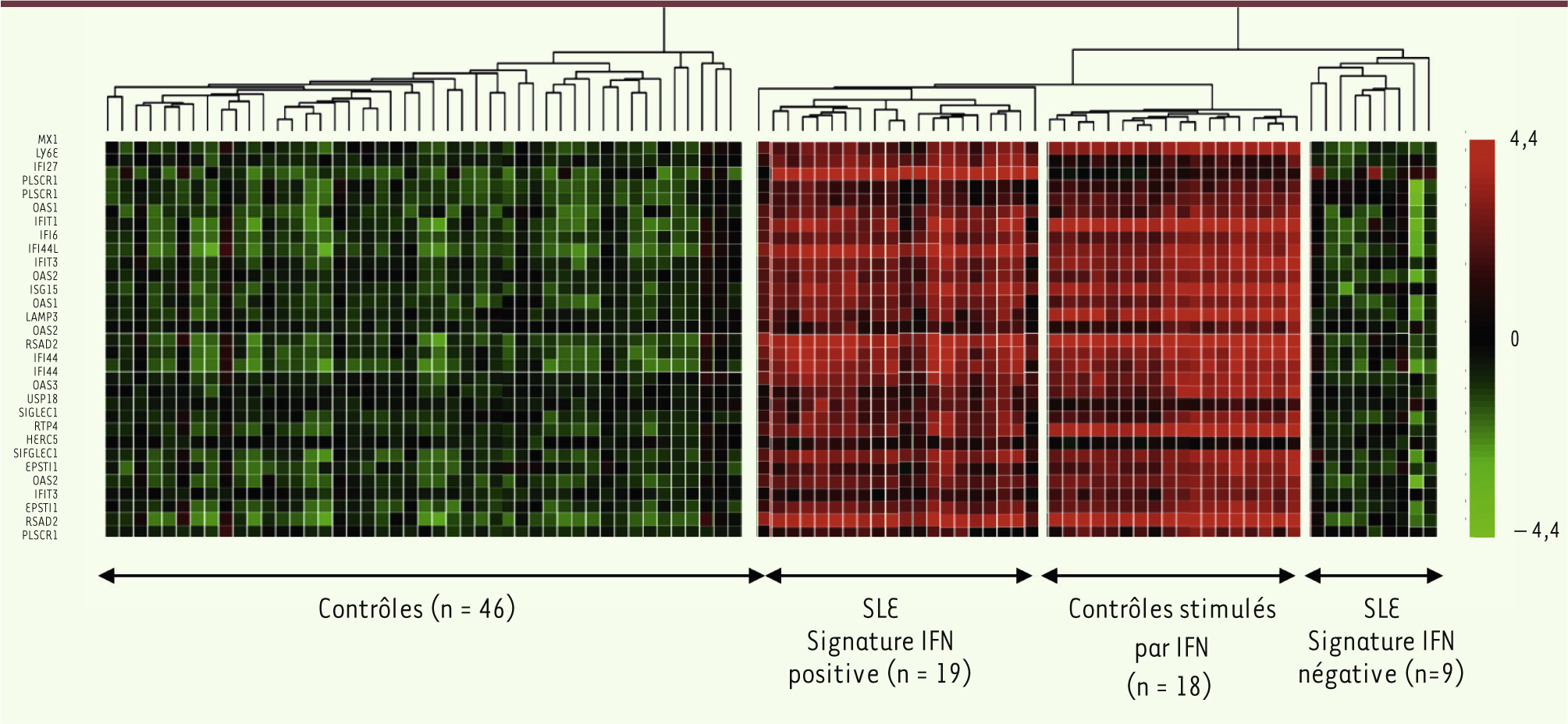
Neutralisation de l’IFN dans les pathologies à signature IFN persistante La présence de la signature IFN chez des patients atteints de maladies auto-immunes, telles que le lupus érythémateux disséminé, la dermatomyosite, et la sclérodermie, a conduit à élargir les indications de traitement anti-IFNα à ces pathologies (Figure 2). Tout comme le rapportent les résultats expérimentaux publiés dans Science, l’inhibition de l’IFN pourrait conduire à une suppression de la réponse auto-immune pathologique chez ces patients. Ainsi, de nombreux anticorps monoclonaux sont en cours de développement : anti-IFNR (MEDI-546) [
10–
13] ou anti-IFNα (rontalizumab, sifalimumab, AGS-009) [
14]. Les premiers résultats sont encourageants, et montrent une bonne tolérance et un effet sur la signature IFN avec une amélioration des signes cliniques [10,
11, 14,
15].
 | Figure 2.
La signature IFN est aussi présente chez les patients atteints de maladies auto-immunes. Dans l’exemple illustré ici, des patients lupiques peuvent être divisés selon le niveau d’expression des gènes induits par l’IFN. L’analyse transcriptomique par microarray de 21 gènes à partir d’échantillons sanguins d’individus contrôles stimulés ou non par l’IFN donne un score d’expression qui, par traitement mathématique (algorithme de regroupement hiérarchique non supervisé), permet de définir une signature IFN. L’analyse des échantillons sanguins de patients lupiques permet, en les comparant aux échantillons contrôles, de les séparer en deux groupes avec une signature IFN négative ou positive. SLE : systematic lupus erythematosus (adapté de [ 15]). |
Une autre stratégie consiste à induire chez les patients des anticorps dirigés contre la cytokine cible. Cette approche par immunisation active avec un vaccin anti-IFN, l’IFNα-kinoïde (IFN-K), présente l’avantage d’induire une réponse humorale polyclonale contre les différentes isoformes de l’IFNα. Au cours d’un essai clinique de phase I/II chez des patients lupiques traités par l’IFN-K, les premiers résultats montrent une bonne tolérance sans augmentation d’infections virales, une diminution de la signature IFN et une augmentation du taux sérique du complément C3, anormalement bas chez les sujets lupiques [
16,
17]. |
La réponse IFN durable au cours de pathologies chroniques virales ou auto-immunes conduit à une désorganisation structurale et fonctionnelle du système immunitaire. Ces dérégulations immunitaires pathogènes peuvent être corrigées en neutralisant l’IFN circulant dans les pathologies à signature IFN persistante. Cette neutralisation peut se faire, soit par immunothérapie passive avec des anticorps monoclonaux anti-IFN, soit par immunisation active avec la vaccination kinoïde en induisant des anticorps naturels polyclonaux anti-IFN. Par ailleurs, le suivi de la signature IFN chez les patients pourrait représenter un biomarqueur de l’efficacité des traitements anti-IFN. Pour cela, les gènes à surveiller devraient être sélectionnés pour déterminer un profil « IFN chronique », pour confirmer le point d’inflexion entre le profil aiguë et chronique, et éventuellement aller vers un consensus des gènes sélectionnés pour comparer les différents traitements. Le choix de l’IFN comme cytokine à neutraliser durant une infection chronique virale ou une maladie auto-immune ouvre de nouvelles perspectives thérapeutiques. |
P. Whitehead et B. Drouet sont salariés de Neovacs.
D. Zagury est fondateur de Neovacs.
A. Bensussan est membre du Conseil scientifique de Neovacs.
|
1.
Isaacs
A
,
Lindenmann
J
.
Virus interference. I
. The interferon . Proc R Soc Lond B Biol Sci.
1957; ; 147 : :258.–267.
2.
Rönnblom
L
,
Pascual
V
. The innate immune system in SLE: type I interferons and dendritic cells . Lupus.
2008; ; 17 : :394.–399. 3.
Odorizzi
PM
,
Wherry
EJ
. Immunology. An interferon paradox . Science.
2013; ; 340 : :155.–156.
4.
Teijaro
JR
,
Ng
C
,
Lee
AM
, et al.
Persistent LCMV infection is controlled by blockade of type I interferon signaling . Science.
2013; ; 340 : :207.–211. 5.
Wilson
EB
,
Yamada
DH
,
Elsaesser
H
, et al.
Blockade of chronic type I interferon signaling to control persistent LCMV infection . Science.
2013; ; 340 : :202.–207. 6.
Bolen
CR
,
Robek
MD
,
Brodsky
L
, et al.
The blood transcriptional signature of chronic hepatitis C virus is consistent with an ongoing interferon-mediated antiviral response . J Interferon Cytokine Res.
2013; ; 33 : :15.–23. 7.
Sarasin-Filipowicz
M
,
Oakeley
EJ
,
Duong
FH
, et al.
Interferon signaling and treatment outcome in chronic hepatitis C . Proc Natl Acad Sci USA.
2008; ; 105 : :7034.–7039. 8.
Gringeri
A
,
Musicco
M
,
Hermans
P
, et al.
Active anti-interferon-alpha immunization: a European-Israeli, randomized, double-blind, placebo-controlled clinical trial in 242 HIV-1–infected patients (the EURIS study) . J Acquir Immune Defic Syndr Hum Retrovirol.
1999; ; 20 : :358.–370. 9.
Sedaghat
AR
,
German
J
,
Teslovich
TM
, et al.
Chronic CD4+ T-cell activation and depletion in human immunodeficiency virus type 1 infection: type I interferon-mediated disruption of T-cell dynamics . J Virol.
2008; ; 82 : :1870.–1883. 10.
Petri
M
,
Wallace
DJ
,
Spindler
A
, et al.
Sifalimumab, a human anti-interferon-α monoclonal antibody, in systemic lupus erythematosus: a phase I randomized, controlled, dose-escalation study . Arthritis Rheum.
2013; ; 65 : :1011.–1021. 11.
McBride
JM
,
Jiang
J
,
Abbas
AR
, et al.
Safety and pharmacodynamics of rontalizumab in patients with systemic lupus erythematosus: results of a phase I, placebo-controlled, double-blind, dose-escalation study . Arthritis Rheum.
2012; ; 64 : :3666.–3676. 12.
Tcherepanova
I
,
Curtis
M
,
Sale
M
, et al.
Results of a randomized placebo controlled phase study of AGS-009, a humanized anti-interferon-α monoclonal antibody in subjects with systemic lupus erythematosus . Berlin:
Annual European Congress on Rheumatology-EULAR; , 2012.
13.
Wang
B
,
Higgs
BW
,
Chang
L
, et al.
Pharmacogenomics and translational simulations to bridge indications for an anti-interferon-α receptor antibody . Clin Pharmacol Ther.
2013; ; 93 : :483.–492. 14.
Terrier
B
,
Mouthon
L
. Lupus érythémateux systémique. Traitements par anticorps monoclonaux et molécules recombinantes . Med Sci (Paris).
2013; ; 29 : :65.–73.
15.
Higgs
BW
,
Zhu
W
,
Morehouse
C
, et al.
A phase 1b clinical trial evaluating sifalimumab, an anti-IFN-α monoclonal antibody, shows target neutralisation of a type I IFN signature in blood of dermatomyositis and polymyositis patients . Ann Rheum Dis . 2013 (sous presse).
16.
Lauwerys
BR
,
Hachulla
E
,
Spertini
F
, et al.
Down-regulation of interferon signature in systemic lupus erythematosus patients by active immunization with interferon α-kinoid . Arthritis Rheum.
2013; ; 65 : :447.–456. 17.
Bensussan
A
,
Bizzini
B
,
Pouletty
P
,
Gallo
R
,
Zagury
D
. Les kinoïdes . Med Sci (Paris).
2008; ; 24 : :306.–313. |