| |
| Med Sci (Paris). 2013 October; 29(10): 908–911. Published online 2013 October 18. doi: 10.1051/medsci/20132910020.Co-infection tuberculose et VIH Coordination d’un essai clinique
randomisé par l’Institut Pasteur du Cambodge Laurence Borand,1* Phearavin Pheng,1 Manil Saman,1 Chanthy Leng,1 Phalla Chea,1 Sao Sarady Ay,1 Sophea Suom,1 Nimul Roat Men,1 Eric Nerrienet,1 and Olivier Marcy1,2 1Unité d’épidémiologie et de santé publique, Institut Pasteur du Cambodge, 5 boulevard Monivong, Phnom Penh, Cambodge 2Cambodian health committee, Phnom Penh, Cambodge |

La tuberculose est une des principales causes de mortalité des personnes infectées par le virus de l’immunodéficience humaine (VIH) [
1]. Afin de réduire cette surmortalité, l’OMS (Organisation mondiale de la santé) recommandait depuis 2003 de débuter le traitement antirétroviral (ARV) dans un délai de deux semaines à deux mois après le début du traitement antituberculeux chez les patients co-infectés ayant moins de 200 lymphocytes T CD4 par mm3 [
2], sans plus de précision. Les bénéfices attendus d’une restauration immunitaire précoce plaidaient pour un démarrage après deux semaines de traitement antituberculeux, tandis que la crainte d’une toxicité médicamenteuse cumulée, d’une incidence accrue de syndrome inflammatoire de reconstitution immunitaire (IRIS) [
14] et d’une mauvaise observance liée à la complexité des traitements étaient en faveur d’un démarrage plus tardif du traitement antirétroviral (ARV), à deux mois du début du traitement antituberculeux [
3]. En 2002, le Cambodge avait la prévalence de l’infection à VIH la plus élevée d’Asie du Sud-Est, estimée à 2,8 % des adultes de 15 à 49 ans [
4], et la mortalité par tuberculose chez les patients infectés par le VIH y était d’environ 35 % [
5]. L’incidence de la tuberculose en population générale était estimée à 510 pour 100 000 personnes-années, et celle-ci représentait la première cause de mortalité. Dans ce contexte, l’essai clinique CAMELIA (Cambodian early versus late introduction of antiretrovirals) (ANRS 1295/CIPRA KH001) mis en œuvre au Cambodge et coordonné par l’Institut Pasteur visait à déterminer le moment optimal d’introduction du traitement antirétroviral chez des patients co-infectés par le VIH et la tuberculose. |
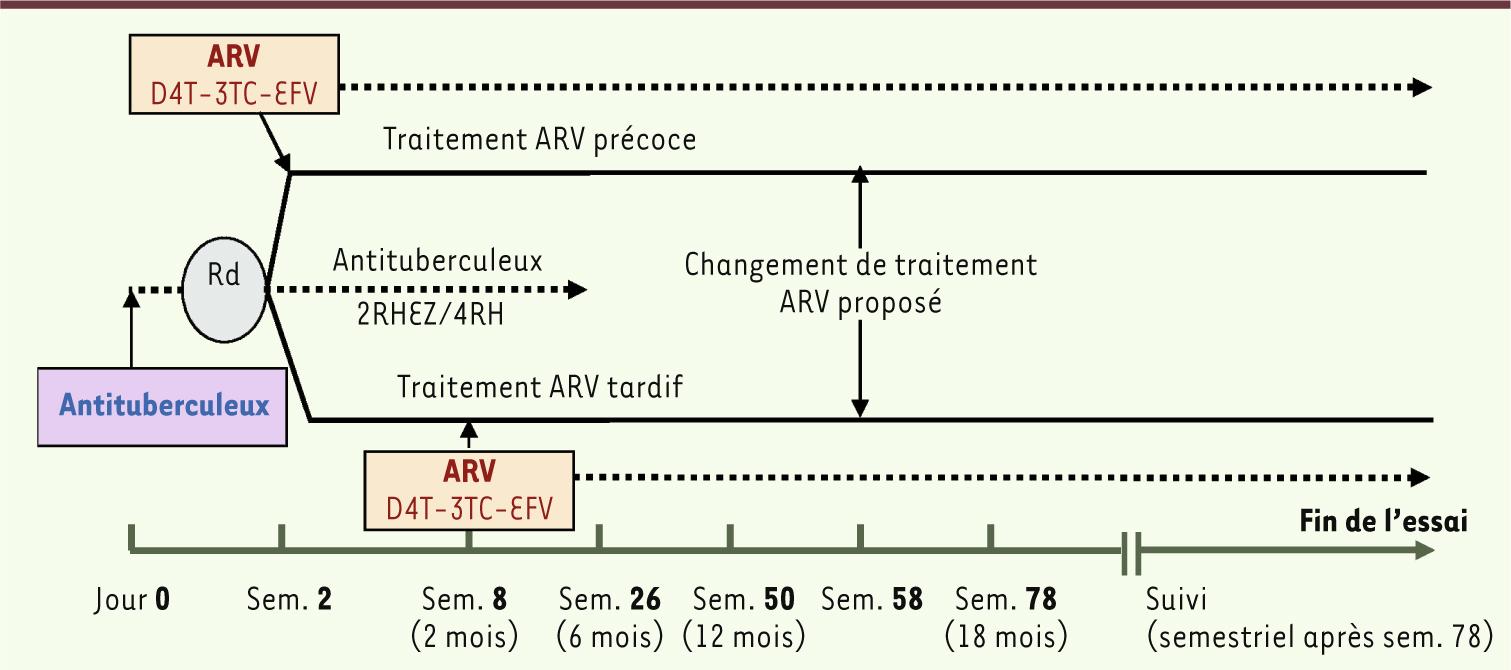
CAMELIA était un essai randomisé comparant une stratégie précoce d’introduction des ARV, deux semaines après l’initiation du traitement antituberculeux standard, par rapport à une stratégie tardive d’introduction, huit semaines après l’initiation du traitement antituberculeux [
6]. Les adultes infectés par le VIH ayant un nombre de lymphocytes CD4 ≤ 200/mm3 et une tuberculose confirmée par l’examen bactériologique direct étaient inclus, après signature du consentement éclairé, et randomisés pour débuter précocement ou tardivement un traitement ARV comprenant de l’efavirenz et une combinaison de stavudine et de lamivudine (Figure 1). La survie était évaluée à la fin de l’étude, 50 semaines après l’inclusion du dernier patient. Les objectifs secondaires portaient sur la tolérance et l’efficacité des ARV et des antituberculeux, la survenue d’un syndrome inflammatoire de reconstitution immunitaire et les interactions médicamenteuses entre efavirenz et rifampicine.
 | Figure 1.
Schéma de l’essai clinique CAMELIA. Rd : randomisation ; H : isoniazide ; Z : pyrazinamide ; R : rifampicine ; E : éthambutol ; ARV : traitement antirétroviral ; D4T : stavudine ; 3TC : lamivudine ; EFV : efavirenz ; Sem. : semaine. |
|
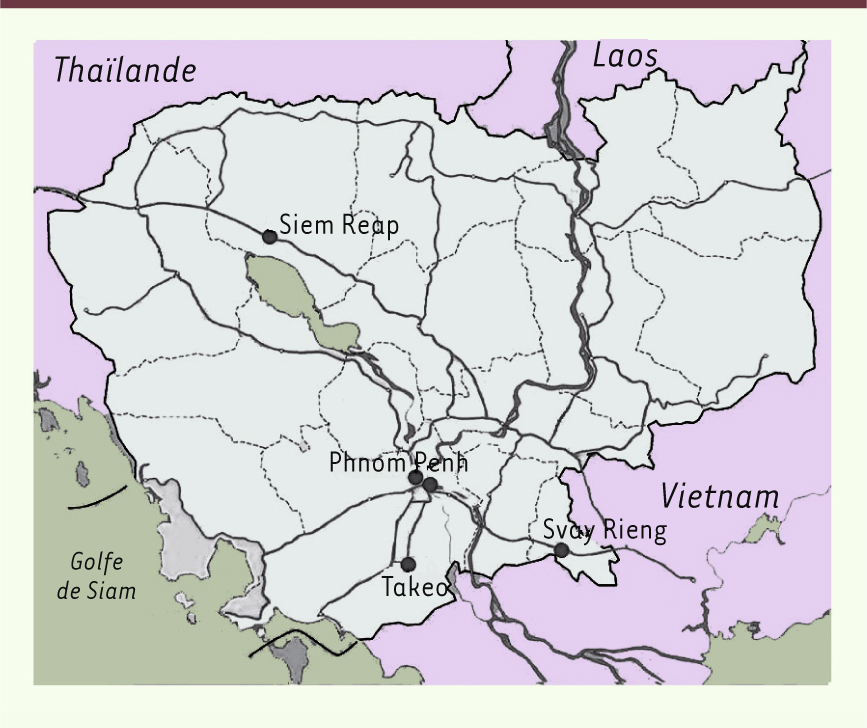
Diverses institutions impliquées dans la recherche ou la prise en charge du VIH et de la tuberculose au Cambodge ont contribué à la mise en œuvre de l’essai CAMELIA : l’Institut Pasteur du Cambodge (IPC), le Cambodian health committee (CHC), le Centre hospitalier universitaire (CHU) de Bicêtre (France), le Harvard immune disease institute (IDI) (États-Unis), le ministère de la Santé cambodgien, Médecins sans frontières (MSF) Belgique et l’Institut Pasteur de Paris (IPP, France). Le financement de l’étude a été assuré par l’Agence nationale de la recherche sur le sida et les hépatites virales française (ANRS) et le National institute of allergy and infectious diseases (NIAID) américain, par le biais du programme Comprehensive international program of research on AIDS (CIPRA) attribué au CHC. Cinq hôpitaux cambodgiens ont participé à l’essai : les hôpitaux nationaux de l’Amitié khméro-soviétique (AKS) et Calmette à Phnom Penh, et les hôpitaux provinciaux de Svay Rieng, Takéo, et Siem Reap (Figure 2).
 | Figure 2.
Cambodge : localisation des hôpitaux ayant participé à l’essai clinique CAMELIA.
|
|
Les structures de l’essai L’unité d’épidémiologie et de santé publique de l’IPC assurait la coordination de l’essai en lien étroit avec le reste de l’équipe opérationnelle constituée des trois investigateurs principaux, ainsi que des coordinateurs cliniques, de laboratoire et méthodologiques. Le conseil scientifique orientait les aspects scientifiques et pratiques de la conduite de l’étude. Le comité indépendant de surveillance de l’étude, composé d’experts des trois pays nommés par le NIAID, l’ANRS et les autorités cambodgiennes, assurait le suivi de l’essai et la sécurité des patients. |
Préparation et mise en place Après approbation du protocole par les autorités de santé cambodgiennes et les comités d’éthique aux niveaux national et institutionnel, l’équipe opérationnelle a développé le cahier d’observations et les manuels de procédures cliniques, méthodologiques et de laboratoire dédiés aux sites de recherche clinique et au centre de coordination. La notice d’information et le formulaire de consentement traduits en Khmer ont été revus avec plusieurs associations cambodgiennes de patients et avec l’aide d’un ethnolinguiste afin de s’assurer de leur intelligibilité, puis rétro-traduits en anglais afin de s’assurer de leur conformité. Plusieurs visites de mise en place et de sessions de formation initiale sur le protocole, les procédures et les Bonnes pratiques cliniques ont été organisées pour former le personnel des sites et du centre de coordination à la conduite de l’étude. Les laboratoires des sites de l’étude ont été équipés de centrifugeuses et de microscopes avec un module additionnel de fluorescence à diodes émettrices de lumière (Fraen FluoLED™) pour la concentration des prélèvements bactériologiques et leur examen direct par coloration à l’auramine, afin d’assurer une détection optimale des bacilles tuberculeux. |
L’équipe de l’IPC assurait les aspects méthodologiques et opérationnels de la conduite de l’étude, la communication avec les autorités de santé, et procédait à la randomisation, à l’envoi aux services de pharmacovigilance des déclarations d’événements indésirables graves (ICH-E6 step 4 - 1996) transmises par les investigateurs, et au monitorage de l’essai. Pendant les quatre années et demie de durée de l’étude, plus de mille visites sur sites ont ainsi été effectuées afin de vérifier la présence et la conformité des consentements éclairés, l’exactitude des données recueillies par rapport aux dossiers médicaux des patients, le respect du protocole par les équipes hospitalières et la gestion des médicaments par la pharmacie des sites. Des réunions rassemblant l’ensemble des investigateurs étaient organisées sur une base semestrielle. Des visites sur site effectuées en collaboration avec l’équipe du CHC en charge de la coordination clinique permettaient, en outre, de discuter les dossiers de patients dont la prise en charge médicale était compliquée (infections opportunistes multiples, suspicion de tuberculose multirésistante, toxicités cumulées), ainsi que de suivre le recrutement et de faire le point sur des questions opérationnelles. Outre la réalisation des examens bactériologiques, immunologiques et virologiques du suivi de l’essai, l’IPC organisait le contrôle de qualité des laboratoires hospitaliers, le suivi des prélèvements et la gestion des biothèques. Les données de 8 955 visites protocolaires ont été saisies dans la base de données. Les analyses statistiques ont été réalisées en collaboration avec l’Institut Pasteur Paris |
Plusieurs études associées ont été réalisées en collaboration avec des chercheurs de l’IPP, de l’Inserm, du Harvard IDI, du CHU de Bicêtre, et du CHU de Montpellier. Ces études ont exploré des aspects fondamentaux de la co-infection VIH-tuberculose : rôle des sous-populations lymphocytaires T et NK (natural killer) dans la physiopathologie et la prédiction du syndrome inflammatoire de reconstitution immunitaire (IRIS) tuberculeux (ANRS 12153 CAPRI NK [
7] et ANRS 12164 CAPRI T), variabilité pharmacocinétique et polymorphisme des cytochromes P450 dans une population de patients cambodgiens infectés par le VIH et traités par névirapine ou efavirenz [
8] (ANRS 12154 PECAN) et, enfin, diversité génétique de la tuberculose et impact sur la mortalité et l’expression clinique de la tuberculose (ANRS 12278). |
Collaboration directe de l’ANRS et du NIH sur une même étude au Cambodge, CAMELIA a intégré trois cultures de travail différentes pour une conduite selon les principes éthiques de la Déclaration d’Helsinki approuvée par l’Association médicale mondiale, les Bonnes pratiques cliniques, la charte éthique de l’ANRS pour la recherche dans les pays en développement, et le code américain Federal regulations (45 CFR 46). La mise en œuvre de ces standards dans des centres sans expérience de recherche clinique préalable a exigé un surcroît de temps et de ressources pour la formation, la coordination et le monitoring. Elle était aussi compliquée par des défis linguistiques nécessitant un effort important de traduction et de prise en considération des différences culturelles. L’essai était intégré au maximum dans le système national de prise en charge du VIH. Il utilisait notamment le circuit de soin habituel, avec des procédures adaptées et des médicaments similaires aux traitements disponibles en routine. L’étude nécessitait néanmoins, de la part du personnel hospitalier, un investissement supplémentaire en temps, dans un contexte de surcharge de travail où l’activité scientifique était peu valorisée, une situation déjà documentée dans des pays à ressources limitées [
9]. Enfin, des difficultés structurelles du système de santé, telles que l’hétérogénéité des ressources hospitalières en matière d’explorations complémentaires entre la province et la capitale et l’absence de compte-rendu d’hospitalisation ou de certificat de décès, ont rendu plus difficile la caractérisation des évènements cliniques graves. En revanche, la stabilité du personnel des sites, la simplicité du processus de soumission au comité d’éthique et le soutien des autorités de santé nationales ont contribué à faciliter la mise en œuvre et la conduite de l’étude sur des points réputés bloquants dans d’autres pays à ressources limitées [
10]. |
Impact en termes de santé publique et autres bénéfices Dès la fin de l’étude, les résultats ont été présentés aux investigateurs, aux autorités de santé et aux associations de patients. La traduction des résultats en termes de santé publique a été immédiate avec l’intégration du démarrage précoce des ARV dans les recommandations cambodgiennes. La mise en place de l’essai a permis l’équipement des laboratoires des hôpitaux, la mise en place de dosages médicamenteux à la faculté de pharmacie de Phnom Penh et la rénovation du service de pneumologie de l’hôpital de l’AKS. Les associations cambodgiennes de patients ont pu se familiariser avec la recherche clinique et constituer un community advisory board pour les études ultérieures de l’ANRS comme suggéré précédemment [
11]. À l’IPC, CAMELIA a permis le développement d’une expertise de recherche clinique complémentaire aux laboratoires, intégrant une équipe de chefs de projets, d’attachés de recherche clinique, de data managers et de cliniciens. Enfin, la prise en charge des tuberculoses multirésistantes initiée grâce à l’essai a permis un élargissement de l’accès aux antituberculeux de 2e ligne au niveau national. |
Les résultats de l’essai CAMELIA Les résultats principaux de CAMELIA ont été publiés en octobre 2011 dans le New England Journal of Medicine [6]. De janvier 2006 à mai 2010, 661 patients profondément immunodéprimés (taux de CD4 médian : 25 cellules/mm3) et dénutris (indice de masse corporelle médian : 16,7 kg/m2) ont été inclus et suivis dans l’essai pendant 25 mois en médiane. L’introduction des ARV, deux semaines après le début des antituberculeux, était associée à une réduction de 34 % de la mortalité sur la durée totale de l’étude (59 décès parmi 332 patients dans le groupe précoce contre 90 décès parmi 329 dans le groupe tardif ; p = 0,006), avec un risque accru de développer un IRIS associé à la tuberculose (risque relatif : 2,51 ; intervalle de confiance 95 % : 1,78 à 3,59), sans sur-risque d’effets secondaires médicamenteux graves (p = 0,31). Des résultats complémentaires ont montré la pertinence de la dose standard de 600 mg d’efavirenz chez des patients pesant 50 kg et plus, traités conjointement par rifampicine [
13].
|
|
Des premières discussions jusqu’à la publication principale [6], l’essai CAMELIA aura duré plus de huit années, contribuant non seulement à répondre à une question clef de santé publique au niveau national et international, mais aussi à développer une véritable plate-forme de recherche clinique au Cambodge. Les Instituts Pasteur du réseau international associent expertise de laboratoire et services d’épidémiologie au plus près des patients. Ils sont particulièrement appropriés à la coordination d’essais cliniques tels que CAMELIA, associant une recherche appliquée bénéficiant directement aux patients des pays où l’étude est conduite [9,
12] à des questions de recherches plus fondamentales. |
Laurence Borand est salariée de l'Institut Pasteur. Pheavarin Pheng et Nimul Roat Men sont salariés de l'Institut Pasteur du Cambodge. Manil Saman, Chanthy Leng, Phalla Chea, Sao Sarady Ay, Sophea Suom, Olivier Marcy sont salariés de l'Institut Pasteur du Cambodge. Eric Nerrienet déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
La conduite d’un essai clinique tel que CAMELIA a nécessité l’implication de nombreux acteurs que nous souhaitons associer à ce travail. Nous tenons particulièrement à remercier les patients qui ont participé à l’essai. Nous remercions aussi les investigateurs coordinateurs : le Dr François-Xavier Blanc, le Dr Anne E. Goldfeld et le Dr Thim Sok, ainsi que l’ensemble de l’équipe CAMELIA et, plus particulièrement, le Dr Didier Laureillard, le Dr Marcelo Fernandez, le Dr Sarin Chan, le Dr Narom Prak, le Dr Chindamony Kim, le Dr Khemarin Kim Lak, le Dr Chanroeurn Hak, le Dr Bunnet Dim, le Dr Bertrand Guillard, le Dr Borann Sar, le Dr Claire Rekacewicz, M. Yoann Madec, le Dr Sirenda Vong, le Dr Lawrence Fox, Mme Jane Bupp, et le Pr Jean-François Delfraissy. Nous remercions également le Pr Françoise Barré-Sinoussi, le Pr Charles Mayaud, le Dr Anne-Marie Taburet, le Pr Vincent Deubel, le Dr Jean-Louis Sarthou, le Dr Arnaud Tarantola, le Pr Pierre L’Her, le Dr Mean Chi Vun et le Dr Mao Tan Eang pour leur contribution et leur soutien tout au long de l’essai.
|
Footnotes |
1.
Straetemans
M
,
Bierrenbach
AL
,
Nagelkerke
N
, et al.
The effect of tuberculosis on mortality in HIV positive people: a meta-analysis . PLoS One.
2010; ; 5 : :e15241.. 2.
World health organization . Scaling up antiretroviral therapy in resource-limited settings: treatment guidelines for a public health approach, 2003 revision . Geneva: : WHO; , 2003.
3.
Dean
GL
,
Edwards
SG
,
Ives
NJ
, et al.
Treatment of tuberculosis in HIV-infected persons in the era of highly active antiretroviral therapy . AIDS.
2002; ; 16 : :75.–83. 4.
Kimerling
ME
,
Schuchter
J
,
Chanthol
E
, et al.
Prevalence of pulmonary tuberculosis among HIV-infected persons in a home care program in Phnom Penh, Cambodia . Int J Tuberc Lung Dis.
2002; ; 6 : :988.–994. 5.
Eng
B
,
Cain
KP
,
Nong
K
, et al.
Impact of a public antiretroviral program on TB/HIV mortality: Banteay Meanchey, Cambodia . Southeast Asian J Trop Med Public Health.
2009; ; 40 : :89.–92. 6.
Blanc
FX
,
Sok
T
,
Laureillard
D
, et al.
Earlier versus later start of antiretroviral therapy in HIV-infected adults with tuberculosis . N Engl J Med.
2011; ; 365 : :1471.–1481. 7.
Pean
P
,
Nerrienet
E
,
Madec
Y
, et al.
Natural killer cell degranulation capacity predicts early onset of the immune reconstitution inflammatory syndrome (IRIS) in HIV-infected patients with tuberculosis . Blood.
2012; ; 119 : :3315.–3320. 8.
Chou
M
,
Bertrand
J
,
Segeral
O
, et al.
Population pharmacokinetic-pharmacogenetic study of nevirapine in HIV-infected Cambodian patients . Antimicrob Agents Chemother.
2010; ; 54 : :4432.–4439. 9.
Lang
TA
,
White
NJ
,
Hien
TT
, et al.
Clinical research in resource-limited settings: Enhancing research capacity and working together to make trials less complicated . PLoS Negl Trop Dis.
2010; ; 4 : :e619.. 10.
Blanchard-Horan
C
,
Stocker
V
,
Moran
L
, et al.
Examining the challenges and solutions to the implementation of trials in resource-limited settings: Limited resource trials . Appl Clin Trials.
2012; ; 21 : :34.–42. 11.
Strauss
RP
,
Sengupta
S
,
Quinn
SC
, et al.
The role of community advisory boards: involving communities in the informed consent process . Am J Public Health.
2001; ; 91 : :1938.–1943. 12.
Lo
B
,
Bayer
R
. Establishing ethical trials for treatment and prevention of AIDS in developing countries . Br Med J.
2003; ; 327 : :337.–339. 13.
Borand
L
,
Laureillard
D
,
Madec
Y
, et al.
Plasma concentrations of efavirenz with a 600 mg standard dose in Cambodian HIV-infected adults treated for tuberculosis with a body weight above 50 kg . Antivir Ther.
2013; ; 18 : :419.–423. 14.
Breton
G
. Syndrome inflammatoire de reconstitution immune . Med Sci (Paris).
2010; ; 26 : :281.–290. |