| |
| Med Sci (Paris). 2013 October; 29(10): 912–917. Published online 2013 October 18. doi: 10.1051/medsci/20132910021.L’ulcère de Buruli – Un modèle de recherche transversale dynamique au sein du réseau des Instituts Pasteur Estelle Marion,1,2a Jordi Landier,1,3b Sara Eyangoh,1,4c and Laurent Marsollier5d 1Service de mycobactériologie, centre Pasteur du Cameroun - Réseau international des Instituts Pasteur, BP 1274, Yaoundé, Cameroun 2Centre de diagnostic et de traitement de l’ulcère de Buruli Raoul et Madeleine Follereau, BP 191, Pobè, République du Bénin 3Unité d’épidémiologie des maladies émergentes, Institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France 4ATOMyc, équipe associée à l’Institut de recherche pour le développement (IRD), centre Pasteur du Cameroun, BP 1274, Yaoundé, Cameroun 5Équipe Atip/Avenir ATOMycA, Inserm U892 CNRS U6299, université Nantes-Angers-Le Mans (LUNAM), université d’Angers et CHU d’Angers, département des maladies infectieuses Nantes-Angers, institut de biologie en santé - IRIS, 4, rue Larrey, 49933Angers Cedex 9, France |

L’ulcère de Buruli, ou infection à Mycobacterium ulcerans, est une maladie tropicale négligée. Cette infection est devenue la troisième mycobactériose après la tuberculose et la lèpre. Cette maladie, à tropisme essentiellement cutané, est responsable de vastes ulcérations dues à l’excrétion d’une toxine nommée mycolactone [
1]. Les gènes codant pour les enzymes responsables de la synthèse de la mycolactone sont situés sur un plasmide géant [
2]. Comme l’ensemble des mycobactéries, M. ulcerans a une paroi riche en lipides, caractéristique des bacilles acido-alcoolo-résistants, ce qui explique sa grande résistance aux substances antimicrobiennes. M. ulcerans possède une matrice extracellulaire qui est le réservoir de la mycolactone et confère des avantages à la bactérie pour coloniser ses différents environnements [
3]. C’est une mycobactérie environnementale, à croissance lente, son temps de génération a été évalué à 3,5 jours dans des modèles in vivo [
4]. |
Présentation de l’ulcère de Buruli Historique En 1948, MacCallum, bactériologiste australien, publie un article intitulé « A new mycobacterial infection in man » [
5]. Il décrit précisément six cas d’ulcère cutané à bords décollés et met en évidence de nombreux bacilles acido-alcoolo-résistants (BAAR) dans les tissus lésés [
30]. Leur isolement est difficile. En raison des lésions ulcératives qu’il provoque, le bacille sera nommé M. ulcerans [
6]. Toutefois, cette infection cutanée semble plus ancienne. En effet, en 1897, Sir Albert Ruskin Cook, jeune médecin anglais, décrit de larges ulcères cutanés aux bords décollés chez des patients ougandais, dont toutes les caractéristiques cliniques laissent supposer une infection à M. ulcerans. À partir des années 1950, de nombreux cas de cette nouvelle mycobactériose sont décrits en Afrique : au Congo, Janssens décrit une série de 170 patients [
7] ; en Ouganda, Clancey rapporte 40 patients, dont 28 proviennent du district de Buruli, la même région où les premiers cas ont été décrits 60 ans plus tôt par Cook. C’est à la suite de cette description initiale que la maladie prit le nom d’ulcère de Buruli [
8]. Mais l’ulcération n’est qu’un stade évolutif de la maladie, et l’appellation infection à Mycobacterium ulcerans semble plus appropriée [
9,
10]. Par la suite, le nombre de cas, le nombre de foyers et le nombre de pays touchés par cette maladie ne cesseront d’augmenter, essentiellement en Afrique de l’Ouest et en Afrique centrale, alors que le foyer historique ougandais s’est éteint. Épidémiologie En 1998, devant l’émergence de la maladie et ses conséquences socio-économiques dans les zones d’endémie [
11], l’Organisation mondiale de la santé (OMS) a décidé de s’engager dans la lutte contre l’infection à M. ulcerans. Les services sanitaires des États ont été incités à prendre en charge de façon effective cet important problème de santé publique. Cette maladie, à tropisme essentiellement cutané, est l’une des 17 maladies tropicales négligées reconnues par l’OMS (Figure 1). Elle est recensée aujourd’hui dans plus de 30 pays, principalement dans les régions tropicales et subtropicales humides (Figure 1). L’Afrique de l’Ouest et l’Afrique centrale sont les zones les plus touchées, puisque plus de 90 % des nouveaux patients diagnostiqués en 2010 étaient originaires de ces régions (entre 5 000 et 10 000 nouveaux cas par an selon l’OMS). Mais le recensement sous-estime certainement le nombre de cas puisque cette maladie n’est pas à déclaration obligatoire et qu’elle sévit dans les zones rurales isolées.
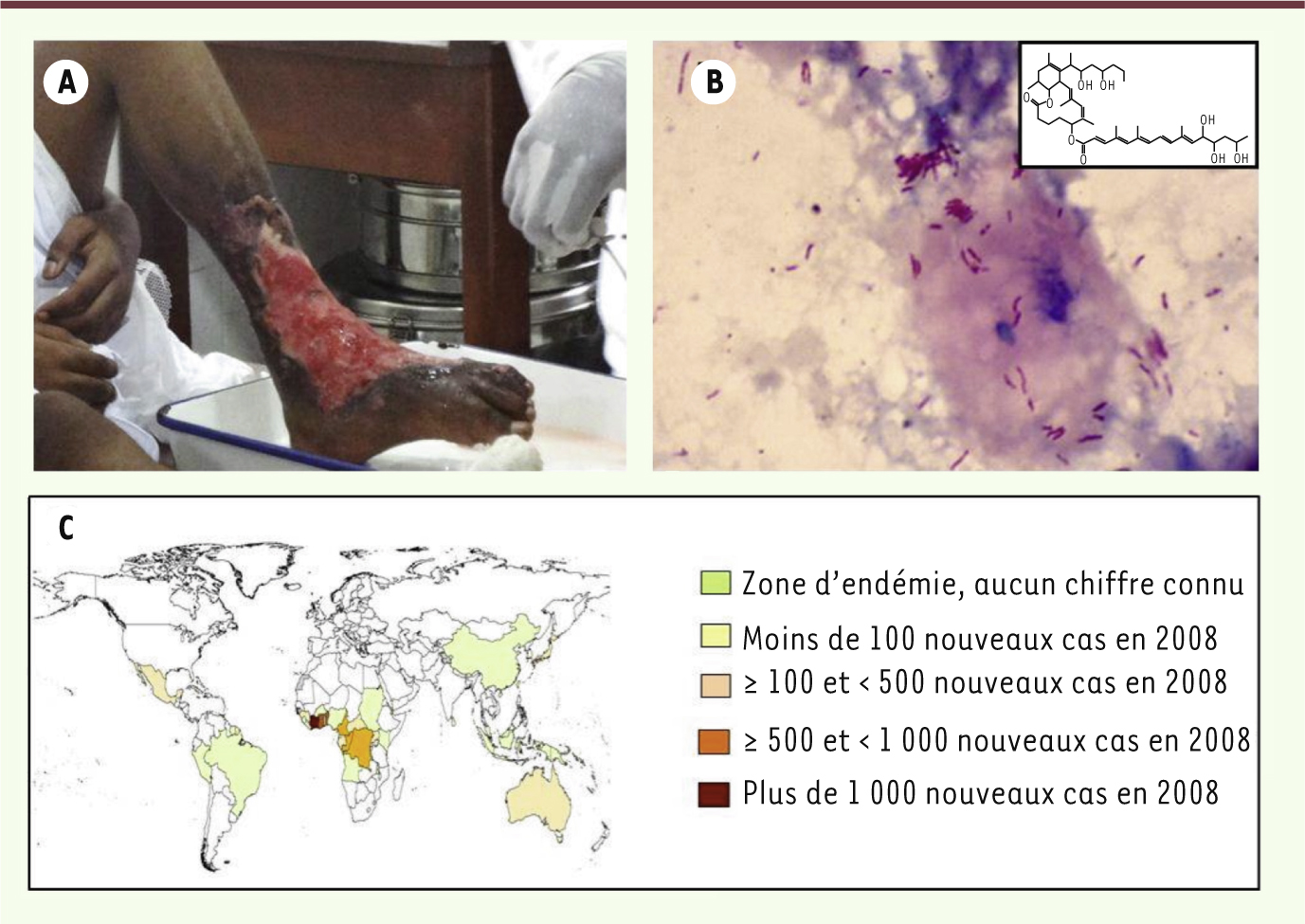
 | Figure 1.
L’ulcère de Buruli ou infection à M. ulcerans. A. L’infection à M. ulcerans provoque des ulcérations cutanées tout particulièrement sur les membres inférieurs. B.
M. ulcerans, agent étiologique de l’ulcère de Buruli, est un bacille acido-alcoolo résistant (BAAR) qui peut donc être mis en évidence dans des prélèvements cutanés après coloration de Ziehl-Neelsen. La mycolactone, qui est un polykétide, est le principal facteur de virulence de M. ulcerans (encart). C. L’infection à M. ulcerans est rapportée dans plus de trente pays dont la plupart se situent dans les zones intertropicales de l’Afrique. Crédits photographiques : © S. Eyangoh (A), © L. Marsollier (B) et © OMS (C) |
Les enfants sont principalement atteints ; plus de 50 % des patients atteints sont âgés de moins de 15 ans, et les deux sexes sont touchés de façon égale. Probablement en raison du mode de pénétration du bacille dans l’organisme, les lésions sont localisées le plus souvent au niveau des membres et tout particulièrement, au niveau des membres inférieurs. Il ne semble pas exister de relation entre infection à M. ulcerans et infection par le virus de l’immunodéficience humaine (VIH), à la différence de la plupart des autres mycobactérioses. Certains patients atteints de l’ulcère de Buruli et infectés par le VIH présentent des formes sévères avec atteinte osseuse, mais d’autres ont des formes plus classiques [
12,
13]. Le faible nombre de co-infections rapportées laisse ouverte la question de l’association VIH et ulcère de Buruli. C’est après une incubation de quelques semaines à plusieurs mois qu’apparaissent les premiers signes cliniques indolores, qui constituent la phase pré-ulcérative. Ils peuvent se présenter sous la forme d’une papule, d’un nodule, d’un œdème ou encore d’une plaque [
14]. Après plusieurs semaines, en l’absence de prise en charge, les lésions évoluent en une ulcération cutanée qui reste indolore malgré une extension qui peut être importante (Figure 1). Les destructions tissulaires sont causées par une toxine, la mycolactone, qui présente une activité cytotoxique et des propriétés immunomodulatrices (Figure 1) [1,
15,
16]. Jusqu’en 2004, la chirurgie - réalisant une exérèse large autour des tissus atteints - était l’unique traitement. Ce traitement était souvent suivi de rechutes des patients opérés (6 à 30 %). La prise en charge des patients a été considérablement améliorée grâce aux succès des recherches portant sur la sélection d’une antibiothérapie efficace [4,
17,
18]. Depuis 2005, l’OMS préconise un traitement par antibiothérapie associant deux antimycobactériens, la rifampicine et la streptomycine, complété, si besoin, par la chirurgie. Mode de transmission Contrairement aux bacilles tuberculeux et lépreux, il n’y a pas de transmission interhumaine de M. ulcerans. Le principal réservoir de M. ulcerans est situé dans l’environnement aquatique, et l’homme s’y contaminerait au cours de ses activités. L’ADN de M. ulcerans est détecté dans des organismes aquatiques variés, ce qui évoque la subsistance du bacille à travers différents maillons d’une chaîne trophique aquatique. Le bacille pourrait survivre chez des hôtes passifs et se multiplier et se concentrer chez des hôtes spécifiques. Plusieurs hypothèses de transmission à l’homme commencent à être formulées, dont les principales portent sur le rôle de punaises aquatiques. Des infections expérimentales ont montré qu’après un repas contaminant (larves de diptères), les punaises aquatiques de la famille des Naucoridae sont capables de transmettre le bacille à des souris lors d’une piqûre unique. Un résultat tout aussi important montre que le bacille est capable de coloniser les glandes salivaires des punaises et de s’y multiplier sans y provoquer de destruction tissulaire. Ce travail pionnier a démontré que les punaises aquatiques peuvent être des hôtes spécifiques et des vecteurs potentiels du bacille. Plusieurs études ont montré le rôle des punaises aquatiques dans l’écologie et la transmission du bacille [
19–
23]. |
L’Institut Pasteur et ses réseaux : un engagement dès les premières heures Il est difficile de déterminer avec exactitude le nombre de cas d’infection à M. ulcerans au Cameroun. Un nombre cumulatif de 3 363 cas de l’ulcère de Buruli a été notifié entre 2001 et 2011 dans les sites endémiques, notamment autour du bassin du Nyong dans la région Centre et à Bankim dans l’Adamaoua [
24–
26] (Figure 2). Cette maladie porte différentes dénominations en fonction des zones où elle sévit. Mais, à chaque fois, son nom est associé à la sorcellerie, démontrant ainsi la connotation mystique qu’on lui accorde [
27]. À titre d’exemple, dans la région d’Ayos/Akonolinga, elle est appelée Atom, signifiant sortilège.
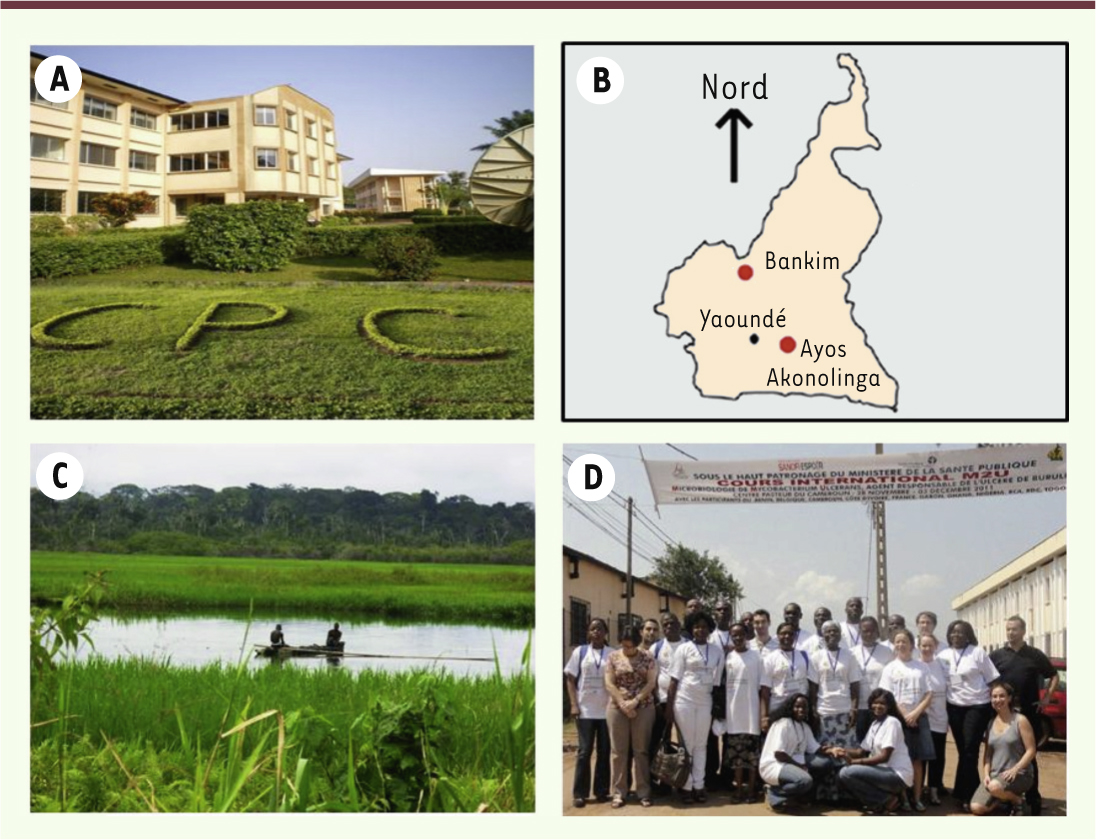
 | Figure 2.
Le centre Pasteur du Cameroun. A. Vue sur le bâtiment principal du centre Pasteur du Cameroun. Le centre Pasteur du Cameroun est placé sous la tutelle du ministère de la Santé du Cameroun. B. Les points rouges localisent les zones endémiques pour l’infection à M. ulcerans.
C. Vue sur le fleuve Nyong qui traverse la zone d’Ayos/Akonolinga. Il est très probable que le fleuve soit le réservoir du bacille. D. Promotion 2011 du cours international M2U, microbiologie de Mycobacterium ulcerans ; lors de cette session, 14 nationalités étaient représentées (enseignants et élèves). Crédits photographiques : © S. Eyangoh (A, D), © L. Marsollier (B) et © E. Marion (C). |
Devant l’émergence de cette maladie, dès le début des années 2000, l’Institut Pasteur, ses réseaux et ses partenaires se sont investis dans la lutte contre cette maladie. Plusieurs axes prioritaires ont été définis afin de développer les outils permettant d’étudier la biologie du bacille (séquençage du génome) et de comprendre l’histoire naturelle de l’infection à M. ulcerans. Dans ce contexte, depuis 10 ans, le centre Pasteur du Cameroun s’implique au côté du ministère de la Santé camerounais afin d’améliorer la prise en charge des malades et de renforcer la lutte à l’échelle nationale, en favorisant la surveillance. Depuis 2002, l’ulcère de Buruli est déclaré comme problème de santé publique au Cameroun. Le centre Pasteur du Cameroun (laboratoire national de santé publique et de recherche-membre du réseau international des Instituts Pasteurs) s’est alors mobilisé immédiatement pour accompagner les services de l’État dans la lutte contre l’ulcère de Buruli. Le centre Pasteur du Cameroun, créé en 1959, est placé sous la tutelle du ministère de la Santé du Cameroun (Figure 2). Sa principale mission est la lutte contre les maladies infectieuses, qu’il remplit en proposant des actions (1) de santé publique (diagnostic, surveillance, vaccinations), (2) de recherche (23 programmes de recherche en cours) et (3) de formation des équipes médicales et techniques. |
Les actions du centre Pasteur du Cameroun et du réseau des Instituts Pasteur Engagement dans le diagnostic et la surveillance Rapidement, le service de mycobactériologie du centre Pasteur a mis en place les techniques permettant un diagnostic rapide de M. ulcerans par amplification génique (méthode la plus sensible), faisant du Cameroun l’un des premiers pays endémiques où le diagnostic de M. ulcerans peut être proposé par PCR ( polymerase chain reaction). Grâce à ce diagnostic rapide et sensible, la prise en charge des patients a été fortement améliorée. Dès 2005, grâce au soutien obtenu auprès du réseau international des Instituts Pasteur (RIIP), une enquête épidémiologique a été diligentée afin de décrire précisément la situation de l’ulcère de Buruli au Cameroun. Cette étude a permis une mobilisation et une organisation adaptées des acteurs de santé locaux et nationaux. Engagement dans la formation du personnel de santé Dès 2006, grâce au soutien du RIIP et sous l’impulsion de Sara Eyangoh (responsable du laboratoire national de référence des mycobactéries du Cameroun), un enseignement spécifique sur l’ulcère de Buruli a été mis en place sous la forme d’un cours international de la microbiologie de M. ulcerans. Il était urgent de développer un tel enseignement réservé aux personnels de santé (médecins, coordinateurs, techniciens, ingénieurs, étudiants, etc.) des différents pays endémiques, afin de transmettre les connaissances et les outils pour organiser la lutte, mais aussi d’harmoniser les méthodes de diagnostic. En effet, l’ulcère de Buruli n’est pas - ou très rarement - au programme des études médicales et médico-techniques. Depuis 2006, quatre cours ont été organisés, formant ainsi 50 personnes de 11 nationalités différentes (Figure 2). De plus, cet enseignement a permis l’émergence de réseaux d’échanges entre les participants. Engagement dans la recherche Les travaux de recherche menés au sein du centre Pasteur du Cameroun (CPC) depuis cinq ans portent principalement sur l’épidémiologie et l’écologie de M. ulcerans. Cette recherche pionnière a été lancée afin de répondre aux attentes des populations et des acteurs de santé. Dès 2005, pour répondre aux besoins des services de santé du Cameroun et de l’OMS, le centre Pasteur du Cameroun, avec ses partenaires, a réalisé plusieurs études épidémiologiques et environnementales intégrées. Ces études ont permis d’obtenir une excellente cartographie des foyers de M. ulcerans et de découvrir deux nouvelles zones endémiques. Cette surveillance des zones à risque et des zones endémiques permet une adaptation des services de santé. Enquêtes épidémiologiques Une première enquête, qui avait pour objectif d’identifier des facteurs de risque et de protection, a été réalisée entre 2005 et 2007 à Ayos/Akonolinga. Cent soixante-huit patients ayant présenté des lésions à M. ulcerans dans les deux années précédentes, et autant de témoins non malades vivant dans les mêmes villages, ont été interrogés. Cette première enquête a confirmé, entre autres conclusions, que (1) le port de vêtements longs lors d’activités agricoles ou dans les zones marécageuses, et (2) l’hygiène et le soin des blessures, protégeaient contre l’apparition de lésions à M. ulcerans, et (3) que le contact avec les zones humides est le principal facteur de risque. Le résultat le plus original concerne l’utilisation de moustiquaires [ 24]. En effet, cette étude suggère qu’il y a une diminution du risque d’ulcère de Buruli pour les personnes dormant sous une moustiquaire. Cette protection par la moustiquaire nous a amenés à considérer plusieurs éventualités : (1) l’étude comporte des biais et l’effet moustiquaire est un artéfact, ou (2) il existe une transmission intradomiciliaire du bacille. Dans ce contexte, une deuxième enquête a été réalisée en 2009 sur le site de Bankim, au nord-est de Yaoundé, où la maladie avait été diagnostiquée pour la première fois en 2004. Dans cette région, à la frontière entre forêts et savanes, les conditions climatiques, géographiques, environnementales, ethniques et sociales sont très différentes de celles d’Ayos/Akonolinga. L’enquête, réalisée avec l’appui des personnels de l’hôpital de district de Bankim, a permis de retrouver et d’interroger 77 patients et 144 témoins. Les résultats ont montré à nouveau le rôle protecteur de la moustiquaire [
25]. L’identification à deux reprises de la moustiquaire comme facteur de protection contre l’ulcère de Buruli suggère qu’il existerait une transmission de M. ulcerans dans l’environnement domestique ou péridomestique. Pour clarifier cette question, notre consortium effectue actuellement une étude sur les insectes intra- et péridomiciliaires. En raison de leur impact potentiel bénéfique, nos résultats ont été rapidement diffusés aux populations des zones d’endémie lors de journées de sensibilisation via des messages dans les médias (Figure 3). Un film documentaire intitulé « Feu de nuit : ulcère de Buruli, entre sciences et croyances » a été réalisé en septembre 2009 par le Collectif interafricain de l’habitat (CIAH), grâce à la collaboration scientifique du centre Pasteur du Cameroun et au soutien financier du ministère des Affaires étrangères français (MAE), et via l’Institut pour la recherche et le développement (IRD) dans le cadre d’un projet sur la promotion de la culture scientifique par la valorisation des résultats de la recherche via l’éducation des populations.
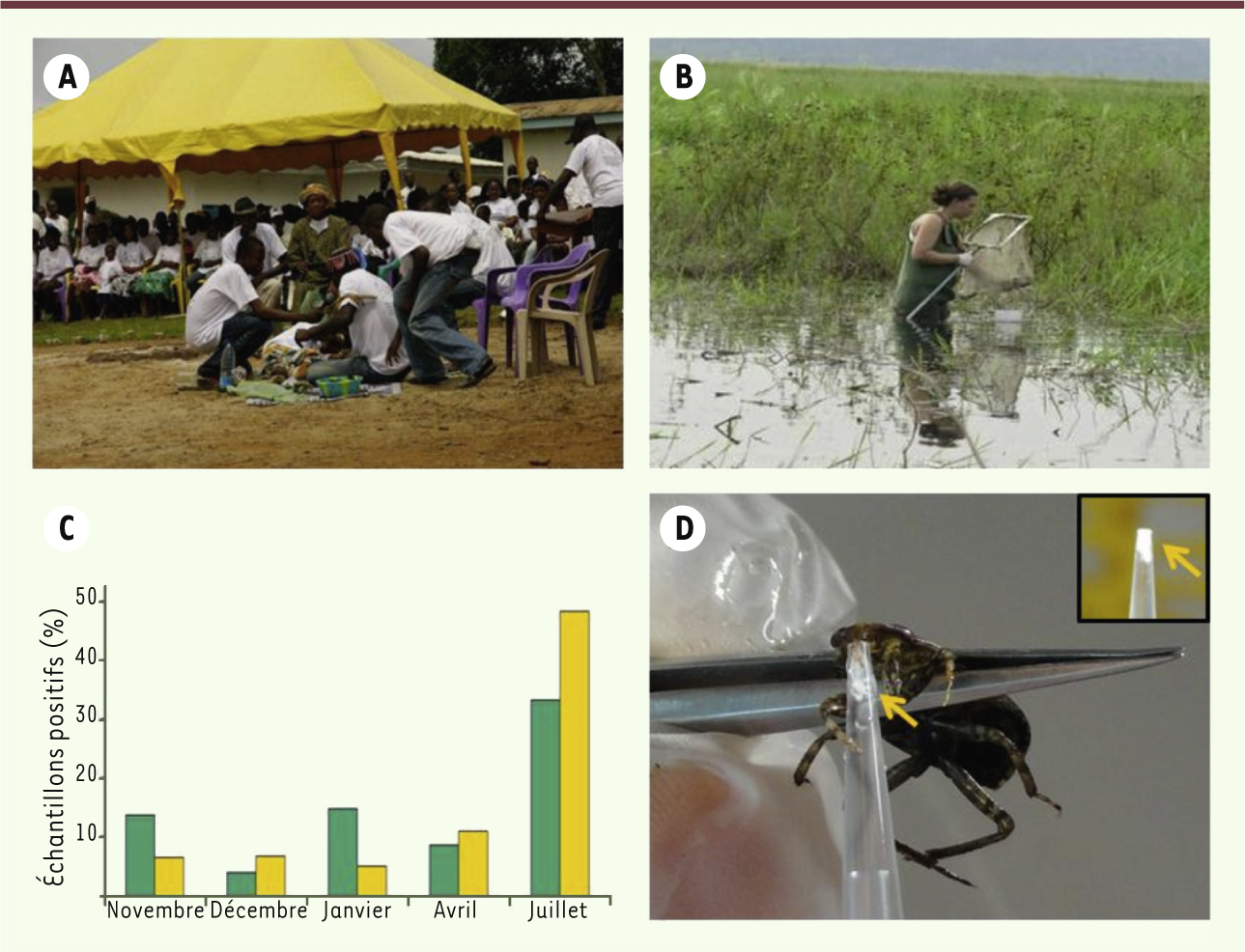
 | Figure 3.
Recherches épidémiologiques et environnementales réalisées au sein du réseau international des Instituts Pasteur (RIIP) afin de comprendre l’histoire naturelle de l’infection à M. ulcerans. A. Les résultats de l’enquête épidémiologique réalisée dans la zone d’Ayos/Akonolinga a permis d’identifier des facteurs protecteurs contre l’infection à M. ulcerans. Ces résultats ont été diffusés très rapidement auprès des populations. Cette photographie montre une pièce de théâtre mise en scène par d’anciens malades permettant de diffuser l’information. B.En parallèle des études épidémiologiques, des collectes environnementales ont été réalisées pour comprendre l’écologie du bacille. Notre première étude s’est focalisée sur le rôle des punaises aquatiques qui ont été capturées dans la végétation du fleuve Nyong. C. Cette étude a permis de montrer des variations saisonnières importantes dans le taux de colonisation des tissus (histogrammes verts) des hétéroptères aquatiques entre novembre 2007 et juillet 2008. De plus, il a été possible de détecter la présence du bacille dans la salive (histogramme jaune) de ces insectes. D. Méthode pour collecter la salive d’une punaise aquatique. La salive, fluide blanc (flèche jaune), est collectée dans un cône dans lequel le rostre piqueur suceur de l’insecte est introduit (encart). Par cette méthode, il est possible de collecter près de 2 µl de salive par individu (Appasus sp.). Crédits photographiques : © S. Eyangoh (A) et © E. Marion (B-D). |
Enquêtes environnementales L’originalité des études épidémiologiques conduites par le centre Pasteur du Cameroun est qu’elles associent des études environnementales. En effet, des collectes d’insectes dans l’environnement aquatique, ciblant tout particulièrement les punaises aquatiques, ont été réalisées afin d’élucider leur rôle dans l’écologie du bacille. Le manque de connaissances concernant ces insectes (biodiversité, écologie, etc.) explique que leur rôle in natura dans la transmission et l’écologie de M. ulcerans soit difficile à évaluer. À titre d’exemple, aucune étude ne s’était encore intéressée aux variations spatio-temporelles des punaises aquatiques dans une zone endémique où sévit l’ulcère de Buruli, ni aux variations de leur taux de colonisation par M. ulcerans. Ces informations pourraient être un premier jalon vers l’établissement de nouvelles stratégies préventives pour les populations exposées. Dans ce contexte, nous avons réalisé une étude de la biodiversité spatio-temporelle des punaises aquatiques dans le district d’Ayos/Akonolinga (Figure 3). Des signatures moléculaires de M. ulcerans ont été recherchées, par PCR quantitative, dans l’ensemble des échantillons (tissus) mais aussi dans la salive (puisque nous avons développé une méthode permettant de récolter le fluide salivaire) (Figure 3). Les signatures moléculaires de M. ulcerans dans les zones endémiques ont été retrouvées dans toutes les familles de punaises aquatiques. En revanche, elles n’ont jamais été détectées chez les insectes capturés dans les zones non endémiques. Le taux de colonisation des punaises par M. ulcerans varie au cours de l’année. Il est important de noter que de l’ADN de M. ulcerans a été détecté aussi dans des punaises aquatiques phytophages. Ce résultat conforte l’hypothèse selon laquelle M. ulcerans serait associé aux végétaux aquatiques, les punaises représentant un maillon dans la chaîne trophique de la bactérie [
28]. De plus, la détection de bacilles dans la salive est un résultat très important car, pour la première fois et in natura, la présence de bacilles viables a été détectée dans la salive d’insectes capables de piquer l’homme (Figure 3) [
29]. L’ensemble de nos résultats suggèrent qu’il y aurait des périodes plus favorables à la multiplication de M. ulcerans dans l’environnement et, donc, qu’il existerait des risques saisonniers d’exposition à cette bactérie. Mais l’importance du rôle des punaises comme vecteur de la maladie reste difficile à déterminer. Nos résultats ont été confirmés dans le site endémique de Bamkim [26]. L’identification des facteurs environnementaux favorisant le développement de M. ulcerans nécessitera l’exploration d’autres niches écologiques de cette bactérie (plantes aquatiques et autres invertébrés). |
Un esprit d’ouverture pour la réalisation de projets intégrés en accord avec les besoins des services de santé La compréhension de l’histoire naturelle de l’infection nécessite des approches multidisciplinaires intégrées (épidémiologie moléculaire, entomologie, système d’information géographique, etc.). Dans cet objectif, le centre Pasteur du Cameroun a su développer des collaborations étroites avec des partenaires de choix (Instituts Pasteur de Paris et de Séoul, l’Institut de recherche pour le développement [IRD], l’Inserm, les universités de Yaoundé [Cameroun], d’Angers [France] et de Monash [Australie]), spécialisés dans différents champs disciplinaires. Le fruit de cette collaboration a permis, entre autres, la création récente au sein du centre Pasteur du Cameroun d’une jeune équipe (équipe ATOMyc) associée à l’IRD. Notre consortium a reçu dernièrement le soutien de l’ANR (Agence nationale de la recherche) pour identifier les composantes environnementales favorisant le développement du bacille. Par son implication dans la recherche sur cette maladie, le centre Pasteur du Cameroun a participé à la formation de plusieurs doctorants. Ainsi, depuis 2007, six doctorants de quatre nationalités différentes réalisent ou ont réalisé leurs travaux sur l’ulcère de Buruli en partenariat avec le centre Pasteur du Cameroun. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
George
KM
,
Chatterjee
D
,
Gunawardana
G
, et al.
Mycolactone: a polyketide toxin from Mycobacterium ulcerans required for virulence . Science.
1999; ; 283 : :854.–857.
2.
Stinear
TP
,
Mve-Obiang
A
,
Small
PL
, et al.
Giant plasmid-encoded polyketide synthases produce the macrolide toxin of Mycobacterium ulcerans
. Proc Natl Acad Sci USA.
2004; ; 101 : :1345.–1349. 3.
Marsollier
L
,
Brodin
P
,
Jackson
M
, et al.
Impact of Mycobacterium ulcerans biofilm on transmissibility to ecological niches and Buruli ulcer pathogenesis . PLoS Pathog.
2007; ; 3 : :e62.. 4.
Marsollier
L
,
Prevot
G
,
Honore
N
, et al.
Susceptibility of Mycobacterium ulcerans to a combination of amikacin/rifampicin . Int J Antimicrob Agents.
2003; ; 22 : :562.–566. 5.
MacCallum
P
,
Tolhurst
JC
, et al.
A new mycobacterial infection in man . J Pathol Bacteriol.
1948; ; 60 : :93.–122. 6.
Tolhurst
JC
,
Buckle
G
. A new mycobacterial infection in man; experimental investigations in laboratory animals . J Pathol Bacteriol.
1948; ; 60 : :102.–110. 7.
Janssens
PG
,
Quertinmont
MJ
,
Sieniawski
J
,
Gatti
F
. Necrotic tropical ulcers and mycobacterial causative agents . Trop Geogr Med.
1959; ; 11 : :293.–312. 8.
Dodge
OG
,
Lunn
HF
. Buruli ulcer: a mycobacterial skin ulcer in a Uganda child . J Trop Med Hyg.
1962; ; 65 : :139.–142. 9.
Uganda Buruli Group . Epidemiology of Mycobacterium ulcerans infection (Buruli ulcer) at Kinyara, Uganda . Trans R Soc Trop Med Hyg.
1971; ; 65 : :763.–775.
10.
Uganda Buruli Group . Clinical features and treatment of pre-ulcerative Buruli lesions (Mycobacterium ulcerans infection). Report II of the Uganda Buruli Group . Br Med J.
1970; ; 2 : :390.–393.
11.
Asiedu
K
,
Etuaful
S
. Socioeconomic implications of Buruli ulcer in Ghana: a three-year review . Am J Trop Med Hyg.
1998; ; 59 : :1015.–1022. 12.
Toll
A
,
Gallardo
F
,
Ferran
M
, et al.
Aggressive multifocal Buruli ulcer with associated osteomyelitis in an HIV-positive patient . Clin Exp Dermatol.
2005; ; 30 : :649.–651. 13.
Delaporte
E
,
Savage
C
,
Alfandari
S
, et al.
Ulcère de Buruli chez une malade zaïroise infectée par le virus de l’immunodéficience humaine . Ann Dermatol Venereol.
1994; ; 121 : :557.–560. 14.
Asiedu
K
,
Sherpbier
R
,
Raviglione
MC.
, Buruli ulcer Mycobacterium ulcerans infection . WHO Global Buruli ulcer initiative. Report 2000. Geneva. , Switzerland: : World Health Organisation; , 2000.
15.
Fraga
AG
,
Cruz
A
,
Martins
TG
, et al.
Mycobacterium ulcerans triggers T-cell immunity followed by local and regional but not systemic immunosuppression . Infect Immun.
2010; ; 79 : :421.–430. 16.
Torrado
E
,
Adusumilli
S
,
Fraga
AG
, et al.
Mycolactone-mediated inhibition of tumor necrosis factor production by macrophages infected with Mycobacterium ulcerans has implications for the control of infection . Infect Immun.
2007; ; 75 : :3979.–3988. 17.
Etuaful
S
,
Carbonnelle
B
,
Grosset
J
, et al.
Efficacy of the combination rifampin-streptomycin in preventing growth of Mycobacterium ulcerans in early lesions of Buruli ulcer in humans . Antimicrob Agents Chemother.
2005; ; 49 : :3182.–3186. 18.
Chauty
A
,
Ardant
MF
,
Adeye
A
, et al.
Promising clinical efficacy of streptomycin-rifampin combination for treatment of Buruli ulcer (Mycobacterium ulcerans disease) . Antimicrob Agents Chemother.
2007; ; 51 : :4029.–4035. 19.
Marsollier
L
,
Deniaux
E
,
Brodin
P
, et al.
Protection against Mycobacterium ulcerans lesion development by exposure to aquatic insect saliva . PLoS Med.
2007; ; 4 : :e64.. 20.
Marsollier
L
,
Robert
R
,
Aubry
J
, et al.
Aquatic insects as a vector for Mycobacterium ulcerans
. Appl Environ Microbiol.
2002; ; 68 : :4623.–4628. 21.
Portaels
F
,
Elsen
P
,
Guimaraes-Peres
A
, et al.
Insects in the transmission of Mycobacterium ulcerans infection . Lancet.
1999; ; 353 : :986.. 22.
Portaels
F
,
Meyers
WM
,
Ablordey
A
, et al.
First cultivation and characterization of Mycobacterium ulcerans from the environment . PLoS Negl Trop Dis.
2008; ; 2 : :e178.. 23.
Wallace
JR
,
Gordon
MC
,
Hartsell
L
, et al.
Interaction of Mycobacterium ulcerans with mosquito species: implications for transmission and trophic relationships . Appl Environ Microbiol.
2010; ; 76 : :6215.–6222. 24.
Pouillot
R
,
Matias
G
,
Wondje
CM
, et al.
Risk factors for Buruli ulcer: a case control study in Cameroon . PLoS Negl Trop Dis.
2007; ; 1 : :e101.. 25.
Landier
J
,
Boisier
P
,
Fotso Piam
F
, et al.
Adequate wound care and use of bed nets as protective factors against Buruli ulcer: results from a case control study in Cameroon . PLoS Negl Trop Dis.
2011; ; 5 : :e1392.. 26.
Marion
E
,
Landier
J
,
Boisier
P
, et al.
Geographic expansion of Buruli ulcer disease, Cameroon . Emerg Infect Dis.
2011; ; 17 : :551.–553. 27.
Kibadi
K
,
Aujoulat
I
,
Meyers
WM
, et al.
Étude des appellations et des représentations attachées à l’infection à Mycobacterium ulcerans dans différents pays endémiques d’Afrique . Med Trop.
2007; ; 67 : :241.–248. 28.
Marsollier
L
,
Aubry
J
,
Milon
G
,
Brodin
P
. Punaises aquatiques et transmission de Mycobacterium ulcerans
. Med Sci (Paris).
2007; ; 23 : :572.–575. 29.
Marion
E
,
Eyangoh
S
,
Yeramian
E
, et al.
Seasonal and regional dynamics of M. ulcerans transmission in environmental context: deciphering the role of water bugs as hosts, vectors . PLoS Negl Trop Dis.
2010; ; 4 : :e731.. 30.
Mabèrou Houngbédji
G
,
Frenette
J
. L’ulcère de Buruli . Med Sci (Paris).
2011; ; 27 : :187.–192. |