 |
| |||
Med Sci (Paris). 2014 January; 30(1): 76–81. Published online 2014 January 24. doi: 10.1051/medsci/20143001017.La niche hématopoïétique de la drosophile Un modèle d’étude in vivo du microenvironnement contrôlant les cellules souches hématopoïétiques 1Centre de biologie du développement, UMR 5547 CNRS/UPS, Toulouse III, 118, route de Narbonne, 31062Toulouse Cedex 9, France Corresponding author. | ||||||
| ||||||
Les cellules souches jouent un rôle essentiel pour le maintien de l’homéostasie des tissus adultes. L’utilisation des cellules souches, un des espoirs de la médecine régénératrice, nécessite d’identifier et de caractériser les mécanismes moléculaires impliqués dans leur autorenouvellement, leur prolifération et leur différenciation. Il est maintenant acquis que le microenvironnement cellulaire, appelé niche, joue un rôle essentiel dans le contrôle de ces processus. Chez l’homme adulte, les cellules souches hématopoïétiques (CSH) résident dans la moelle osseuse où elles prolifèrent et se différencient en cellules des différents lignages sanguins : érythrocytaire, myéloïde, lymphoïde et mégacaryocytaire. Deux compartiments majeurs de la niche hématopoïétique sont la niche endostéale (proche de l’os) et la niche vasculaire, contenant différents types de cellules stromales sécrétant des facteurs solubles dans l’environnement des CSH [ 1– 6] (Figure 1). Cependant, bien que le concept de niche ait été proposé dès 1978 [ 7], les relations fonctionnelles entre niches et CSH restent mal connues. La découverte d’une « niche hématopoïétique » chez la drosophile ouvre de nouvelles possibilités pour étudier in vivo comment le microenvironnement contrôlant l’autorenouvellement et la différenciation des progéniteurs hématopoïétiques est lui-même régulé.
| ||||||
La majorité des gènes qui régulent l’hématopoïèse sont conservés au cours de l’évolution, de la drosophile aux vertébrés [ 8]. La redondance fonctionnelle entre gènes/protéines d’une même famille étant beaucoup moins importante chez la drosophile, ce modèle facilite les analyses fonctionnelles in vivo [ 9]. La drosophile présente aussi un temps de génération court et offre une panoplie de techniques génétiques sophistiquées. Enfin, alors que chez les vertébrés l’hématopoïèse adulte se situe dans la moelle osseuse, elle a lieu chez la drosophile dans un organe facilement accessible et manipulable in vivo : la glande lymphatique. | ||||||
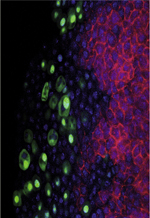
L’hématopoïèse de la drosophile, à l’origine des cellules sanguines (appelées hémocytes chez les insectes), se déroule en deux vagues successives au cours du développement (pour revue voir [ 10, 11]). - La première vague a lieu au stade embryonnaire à partir du mésoderme antérieur et est à l’origine de la spécification de deux types d’hémocytes circulants, apparentés au lignage myéloïde des vertébrés. Les plasmatocytes, équivalents fonctionnels des macrophages, sont impliqués dans la phagocytose. Les cellules à cristaux, fonctionnellement apparentées aux plaquettes, sont requises pour la cicatrisation et la mélanisation, une réaction spécifique aux arthropodes. - La seconde vague d’hématopoïèse a lieu au stade larvaire dans un organe hématopoïétique dédié, appelé glande lymphatique. Outre des plasmatocytes et des cellules à cristaux, un troisième type cellulaire, les lamellocytes, se différencient dans la glande lymphatique en réponse à un stress immun, tel que l’infection par des guêpes parasitoïdes, parasites naturels des drosophiles. Les lamellocytes sont de grandes cellules très adhérentes, qui encapsulent et neutralisent un pathogène trop gros pour être détruit par phagocytose. La glande lymphatique se désagrège au début de la métamorphose et ses cellules sont libérées dans la circulation [ 12]. Ainsi, au cours de la métamorphose et dans les mouches adultes, l’hémolymphe contient un mélange d’hémocytes d’origine embryonnaire et d’origine larvaire [ 13]. À ce jour, aucun processus hématopoïétique n’a été décrit au stade adulte. | ||||||
La glande lymphatique se forme au cours de l’embryogenèse, au contact du tube cardiaque qui est le système vasculaire de la mouche (Figure 2A). Au cours des trois stades larvaires successifs (durée totale de 96 h), la glande lymphatique augmente de taille. Au dernier stade larvaire, la glande est mature et les hémocytes se différencient. À ce stade, la glande est composée de deux lobes antérieurs (ou primaires) formés au stade embryonnaire, et d’une suite de plus petits lobes postérieurs (ou secondaires) formés au cours des stades larvaires [ 14]. Ces lobes secondaires correspondent à des réservoirs de progéniteurs hématopoïétiques (Figure 2B). Les lobes antérieurs comportent trois zones : la zone médullaire (ZM) qui contient les progéniteurs hématopoïétiques pluripotents ; la zone corticale (ZC), localisée au cortex de la glande, où se différencient les hémocytes ; et le PSC (posterior signaling center), un centre de signalisation localisé dans la partie postérieure et composé d’environ 30 cellules (Figure 2B) [ 15]. La spécification du PSC au cours de l’embryogenèse requiert la fonction du gène collier (col), qui code pour un facteur de transcription conservé au cours de l’évolution. Quatre gènes apparentés (orthologues) ont été identifiés chez les mammifères : les gènes early B-cell factor (ebf), dont deux, ebf1 et ebf2 sont impliqués dans l’hématopoïèse [ 16– 19]. L’analyse de mutants col a permis de montrer que le PSC est requis pour maintenir un pool de progéniteurs hématopoïétiques pluripotents dans la glande lymphatique [ 20, 21], une fonction similaire à celle de la niche des CSH chez les vertébrés. Le PSC de drosophile constitue donc un modèle de choix, complémentaire du modèle de la souris, pour étudier in vivo les mécanismes cellulaires et moléculaires impliqués dans la formation et la fonction de la niche hématopoïétique.
| ||||||
L’invalidation de gènes spécifiques du PSC ou de chacune des deux autres zones a montré que le PSC sécrète des signaux diffusibles, capables d’activer différentes voies de signalisation dans les autres compartiments de la glande lymphatique. Deux de ces signaux issus du PSC ont été bien caractérisés : le morphogène Hh (hedgehog) et le ligand PVF1 (platelet-derived growth factor/vascular endothelial growth factor-like factor) (Figure 2C). La perte de fonction dans le PSC des gènes hh ou pvf1 conduit à la différenciation prématurée des progéniteurs hématopoïétiques. Cependant, les cibles et communications cellulaires de ces deux signaux sont très différentes. Hh agit directement sur les progéniteurs de la ZM et est nécessaire au maintien de leur état progéniteur pluripotent [21]. PVF1 diffuse par exocytose à partir du PSC et agit, via son récepteur PDGF/VEGFR, dans les hémocytes en cours de différenciation. Il y stimule la sécrétion d’ADGF-A (adenosine deaminase-related growth factor-A), une enzyme modifiant l’adénosine extracellulaire. Cette modification conduit à l’inactivation de la voie de signalisation adénosine/AdoR (adenosine receptor) dans les cellules de la ZM. La voie AdoR régule positivement l’activité de la protéine kinase A (PKA), favorisant la différenciation, alors que la signalisation Hh inhibe l’activité PKA dans la ZM. Le contrôle positif de l’activité PKA par les cellules se différenciant, via la voie adénosine/AdoR, et négatif par le PSC, via la voie Hh, permet un maintien de l’équilibre entre progéniteurs et cellules différenciées [ 22]. D’autres études ont montré que la voie JAK (Janus kinase)/STAT (signal transducer and activator of transcription) est activée et nécessaire dans la ZM [ 23]. Ces données montrent que les communications entre le PSC et la ZM sont indispensables au maintien de l’équilibre entre cellules progéniteurs pluripotentes et cellules différenciées au sein de la glande lymphatique, et mettent en jeu de multiples voies de signalisation. | ||||||
La voie de signalisation BMP/Dpp contrôle le nombre de cellules de la niche hématopoïétique chez la drosophile La voie de signalisation BMP (bone morphogenetic protein), conservée au cours de l’évolution, est impliquée dans de nombreux processus biologiques [ 24– 26]. Cette voie est activée suite à la liaison d’un ligand de type TGFβ (transforming growth factor β) à un récepteur de type II, suivie du recrutement et de la phosphorylation d’un récepteur de type I. Le complexe récepteur type I plus II phosphorylé active par phosphorylation un facteur de transcription Smad (mothers against decapentaplegic homolog). Smad activé recrute un cofacteur, Smad4/Medea, puis devient nucléaire et active la transcription de ses gènes cibles (Figure 3A). Chez la drosophile, la voie BMP, appelée Dpp (decapentaplegic), comporte trois ligands (Dpp, glass bottom boat et screw), deux récepteurs de type I (thickvein [Tkv] et saxophone), deux récepteurs de type II (wishfull thinking [Wit] et Punt), un transactivateur Smad et son cofacteur Medea [ 25]. Au sein de la glande lymphatique, la voie Dpp est spécifiquement activée dans le PSC par liaison de Dpp à ses récepteurs Tkv et Wit [ 27]. L’inactivation génétique de la signalisation Dpp dans le PSC conduit à une augmentation considérable du nombre de cellules du PSC, montrant que la voie Dpp contrôle la prolifération des cellules du PSC (Figure 3B). Ce contrôle de la prolifération passe par la répression de l’expression de Dmyc, l’orthologue chez la drosophile du proto-oncogène Myc vertébré (Figure 3E). Il a été montré indépendamment que la voie de signalisation wingless (Wg/Wnt) [ 28] régule positivement le nombre de cellules du PSC, suggérant que le rapport entre les niveaux de signalisation Wnt et Dpp détermine la taille du PSC [27, 29]. L’étape suivante était de déterminer les conséquences du changement du nombre de cellules du PSC sur la différenciation des hémocytes (Figure 4A) [21, 27].
| ||||||
L’inactivation de la signalisation Dpp dans le PSC induit à la fois une augmentation du nombre des cellules du PSC et une perte de différenciation des hémocytes, indiquant que le contrôle de la taille du PSC est un paramètre essentiel de l’homéostasie hémocytaire dans la glande lymphatique (Figure 4A). L’expression de Hh n’est cependant pas affectée dans ces conditions [21], ce qui suggère que l’augmentation du nombre de cellules du PSC provoque une augmentation de la quantité de Hh total produit, qui conduit au maintien de toutes les cellules de la LG (hors PSC) à l’état de progéniteurs multipotents [27]. Une perte de fonction de col dans le PSC à partir du deuxième stade larvaire, après la phase de spécification dans l’embryon, conduit à une augmentation du nombre de cellules du PSC. Cette augmentation est corrélée à la perte d’activation de la voie BMP dans le PSC. Pourtant, contrairement à la simple inactivation de la voie Dpp, l’augmentation de la taille du PSC consécutive à l’absence de Col n’empêche pas la différenciation des hémocytes. D’où l’hypothèse que l’augmentation du nombre de cellules du PSC, en absence de Col, est compensée par une perte partielle de leur activité de signalisation (Figure 4). En accord avec cette hypothèse, l’expression de Hh dans les cellules du PSC est significativement diminuée dans des conditions de perte de fonction de Col. L’ensemble de ces données montre que le facteur de transcription Collier coordonne les programmes de prolifération et de signalisation des cellules de la niche hématopoïétique, et que cette coordination est un paramètre essentiel de l’hématopoïèse (Figure 4B). | ||||||
Bien que les données concernant la formation et la fonction de la niche hématopoïétique chez la drosophile et la souris restent fragmentaires, de nombreux parallèles peuvent déjà être établis entre ces deux organismes modèles. Ainsi, chez la souris, la perte de fonction du gène codant pour la β-caténine, facteur de transcription en aval de la voie Wg/Wnt, entraîne une diminution du nombre d’ostéoblastes [ 30]. Un phénotype comparable est observé chez la drosophile où l’inactivation du ligand Wg dans le PSC conduit à la réduction de la taille de ce dernier (Figure 4B) [27, 29]. Un second parallèle concerne l’implication de la voie BMP/Dpp requise pour le contrôle de la taille de la niche chez la drosophile. En effet, l’inactivation d’un récepteur de la voie de signalisation BMP (BMPR1A) dans les ostéoblastes conduit à une augmentation de leur nombre et, ainsi, du nombre de CSH [ 31]. Enfin, de nouveaux parallèles pourraient être établis sachant qu’EBF2 (early B-cell factor 2), l’un des orthologues murins de Col, est exprimé dans les ostéoblastes et est requis pour le maintien des CSH [ 32]. De la même manière, chez la drosophile, Col est requis pour le maintien des précurseurs hématopoïétiques. Cependant, le mécanisme impliqué demeure non élucidé et les interactions possibles entre EBF2 et les voies BMP et Wnt restent à établir. De même, une meilleure connaissance des voies de signalisation impliquées dans la communication entre la niche et les CSH chez les mammifères [33] permettra de déterminer si les voies de signalisation Hh et PDGF/VEGFR (platelet derived growth factor/vascular endothelial growth factor), impliquées dans ce processus chez la drosophile, jouent aussi un rôle dans la niche des vertébrés. | ||||||
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. | ||||||
Nous remercions L. Bataillé, J.L. Frendo, M. Meister et A. Vincent pour la lecture et la correction du manuscrit. Ce travail de recherche est financé par le CNRS, l’Université Toulouse III, le ministère de la Recherche (ANR-11 BSV2 00801), l’ARC (Association pour la recherche sur le cancer), la FRM (Fondation pour la recherche médicale ; DEQ 20090515429) et une bourse ARC pour I. Morin-Poulard. | ||||||
1.
Trumpp
A
,
Essers
M
,
Wilson
A
. Awakening dormant haematopoietic stem cells . Nat Rev Immunol.
2010; ; 10 : :201.–209. 2.
Morrison
SJ
,
Spradling
AC
. Stem cells and niches: mechanisms that promote stem cell maintenance throughout life . Cell.
2008; ; 132 : :598.–611. 3.
Levesque
JP
,
Helwani
FM
,
Winkler
IG
. The endosteal « osteoblastic » niche and its role in hematopoietic stem cell homing and mobilization . Leukemia.
2010; ; 24 : :1979.–1992. 4.
Lymperi
S
,
Ferraro
F
,
Scadden
DT
. The HSC niche concept has turned 31. Has our knowledge matured ?
Ann NY Acad Sci.
2010; ; 1192 : :12.–18. 5.
Mercier
FE
,
Ragu
C
,
Scadden
DT
. The bone marrow at the crossroads of blood and immunity . Nat Rev Immunol.
2012; ; 12 : :49.–60. 6.
Lataillade
JJ
,
Brunet de la Grange
P
,
Uzan
G
,
Le Bousse-Kerdilès
MC
. Les cellules souches ont-elles l’âge de leur niche ?
Med Sci (Paris).
2010; ; 26 : :582.–585. 7.
Schofield
R
. The relationship between the spleen colony-forming cell and the haemopoietic stem cell . Blood Cells.
1978; ; 4 : :7.–25. 8.
Martinez-Agosto
JA
,
Mikkola
HK
,
Hartenstein
V
,
Banerjee
U
. The hematopoietic stem cell and its niche: a comparative view . Genes Dev.
2007; ; 21 : :3044.–3060. 9.
Andriatsilavo
M
,
Gervais
L
,
Fons
C
,
Bardin
AJ
. L’intestin moyen de drosophile. Un nouveau modèle d’étude des cellules souches in vivo
. Med Sci (Paris).
2013; ; 29 : :75.–81. 11.
Lanot
R
,
Zachary
D
,
Holder
F
,
Meister
M
. Postembryonic hematopoiesis in Drosophila
. Dev Biol.
2001; ; 230 : :243.–257. 12.
Grigorian
M
,
Mandal
L
,
Hartenstein
V
. Hematopoiesis at the onset of metamorphosis: terminal differentiation and dissociation of the Drosophila lymph gland . Dev Genes Evol.
2011; ; 221 : :121.–131. 13.
Holz
A
,
Bossinger
B
,
Strasser
T
, et al.
The two origins of hemocytes in Drosophila
. Development.
2003; ; 130 : :4955.–4962. 14.
Krzemien
J
,
Crozatier
M
,
Vincent
A
. Ontogeny of the Drosophila larval hematopoietic organ, hemocyte homeostasis and the dedicated cellular immune response to parasitism . Int J Dev Biol.
2010; ; 54 : :1117.–1125. 15.
Jung
SH
,
Evans
CJ
,
Uemura
C
,
Banerjee
U
. The Drosophila lymph gland as a developmental model of hematopoiesis . Development.
2005; ; 132 : :2521.–2533. 16.
Wang
MM
,
Reed
RR
. Molecular cloning of the olfactory neuronal transcription factor Olf-1 by genetic selection in yeast . Nature.
1993; ; 364 : :121.–126. 17.
Hagman
J
,
Belanger
C
,
Travis
A
, et al.
Cloning and functional characterization of early B-cell factor, a regulator of lymphocyte-specific gene expression . Genes Dev.
1993; ; 7 : :760.–773. 18.
Hagman
J
,
Gutch
MJ
,
Lin
H
,
Grosschedl
R
. EBF contains a novel zinc coordination motif and multiple dimerization and transcriptional activation domains . EMBO J.
1995; ; 14 : :2907.–2916. 19.
Daburon
V
,
Mella
S
,
Plouhinec
JL
, et al.
The metazoan history of the COE transcription factors. Selection of a variant HLH motif by mandatory inclusion of a duplicated exon in vertebrates . BMC Evol Biol.
2008; ; 8 : :131.. 20.
Krzemien
J
,
Dubois
L
,
Makki
R
, et al.
Control of blood cell homeostasis in Drosophila larvae by the posterior signalling centre . Nature.
2007; ; 446 : :325.–328. 21.
Mandal
L
,
Martinez-Agosto
JA
,
Evans
CJ
, et al.
A Hedgehog- and Antennapedia-dependent niche maintains Drosophila haematopoietic precursors . Nature.
2007; ; 446 : :320.–324. 22.
Mondal
BC
,
Mukherjee
T
,
Mandal
L
, et al.
Interaction between differentiating cell- and niche-derived signals in hematopoietic progenitor maintenance . Cell.
2011; ; 147 : :1589.–1600. 23.
Makki
R
,
Meister
M
,
Pennetier
D
, et al.
A short receptor downregulates JAK/STAT signalling to control the Drosophila cellular immune response . PLoS Biol.
2010; ; 8 : :e1000441.. 24.
Harris
RE
,
Ashe
HL
. Cease and desist: modulating short-range Dpp signalling in the stem-cell niche . EMBO Rep.
2011; ; 12 : :519.–526. 25.
Affolter
M
,
Basler
K
. The decapentaplegic morphogen gradient: from pattern formation to growth regulation . Nat Rev Genet.
2007; ; 8 : :663.–674. 26.
Sagorny
K
,
Chapellier
M
,
Laperrousaz
B
,
Maguer-Satta
V
. BMP et cancer : le Yin et le Yang des cellules souches . Med Sci (Paris).
2012; ; 28 : :416.–422. 27.
Pennetier
D
,
Oyallon
J
,
Morin-Poulard
I
, et al.
Size control of the Drosophila hematopoietic niche by bone morphogenetic protein signaling reveals parallels with mammals . Proc Natl Acad Sci USA.
2012; ; 109 : :3389.–3394. 28.
Gilgenkrantz
H.
, Le monde selon YAP. Un dialogue perpétuel entre les voies Wnt et Hippo . Med Sci (Paris).
2013; ; 29 : :868.–874. 29.
Sinenko
SA
,
Mandal
L
,
Martinez-Agosto
JA
,
Banerjee
U
. Dual role of wingless signaling in stem-like hematopoietic precursor maintenance in Drosophila
. Dev Cell.
2009; ; 16 : :756.–763. 30.
Nemeth
MJ
,
Mak
KK
,
Yang
Y
,
Bodine
DM
. Beta-catenin expression in the bone marrow microenvironment is required for long-term maintenance of primitive hematopoietic cells . Stem Cells.
2009; ; 27 : :1109.–1119. 31.
Zhang
J
,
Niu
C
,
Ye
L
, et al.
Identification of the haematopoietic stem cell niche and control of the niche size . Nature.
2003; ; 425 : :836.–841. | ||||||