| |
| Med Sci (Paris). 2014 February; 30(2): 130–133. Published online 2014 February 24. doi: 10.1051/medsci/20143002005.Quand les microtubules rencontrent les puits recouverts de clathrine et permettent aux cellules de tenir le cap Guillaume Montagnac1,2* and Philippe Chavrier1,2** 1Institut Curie, Centre de Recherche, 26, rue d’Ulm, 75005Paris, France 2Dynamique de la membrane et du cytosquelette, CNRS UMR 144, 26, rue d’Ulm, 75005Paris, France MeSH keywords: Acétylation, Vésicules tapissées de clathrine, physiologie, Cellules HeLa, Humains, Microtubules, Tubuline, métabolisme |
Les microtubules représentent un des composants du cytosquelette. Ce sont des polymères de tubuline qui s’assemblent en tubes creux polarisés présentant une extrémité (-) généralement stable et ancrée au centrosome, et une extrémité (+) dynamique qui explore le cytosol en alternant des phases de polymérisation et de dépolymérisation. Organisés en réseau, ils interviennent dans de nombreux processus cellulaires tels que la division et la migration. Les microtubules subissent de nombreuses modifications post-traductionnelles qui modifient leurs propriétés physicochimiques. Une de ces modifications est l’acétylation de la tubuline, qui est associée à une plus longue durée de vie des microtubules [
1]. L’enzyme responsable de l’acétylation (une acétyl-transférase) est αTAT1 qui ne peut acétyler que la tubuline polymérisée en microtubule [
2,
3]. Une des caractéristiques étonnantes de l’acétylation de la tubuline est que cette modification n’affecte qu’une sous-population de microtubules. Comment les microtubules acétylés sont-ils sélectionnés est une question récurrente qui a attiré l’attention de nombreux biologistes cellulaires. |
Les microtubules sont acétylés au niveau des puits recouverts de clathrine Au cours d’une étude publiée récemment dans Nature [
4], nous avons mis en évidence que l’extrémité (+) en croissance de certains microtubules peut entrer en contact avec des structures présentes au niveau de la face interne de la membrane plasmique, les puits recouverts de clathrine. Ces structures représentent des invaginations de la membrane plasmique spécialisées dans l’endocytose et essentiellement constituées de clathrine ainsi que du complexe AP-2. Le complexe AP-2 est d’abord recruté à la membrane plasmique et recrute à son tour la clathrine, qui permet la déformation des puits dans lesquels s’accumulent les récepteurs membranaires destinés à être internalisés [
5]. Notre étude a montré qu’en absence du complexe AP-2, alors que la membrane plasmique est dépourvue de puits recouverts de clathrine, l’acétylation des microtubules était dramatiquement diminuée. En revanche, nous avons observé que l’absence de clathrine n’affecte pas l’acétylation des microtubules. En absence de clathrine, le complexe AP-2 reste enrichi au niveau de pseudo-puits dépourvus de clathrine et donc incapables d’invaginer la membrane plasmique et de contribuer à l’endocytose [
6]. Nous en avons conclu que ce n’est pas tant leur rôle dans l’endocytose, mais bien la présence des puits recouverts de clathrine (ou des pseudo-puits) à la membrane plasmique, qui est cruciale pour permettre l’acétylation des microtubules. En recherchant les mécanismes permettant aux puits recouverts de clathrine de contrôler l’acétylation des microtubules, nous avons découvert que αTAT1, l’acétyl-transférase des microtubules, était localisée au niveau des puits recouverts de clathrine où elle interagit directement avec le complexe AP-2. De plus, nous avons montré que l’interaction entre AP-2 et αTAT1 dans les puits recouverts de clathrine est nécessaire à l’acétylation. Enfin, dans des expériences où nous avons synchronisé la croissance des microtubules, nous avons observé que l’acétylation des microtubules démarre au niveau des puits recouverts de clathrine (Figure 1A). Ces résultats nous ont conduits à proposer un nouveau modèle dans lequel des microtubules en croissance venant contacter les puits recouverts de clathrine par leur extrémité (+) deviennent acétylés (Figure 1B). Ce modèle répond à la question de la sélectivité de l’acétylation puisque seuls les microtubules ayant contacté un puits recouvert de clathrine pourront être acétylés.
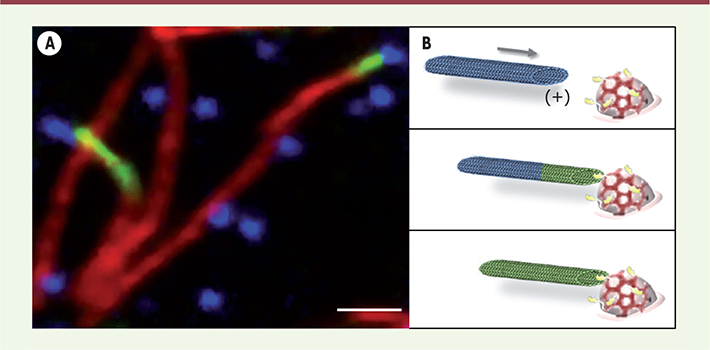
 | Figure 1.
L’acétylation des microtubules démarre au niveau des puits recouverts de clathrine. A. Des cellules HeLa ont été traitées par le Nocodazole, une drogue qui dépolymérise les microtubules, puis la drogue a été retirée pour permettre une re-croissance synchrone des microtubules. Après fixation et marquage, les cellules ont été observées au microscope à fluorescence. L’image montre une région d’une cellule dans laquelle des microtubules (en rouge) sont acétylés à leur extrémité (en vert) qui contacte un puits recouvert de clathrine (en bleu). Barre d’échelle : 2 μm. B. Modèle : un puits recouvert de clathrine (clathrine en rouge) enrichi en αTAT1 (en jaune) est contacté par l’extrémité (+) d’un microtubule en croissance (panneau du haut) et l’acétylation démarre à partir de cette extrémité (panneau du milieu) et se propage le long du microtubule (panneau du bas). |
|
Les puits recouverts de clathrine sculptent le réseau de microtubules Notre modèle implique que la distribution des puits recouverts de clathrine à la membrane plasmique est le facteur déterminant qui dicte à quel endroit de la cellule les microtubules seront acétylés. Dans la plupart des cellules, les puits recouverts de clathrine sont distribués de façon homogène et aléatoire à la membrane plasmique. Cependant, il n’en va pas de même au cours de la migration cellulaire, et nous avons confirmé des observations plus anciennes [
7] montrant que les puits recouverts de clathrine s’accumulent préférentiellement à l’avant des cellules cancéreuses en migration (Figure 2A). Cette distribution asymétrique des puits recouverts de clathrine est en soi remarquable et doit être mise en parallèle avec d’autres observations ayant établi que les microtubules acétylés sont essentiellement dirigés vers l’avant des cellules en migration [
8,
9]. Il est donc très vraisemblable que dans une cellule en migration, les microtubules en croissance ont davantage de chances de rencontrer des puits recouverts de clathrine à l’avant de la cellule, avec pour conséquence une accumulation de microtubules acétylés orientés vers le front de migration (Figure 2B).
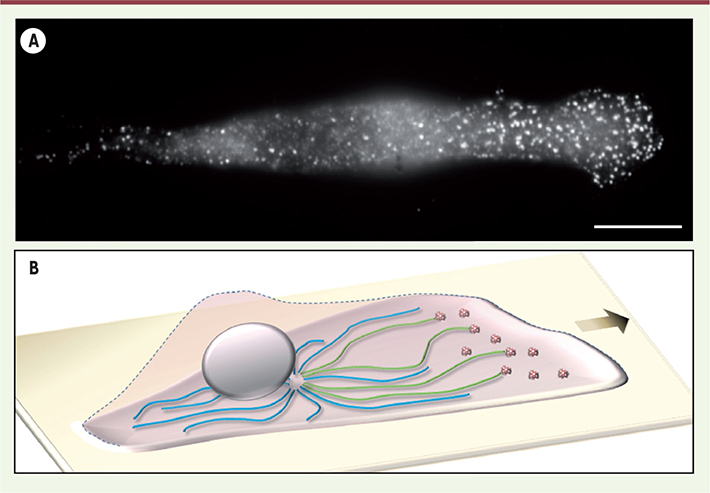
 | Figure 2.
La distribution des puits recouverts de clathrine dicte l’orientation des microtubules acétylés au cours de la migration. A. Marquage des puits recouverts de clathrine à l’aide d’un anticorps dirigé contre une sous-unité du complexe AP-2 dans une cellule MDA-MB-231 (adénocarcinome mammaire humain) ; la cellule se déplace vers la droite. Barre d’échelle : 10 µm. B. Modèle : les microtubules en croissance ont plus de chance de rencontrer des puits recouverts de clathrine à l’avant d’une cellule en migration où ces structures s’accumulent. En conséquence, les microtubules acétylés (en vert) sont préférentiellement orientés vers l’avant. |
Nous avons ensuite étudié les conséquences de cette acétylation asymétrique des microtubules sur les capacités de migration et d’invasion des cellules cancéreuses. Dans des expériences classiques de migration sur un substrat plan rigide (une lame de verre), nous avons observé qu’en absence du complexe AP-2 ou d’αTAT1, la vitesse de migration des cellules tumorales n’était pas perturbée. En revanche, la capacité de ces cellules à migrer de façon persistante dans une direction donnée était diminuée. Dans ces conditions, les cellules tumorales n’étaient plus capables de se déplacer en ligne droite sur de longues distances et changeaient fréquemment de direction. Là encore, nous avons pu montrer que l’interaction entre AP-2 et αTAT1 est absolument nécessaire pour une migration persistante. L’environnement des cellules cancéreuses est évidemment plus complexe que la lame de verre utilisée dans nos conditions expérimentales. Par exemple, après s’être échappées de la tumeur primaire, les cellules tumorales évoluent dans des environnements tridimensionnels essentiellement constitués de fibres de collagène. De plus, les cellules tumorales ne migrent pas de façon aléatoire, mais elles sont orientées par des gradients de molécules chimiotactiques, comme des cytokines ou des facteurs de croissance. De cette façon, les cellules tumorales sont capables de s’orienter pour rejoindre le système circulatoire et se disséminer dans l’organisme. Nous avons donc mis au point un système expérimental permettant d’établir un gradient de facteur de croissance épidermique (epidermal growth factor, EGF) dans un réseau tridimensionnel de fibres de collagène. Dans ces conditions, les cellules tumorales ont tendance à se déplacer en suivant le gradient d’EGF de façon relativement persistante. En revanche, et de façon semblable à nos observations en 2D, l’inactivation du complexe AP-2 ou d’αTAT1 dans cet environnement en 3 dimensions n’affecte pas la vitesse de déplacement des cellules, mais inhibe la persistance de la migration et altère le déplacement des cellules vers la source d’EGF. En résumé, nos travaux démontrent que l’accumulation des puits recouverts de clathrine au front de migration détermine une acétylation préférentielle des microtubules orientés vers l’avant, permettant aux cellules de maintenir leur cap. |
Des puits vers la lumière Ainsi, la façon dont sont distribués les puits recouverts de clathrine à la membrane plasmique permet de sculpter le réseau de microtubules pour une migration efficace et dirigée. Plusieurs questions restent cependant à élucider. En premier lieu, il va nous falloir comprendre pourquoi les puits recouverts de clathrine ne sont pas répartis de façon homogène dans les cellules en migration et pourquoi ils s’accumulent préférentiellement à l’avant. Une autre question centrale sera de comprendre comment les microtubules acétylés orientés vers l’avant des cellules permettent de maintenir la direction de migration ; une hypothèse qui a été proposée dans le passé suppose que ces microtubules acétylés et stabilisés servent de voies de transport à des composants cellulaires qui sont nécessaires à l’avant des cellules en migration. Enfin, une des particularités de l’acétylation est que le résidu cible d’αTAT1 sur la tubuline des microtubules est une lysine exposée à l’intérieur des tubes creux que constituent les microtubules [
10]. Ceci implique qu’αTAT1 doit pénétrer dans la lumière relativement exiguë de ces tubes (environ 16 nm de diamètre) afin d’acétyler la paroi interne des microtubules. Comment αTAT1 accède-t-elle à la lumière des microtubules après le contact avec un puits recouvert de clathrine, et comment l’acétylation se propage-t-elle le long du microtubule sont des questions dont les réponses devraient nous en apprendre plus sur la structure même des microtubules. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Perdiz
D
,
Mackeh
R
,
Pous
C
,
Baillet
A
. The ins and outs of tubulin acetylation: more than just a post-translational modification?
Cell Signal.
2011; ; 23 : :763.–771. 2.
Akella
JS
,
Wloga
D
,
Kim
J
, et al.
MEC-17 is an alpha-tubulin acetyltransferase . Nature.
2010; ; 467 : :218.–222. 3.
Shida
T
,
Cueva
JG
,
Xu
Z
, et al.
The major alpha-tubulin K40 acetyltransferase alphaTAT1 promotes rapid ciliogenesis and efficient mechanosensation . Proc Natl Acad Sci USA.
2010; ; 107 : :21517.–21522. 4.
Montagnac
G
,
Meas-Yedid
V
,
Irondelle
M
, et al.
alphaTAT1 catalyses microtubule acetylation at clathrin-coated pits . Nature.
2013; ; 502 : :567.–570. 5.
McMahon
HT
,
Boucrot
E
. Molecular mechanism and physiological functions of clathrin-mediated endocytosis . Nat Rev Mol Cell Biol.
2011; ; 12 : :517.–533. 6.
Hinrichsen
L
,
Harborth
J
,
Andrees
L
, et al.
Effect of clathrin heavy chain- and alpha-adaptin-specific small inhibitory RNAs on endocytic accessory proteins and receptor trafficking in HeLa cells . J Biol Chem.
2003; ; 278 : :45160.–45170. 7.
Rappoport
JZ
,
Simon
SM
. Real-time analysis of clathrin-mediated endocytosis during cell migration . J Cell Sci.
2003; ; 116 : :847.–855. 8.
Gundersen
GG
,
Bulinski
JC
. Selective stabilization of microtubules oriented toward the direction of cell migration . Proc Natl Acad Sci USA.
1988; ; 85 : :5946.–5950. 9.
Watanabe
T
,
Noritake
J
,
Kaibuchi
K
. Regulation of microtubules in cell migration . Trends Cell Biol.
2005; ; 15 : :76.–83. 10.
Nogales
E
,
Whittaker
M
,
Milligan
RA
,
Downing
KH
. High-resolution model of the microtubule . Cell.
1999; ; 96 : :79.–88. |