| |
| Med Sci (Paris). 2014 February; 30(2): 139–141. Published online 2014 February 24. doi: 10.1051/medsci/20143002008.Des maladies à prions à la maladie d’Alzheimer Une cible thérapeutique commune, PDK1 Mathéa Pietri,1 Aurélie Alleaume-Butaux,1 Jean-Marie Launay,2,3 Odile Kellermann,1 and Benoit Schneider1* 1Université Paris Descartes, Inserm UMR-S 747, Sorbonne Paris Cité, 45, rue des Saints-Pères, 75006Paris, France 2AP-HP, service de biochimie, Inserm UMR-S 942, 45, rue des Saints-Pères, 75006Paris, France 3Pharma research department, Hoffmann La Roche, Bâle, Suisse MeSH keywords: Protéines ADAM, métabolisme, Protéine ADAM17, Maladie d'Alzheimer, enzymologie, Antienzymes, usage thérapeutique, Humains, Maladies à prions, Protein-Serine-Threonine Kinases, antagonistes et inhibiteurs , physiologie |
Les maladies à prions forment un ensemble de maladies neurodégénératives dont l’évolution est toujours fatale. Ces maladies sont caractérisées par l’accumulation dans le cerveau de protéines pathologiques anormalement conformées, nommées protéine prion scrapie (PrPSc). C’est la conversion transconformationnelle d’une protéine endogène de l’hôte, la protéine prion cellulaire (PrPC), en PrPSc qui est à l’origine des maladies à prions. La PrPC est une sialoglycoprotéine ancrée à la membrane plasmique via un groupement glycosylphosphatidylinositol, qui, en tant que récepteur ou corécepteur, joue un rôle multifacette dans la signalisation cellulaire [
1,
2]. Le clivage de la PrPC par des α-sécrétases, entre les acides aminés 111 et 112, libère une forme amino-terminale tronquée qui n’est plus convertible en PrPSc et exerce un effet dominant négatif sur la réplication de la PrPSc [
3]. Dans la famille des α-sécrétases, la métalloprotéase TACE (TNFα [tumor necrosis factor] converting enzyme ou ADAM17) catalyse le clivage de la PrPC [
4] et exerce un rôle neuroprotecteur vis-à-vis des maladies à prions. La diminution progressive de la quantité de PrPC tronquée dans le cerveau des souris infectées par les prions suggère qu’un défaut d’activité TACE est associé à la progression de la maladie [
5]. Les mécanismes à l’origine du déficit d’activité TACE dans les maladies à prions étaient totalement inconnus. Nos travaux sur la dégénérescence neuronale induite par l’infection à prions ont permis de dévoiler un nouveau mécanisme de régulation de TACE, et de comprendre l’origine du défaut d’activité TACE dans les neurones infectés par la PrPSc [
6]. |
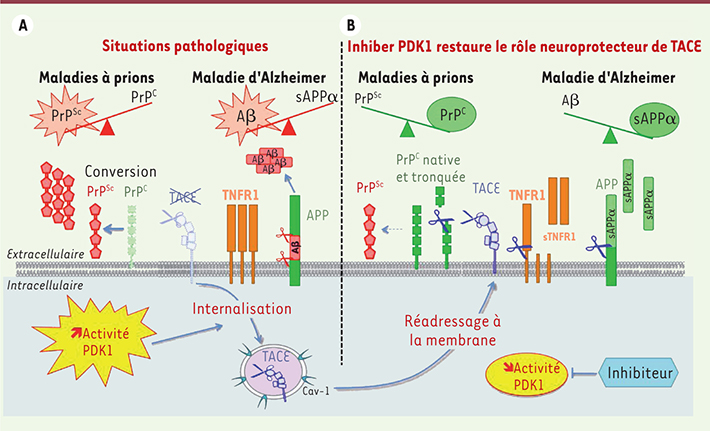
L’infection par les prions provoque l’internalisation de TACE et donc la perte de son activité de clivage Dans les neurones non infectés, TACE est présente à la membrane plasmique, où elle catalyse le clivage de la PrPC, mais aussi d’autres substrats comme les récepteurs de type 1 au facteur inflammatoire TNFα (TNFR1), ce qui confère aux neurones une sensibilité « physiologique » au TNFα. L’infection de la lignée neuronale murine 1C11, ou de cultures primaires de neurones en grain du cervelet, par la PrPSc délocalise TACE de la membrane plasmique vers des microvésicules enrichies en cavéoline de type 1 (cav-1), où TACE est internalisée (Figure 1). La PrPSc interfère donc avec les mécanismes de contrôle du trafic de TACE. L’internalisation de TACE découple l’α-sécrétase de ses substrats, dont TNFR1 et la PrPC. L’absence d’activité TACE α-sécrétase à la membrane plasmique empêche le clivage de TNFR1 et la libération de TNFR1 soluble (sTNFR1) dans le surnageant de culture des cellules infectées. L’augmentation (x 3) de la quantité de TNFR1 à la surface cellulaire rend les neurones infectés plus sensibles aux effets toxiques du TNFα. Quant à la perte du clivage de la PrPC en sa forme amino-terminale tronquée, elle favorise la réplication de la PrPSc dans les neurones infectés. L’internalisation et, en conséquence, la perte d’activité TACE induites par la PrPSc ont aussi été observées in vivo. Dans les souris infectées par les prions, l’accumulation de TNFR1 dans le cervelet et la diminution de sTNFR1 dans le liquide céphalo-rachidien (LCR) sont corrélées à l’augmentation des dépôts de PrPSc.
 | Figure 1.
Comment l’inhibition de PDK1 protège-t-elle de la neurodégénérescence associée aux maladies à prions et à la maladie d’Alzheimer ? A. En situation pathologique (maladies à prions, maladie d’Alzheimer), la suractivation de PDK1 dans les neurones provoque l’internalisation de l’α-sécrétase TACE. Le défaut de clivage par TACE participe à la neurodégénérescence en favorisant la formation de PrPSc, de peptides Aβ et une hypersensibilité au TNFα. B. L’inhibition de PDK1 permet de réadresser TACE à la surface des neurones et de restaurer ses clivages neuroprotecteurs. TACE diminue l’accumulation de PrPSc, la production d’Aβ et restaure une sensibilité « physiologique » au TNFα. |
|
La suractivation de la kinase PDK1 est responsable de l’internalisation de TACE dans les neurones infectés par les prions
In vitro, dans les neurones infectés, l’internalisation de TACE résulte de la suractivation (x 3) d’une kinase, la 3-phosphoinositide-dependent-kinase-1 (PDK1). La seule inhibition de PDK1 par un inhibiteur pharmacologique (BX912) permet de rediriger TACE, internalisée dans les microvésicules riches en cav-1 vers la membrane plasmique (Figure 1). La relocalisation de TACE à la surface cellulaire permet alors de rétablir l’activité neuroprotectrice de l’enzyme. Le clivage de la PrPC en sa forme amino-terminale tronquée non convertible en PrPSc est rétabli, ce qui limite l’accumulation des prions pathogènes. L’inhibition de PDK1 restaure également le clivage de TNFR1 en sTNFR1, permettant aux cellules infectées de retrouver une sensibilité normale au TNFα. |
Inhiber PDK1 permet de lutter contre les maladies à prions L’enjeu a ensuite été d’évaluer si PDK1 pouvait être une cible thérapeutique dans les maladies à prions. Chez les souris infectées, l’inactivation de PDK1 par BX912 ou par interférence ARN (siARN) allonge significativement la durée de vie des animaux. Des tests biochimiques révèlent une protection des neurones du cervelet contre la neurodégénérescence, et des tests comportementaux une réduction des déficits moteurs. La diminution des dépôts de PrPSc dans le cerveau et l’augmentation de sTNFR1 dans le LCR des souris infectées démontrent que l’effet bénéfique induit par l’inhibition de PDK1 est associé à un rétablissement de l’activité de clivage TACE α-sécrétase. |
Les maladies à prions et la maladie d’Alzheimer partagent des mécanismes communs de neurodégénérescence : une même cible thérapeutique… Dans la maladie d’Alzheimer, un défaut d’activité TACE α-sécrétase pourrait aussi contribuer à l’accumulation des peptides neurotoxiques Aβ (Aβ40 et Aβ42) et à la progression de la maladie [
7]. Les peptides Aβ sont produits à partir de la protéine précurseur des peptides amyloïdes (APP) par l’action consécutive des β- et γ-sécrétases [
8], alors que le clivage de APP entre les acides aminés 687 et 688 par l’α-sécrétase TACE empêche la formation des peptides Aβ et permet la libération du fragment soluble neuroprotecteur sAPPα. Des quantités faibles de sAPPα dans le LCR des patients souffrant de la maladie d’Alzheimer plaident en faveur d’un déficit d’activité TACE [
9]. à l’instar des résultats obtenus avec les neurones infectés par les prions, nos travaux in vitro et in vivo ont permis de mettre en évidence une augmentation de l’activité PDK1 associée à l’internalisation de TACE dans les neurones « Alzheimer », c’est-à-dire des neurones de souris affectés par les dépôts de peptides Aβ [6] (Figure 1). Le défaut d’activité TACE à la surface de ces neurones amplifie la production des peptides neurotoxiques Aβ et rend les neurones très vulnérables à la toxicité du TNFα. Comme nous l’avons décrit ci-dessus pour l’infection par les prions, l’inhibition de PDK1 par BX912 ou par un siARN dans les neurones « Alzheimer » permet de relocaliser TACE à la membrane plasmique, ce qui rétablit le clivage neuroprotecteur de APP en sAPPα et limite la production des peptides neurotoxiques Aβ40/42 (Figure 1). L’inhibition de PDK1 dans trois modèles de souris Alzheimer (Tg2576, 3xTg-AD, 5xTg-AD) permet de contrecarrer les déficits cognitifs et de mémoire associés à la maladie d’Alzheimer. À ce stade, une question majeure reste non résolue. Comment les peptides Aβ, ou la PrPSc, suractivent-ils PDK1 ? Les peptides Aβ, comme la PrPSc, se fixent à la protéine prion cellulaire non pathologique PrPC et dévient sa/ses fonctions de signalisation, ce qui est à l’origine de la neurodégénérescence [
10–
15]. Un indice important est que la suractivation de PDK1 dépend de la PrPC puisque l’extinction de la PrPC par un siARN dans les neurones « Alzheimer » in vitro et in vivo a le même effet bénéfique que l’inhibition de PDK1 par BX912. |
La maladie d’Alzheimer est actuellement la forme de démence la plus répandue. Elle touche 850 000 personnes en France. Diagnostiquer la maladie à des stades précoces et développer de nouvelles thérapies constituent un enjeu majeur de la future décennie. Concernant les maladies à prions, la découverte très récente d’un nombre conséquent de porteurs asymptomatiques de la PrPSc dans la population britannique [
16] renforce la nécessité de rechercher de nouvelles stratégies thérapeutiques. À l’heure actuelle, les traitements disponibles dans les maladies à prions et la maladie d’Alzheimer restent limités et peu efficaces. En démontrant que la seule inhibition de la kinase PDK1 est bénéfique dans les deux types de maladies, nos données offrent les premiers arguments en faveur de mécanismes communs de neurodégénérescence, qui font jouer au couple PDK1/TACE un rôle central. Il est important de noter qu’une suractivation de PDK1 associée à un défaut de clivage par TACE a été retrouvée dans le cerveau de patients atteints de la maladie d’Alzheimer [6]. PDK1 émerge donc comme une cible thérapeutique prometteuse dans ces maladies neurodégénératives. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Mouillet-Richard
S
,
Ermonval
M
,
Chebassier
C
, et al.
Signal transduction through prion protein . Science.
2000; ; 289 : :1925.–1928. 2.
Schneider
B
,
Pietri
M
,
Pradines
E
, et al.
Understanding the neurospecificity of Prion protein signaling . Front Biosci.
2011; ; 16 : :169.–186. 3.
Westergard
L
,
Turnbaugh
JA
,
Harris
DA
. A naturally occurring, C-terminal fragment of the prion protein delays disease and acts as a dominant negative inhibitor of PrPSc formation . J Biol Chem.
2011; ; 286 : :44234.–44242. 4.
Vincent
B
,
Paitel
E
,
Saftig
P
, et al.
The disintegrins ADAM10 and TACE contribute to the constitutive and phorbol ester-regulated normal cleavage of the cellular prion protein . J Biol Chem.
2001; ; 276 : :37743.–37746. 5.
Yadavalli
R
,
Guttmann
RP
,
Seward
T
, et al.
Calpain-dependent endoproteolytic cleavage of PrPSc modulates scrapie prion propagation . J Biol Chem.
2004; ; 279 : :21948.–21956. 6.
Pietri
M
,
Dakowski
C
,
Hannaoui
S
, et al.
PDK1 decreases TACE-mediated alpha-secretase activity and promotes disease progression in prion and Alzheimer’s diseases . Nat Med.
2013; ; 19 : :1124.–1131. 7.
Allinson
TM
,
Parkin
ET
,
Turner
AJ
,
Hooper
NM
. ADAMs family members as amyloid precursor protein alpha-secretases . J Neurosci Res.
2003; ; 74 : :342.–352. 8.
De Strooper
B
. Proteases and proteolysis in Alzheimer disease: a multifactorial view on the disease process . Physiol Rev.
2010; ; 90 : :465.–494. 9.
Sennvik
K
,
Fastbom
J
,
Blomberg
M
, et al.
Levels of alpha- and beta-secretase cleaved amyloid precursor protein in the cerebrospinal fluid of Alzheimer’s disease patients . Neurosci Lett.
2000; ; 278 : :169.–172. 10.
Pietri
M
,
Caprini
A
,
Mouillet-Richard
S
, et al.
Overstimulation of PrPC signaling pathways by prion peptide 106–126 causes oxidative injury of bioaminergic neuronal cells . J Biol Chem.
2006; ; 281 : :28470.–28479. 11.
Pradines
E
,
Hernandez-Rapp
J
,
Villa-Diaz
A
, et al.
Pathogenic prions deviate PrP(C) signaling in neuronal cells, impair A-beta clearance . Cell Death Dis.
2013; ; 4 : :e456.. 12.
Lauren
J
,
Gimbel
DA
,
Nygaard
HB
, et al.
Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers . Nature.
2009; ; 457 : :1128.–1132. 13.
Benilova
I
,
De Strooper
B
. Prion protein in Alzheimer’s pathogenesis: a hot and controversial issue . EMBO Mol Med.
2010; ; 2 : :289.–290. 14.
Um
JW
,
Nygaard
HB
,
Heiss
JK
, et al.
Alzheimer amyloid-beta oligomer bound to postsynaptic prion protein activates Fyn to impair neurons . Nat Neurosci.
2012; ; 15 : :1227.–1235. 15.
Larson
M
,
Sherman
MA
,
Amar
F
, et al.
The complex PrP(c)-Fyn couples human oligomeric Abeta with pathological tau changes in Alzheimer’s disease . J Neurosci.
2012; ; 32 : :16857.–1671a. 16.
Gill
ON
,
Spencer
Y
,
Richard-Loendt
A
, et al.
Prevalent abnormal prion protein in human appendixes after bovine spongiform encephalopathy epizootic: large scale survey . Br Med J.
2013; ; 347 : :f5675.. |