| |
| Med Sci (Paris). 2014 February; 30(2): 142–144. Published online 2014 February 24. doi: 10.1051/medsci/20143002009.La TSLP, clé du prurit dans la dermatite atopique Laurent Misery1* 1Laboratoire des neurosciences de Brest (EA4685), Université de Bretagne occidentale, service de dermatologie vénérologie, CHU de Brest, faculté de médecine, rue Camille Desmoulins, 29200Brest, France MeSH keywords: Cytokines, physiologie, Eczéma atopique, physiopathologie, thérapie, Ganglions sensitifs, Humains, Terminaisons nerveuses, Prurit |
TSLP et sensibilisation cutanée dans la dermatite atopique La dermatite atopique est une maladie fréquente dont la physiopathologie commence à être comprise [
1]. Elle se caractérise par un eczéma chronique, avec un prurit important et une sécheresse cutanée (xérose). Alors que l’on considérait jusqu’à une date récente que les anomalies de l’épiderme étaient une conséquence de l’activation des cellules immunitaires, il apparaît désormais plutôt que les anomalies de la barrière cutanée préexistent, et qu’elles peuvent induire une activation du système immunitaire initialement non spécifique. Le rôle de la thymic stromal lymphopoietin (TSLP) paraît crucial [
2]. Cette cytokine est produite par les kératinocytes et les mastocytes. Cette production est fortement augmentée au cours de la dermatite atopique et promeut l’initiation d’une réponse inflammatoire de type Th2 par les cellules dendritiques [2,
11]. La TSLP joue un rôle important dans la marche atopique (de la dermatite atopique vers l’asthme) puisque ses niveaux sont corrélés à la sensibilisation cutanée et à la sévérité de l’asthme chez la souris, alors que cette sensibilisation et ses conséquences cutanées et bronchiques sont fortement réduites chez les souris dont le gène codant pour la TSLP est invalidé (knocked-out) [
3]. Si le rôle des terminaisons nerveuses cutanées dans la dermatite atopique commence à être plus clair [
4], les raisons de la présence d’un prurit restaient assez mystérieuses [
5] alors qu’il s’agit d’un symptôme majeur au cours de cette maladie, à tel point qu’il est indispensable à sa définition. Contrairement à ce que l’on pensait initialement, l’histamine ne joue aucun rôle dans le prurit de la dermatite atopique puisque les anti-histaminiques (anti-H1 dirigés contre les récepteurs H1) n’ont aucune efficacité. Des travaux sont toutefois en cours à propos des anti-histaminiques dirigés contre les récepteurs de type H4. La découverte d’une deuxième sous-population de pruricepteurs (récepteurs spécifiques du prurit), indépendante de l’histamine [
6], a ouvert de nouvelles perspectives. Ces pruricepteurs expriment le récepteur PAR-2 (protease-activated receptor), activé par des sérine-protéases telles que la tryptase produite par les mastocytes. |
Rôle de la TSLP dans les terminaisons nerveuses des ganglions sensoriels Un remarquable article [
7] vient de montrer le rôle majeur de la TSLP dans le prurit au cours de la dermatite atopique, qui pouvait être suggéré par la corrélation entre l’activité de PAR-2 et l’expression de la TSLP dans la peau de patients ou dans celle de souris avec un modèle de dermatite atopique [
8]. Dans ce travail [7], Sarah Wilson et al. ont mis en évidence l’expression du récepteur de la TSLP (TSLPR) dans les ganglions sensoriels des souris. Ils ont montré que l’injection de TSLP dans la peau de souris saines induisait un prurit très important, objectivé par le grattage, et présent avec la même intensité chez des souris ne possédant pas de lymphocytes T ou B ou de mastocytes. Ces résultats suggèrent fortement un effet direct de la TSLP sur les neurones, sans qu’interviennent ni les lymphocytes ni les mastocytes, ni d’autres cytokines que ces cellules pourraient produire. Effectivement, la destruction des terminaisons nerveuses cutanées par injection de résinifératoxine empêchait l’induction d’un prurit par la TSLP. Le groupe de Diana Bautista a ensuite montré que les cellules des ganglions sensoriels étaient des neurones exprimant la périphérine, donc émettant des neurites de petit diamètre, en moyenne de 18 µm. Dans la peau, environ 10 % des fibres nerveuses (reconnues par un anticorps anti-PGP9.5) exprimaient TSLPR. L’imagerie calcique montrait que ces neurones étaient fonctionnels. Ces neurones pouvaient aussi être activés par la capsaïcine (via son récepteur TRPV1 [transient receptor potential vanilloide 1] [
12] et par l’isothiocyanate d’allyle (via son récepteur TRPA1 [transient receptor potential cation channel, subfamily A, member 1]). L’inhibition de TRPA1 et TRPV1 diminuait nettement la sensibilité neuronale à la TSLP. Chez des souris déficientes en une sous-unité de TSLPR (qui est aussi la chaîne α du récepteur de l’interleukine 7), le prurit induit par la TSLP était significativement réduit. Il était aboli chez des souris déficientes en TRPA1, mais inchangé chez des souris déficientes en TRPV1. Le couple TRPA1-TSLPR apparaît donc indispensable à l’induction d’un prurit par la TSLP. Les auteurs ont aussi montré que TRPA1 et TSLPR communiquaient via la phospholipase C, et que celle-ci était indispensable (Figure 1).
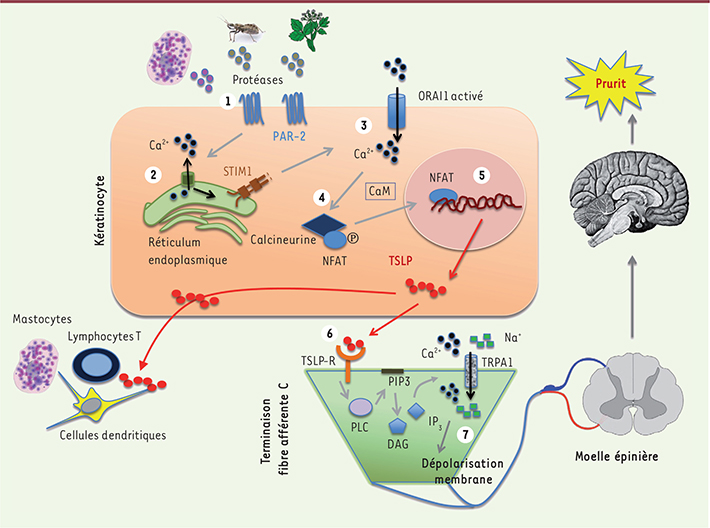
 | Figure 1.
Activation des pruricepteurs par la TSLP. Les différentes étapes de la synthèse de la TSLP dans les kératinocytes, puis de son action sur la terminaison de la fibre afférente sensorielle conduisant au prurit sont indiquées. 1. Activation de PAR-2 par des protéases au niveau des kératinocytes. 2. Activation intracellulaire. 3. Activation de ORAI1. 4. Activation de NFAT. 5. Transcription de TSLP puis synthèse et excrétion. 6. Liaison de TSLP à son récepteur sur les terminaisons nerveuses. 7. Transmission de la sensation de prurit (schéma inspiré de [
9] et réalisé par Laure Coulombel). |
L’étape suivante a consisté à montrer que le prurit induit par la tryptase (via PAR-2) était nettement atténué chez les souris n’exprimant pas IL7Rα et que la stimulation de PAR-2 induisait la libération de TSLP par les kératinocytes (Figure 1). Cette sécrétion était très dépendante du calcium et les récepteurs ORAI1 et STIM1 [
13] étaient alors requis. Enfin, les auteurs ont montré que l’activation de PAR-2 induisait une translocation de NFAT (nuclear factor of activated T cells) et une sécrétion de TSLP dépendante du calcium. Cet article majeur permet de comprendre comment le prurit apparaît au cours de la dermatite atopique et permet de relier enfin les phénomènes inflammatoires et prurigineux au cours de cette maladie. Il confirme que ce prurit est bien lié à PAR-2, de manière totalement indépendante de l’histamine, et montre que la TSLP est une cytokine clé dans ce prurit, par l’intermédiaire de son récepteur spécifique qui est présent sur les neurones (Figure 1), et sans intervention des lymphocytes. Il permet de comprendre pourquoi les patients atteints de dermatite atopique ont souvent un prurit avant même d’avoir des lésions d’eczéma [9]. |
Perspectives thérapeutiques La démonstration de l’indispensable présence de TRPA1 et de la fine mécanique cellulaire dépendant du calcium dans cette étude assez exhaustive permet d’envisager de nouvelles pistes thérapeutiques. En particulier, cela montre que les effets de la ciclosporine sur le prurit de la dermatite atopique ne sont pas seulement liés à ses effets immunosuppresseurs, mais aussi à des effets directs sur les neurones, puisque la ciclosporine est un inhibiteur de la transcription médiée par NFAT. Il en est probablement de même pour d’autres inhibiteurs de la calcineurine, tels que le tacrolimus, immunosuppresseur qui a des effets directs sur les neurones [
10]. Comme il existe des terminaisons nerveuses exprimant TRPA1 dans les bronches et l’intestin, et que l’activation de TRPA1 est connue pour induire une inflammation, cette étude suggère que les interactions neuro-épithéliales, comme les interactions immuno-épithéliales, pourraient être impliquées dans la marche atopique. Ainsi, la mise en évidence du rôle de la TSLP dans la dermatite atopique et son prurit, ainsi que du rôle des neurones, ouvre de nombreuses pistes. Il reste à savoir quelle est la part de la TSLP par rapport à d’autres cytokines et quelle est l’importance relative du système nerveux. |
L’auteur déclare avoir des liens d’intérêt avec des entreprises travaillant sur le prurit et/ou la dermatite atopique : Almirall, Astellas, BASF, Bioderma, Galderma, GSK, Maruho, Novartis, Pierre Fabre, Uriage.
|
1.
Misery
L
. Atopic dermatitis: new trends and perspectives . Clin Rev Allerg Immunol.
2011; ; 41 : :296.–297. 2.
Carmi-Levy
I
,
Homey
B
,
Soumelis
V
. A modular view of cytokine networks in atopic dermatitis . Clin Rev Allerg Immunol.
2011; ; 41 : :245.–253. 3.
Leyva-Castillo
JM
,
Hener
P
,
Jiang
H
,
Li
M
. TSLP produced by keratinocytes promotes allergen sensitization through skin and thereby triggers atopic march in mice . J Invest Dermatol.
2013; ; 133 : :154.–163. 4.
Misery
L
. Atopic dermatitis and the nervous system . Clin Rev Allerg Immunol.
2011; ; 41 : :259.–266. 5.
Darsow
U
,
Pfab
F
,
Valet
M
, et al.
Pruritus and atopic dermatitis . Clin Rev Allerg Immunol.
2011; ; 41 : :237.–244. 6.
Steinhoff
M
,
Neisius
U
,
Ikoma
A
, et al.
Proteinase-acivated receptor-2 mediates itch: a novel pathway for pruritus in human skin . J Neurosci.
2003; ; 23 : :6176.–6180. 7.
Wilson
SR
,
Thé
L
,
Batia
LM
, et al.
The epithelial-cell derived atopic dermatitis cytokine TSLP activates neurons to induce itch . Cell.
2013; ; 155 : :285.–295. 8.
Hovnanian
A
. Netherton syndrome: skin inflammation and allergy by loss of protease inhibition . Cell Tissue Res.
2013; ; 351 : :289.–300. 9.
Elmariah
SB
,
Lerner
EA
. The missing link between itch and inflammation in atopic dermatitis . Cell.
2013; ; 155 : :267.–269. 10.
Pereira
U
,
Boulais
N
,
Lebonvallet
N
, et al.
Mechanisms of the sensory effects of tacrolimus on the skin . Br J Dermatol.
2010; ; 163 : :70.–77. 11.
Soumelis
V
. La lymphopoïétine stromale thymique (TSLP) . Med Sci (Paris).
2007; ; 23 : :692.–694. 12.
Danigo
A
,
Magy
L
,
Demiot
C
. TRPV1 dans les neuropathies douloureuses : des modèles animaux aux perspectives thérapeutiques . Med Sci (Paris).
2013; ; 29 : :597.–606. 13.
Le Deist
F
,
Capiod
T
. Immunodéficiences et pathologies associées aux mutations dans STIM/ORAI . Med Sci (Paris).
2011; ; 27 : :737.–745. |