| |
| Med Sci (Paris). 2014 March; 30(3): 248–250. Published online 2014 March 31. doi: 10.1051/medsci/20143003010.Arpin, un nouvel inhibiteur du complexe Arp2/3, contrôle la migration cellulaire Roman Gorelik,1 Irène Dang,1 and Alexis Gautreau1* 1Laboratoire d’enzymologie et de biochimie structurales CNRS UPR3082, Bâtiment 34, avenue de la terrasse, 91198Gif-sur-Yvette Cedex, France MeSH keywords: Complexe Arp-2-3, antagonistes et inhibiteurs , Tumeurs du sein, métabolisme, anatomopathologie, Mouvement cellulaire, effets des médicaments et des substances chimiques, Femelle, Humains, Invasion tumorale, Pseudopodes, Protéines recombinantes, pharmacologie |
La protrusion de la membrane plasmique dépend de la formation de réseaux d’actine branchée Les cellules qui migrent sont polarisées. Au front de migration, la membrane plasmique s’étale sur le substrat dans une structure appelée lamellipode. La protrusion du lamellipode est due à la force générée par la polymérisation d’une protéine fibreuse, l’actine. Au lamellipode, les réseaux d’actine sont branchés, et ce, grâce à une machine moléculaire, appelée complexe Arp2/3 [
1]. Cette machine est activée à l’extrémité du lamellipode par la molécule Wave. Cet activateur, comme les autres activateurs du complexe Arp2/3, contient une extrémité carboxy-terminale comprenant un motif WH2 interagissant avec l’actine, et un motif acide interagissant avec le complexe Arp2/3 [
2]. Ces deux motifs sont absolument essentiels à l’activation du complexe Arp2/3. Wave est lui-même un composant d’une autre machine moléculaire, le complexe Wave, qui contient aussi une sous-unité effectrice de l’interrupteur moléculaire, Rac [
3]. Rac est une petite GTPase qui, sous sa forme active liée au GTP, déclenche la formation des lamellipodes. Cette voie de signalisation qui aboutit à la polymérisation d’actine, donc à la génération de force et ainsi à la protrusion membranaire, est particulièrement bien comprise (Figure 1).
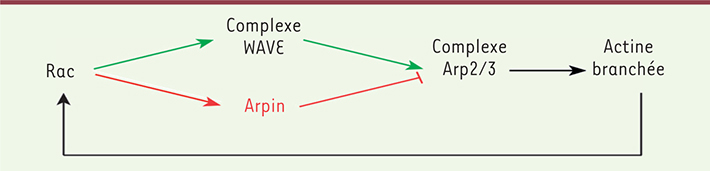
 | Figure 1.
Circuit de signalisation de la polymérisation d’actine branchée au lamellipode. En aval de Rac, il existe une voie activatrice d’Arp2/3 qui passe par Wave, et une voie inhibitrice qui passe par Arpin. Ces deux voies contradictoires génèrent une incoherent feedforward loop. Quand la migration est efficace, le lamellipode à l’avant de la cellule est maintenu au cours du temps grâce à une boucle de rétroaction qui détecte l’actine branchée et qui active Rac en réponse. |
Cependant, la migration cellulaire est finement régulée en termes de vitesse et de direction. Et cette unique voie de signalisation nous semblait insuffisante pour rendre compte de ces régulations. Nous avons donc décidé de chercher s’il existait de nouvelles protéines régulant le moteur de la protrusion membranaire, le complexe Arp2/3. |
Identification d’une nouvelle molécule qui inhibe le complexe Arp2/3 in vitro
Nous avons écrit un programme qui recherchait dans les bases de données toutes les protéines contenant un motif acide à leur extrémité carboxy-terminale. Ce programme a permis d’identifier une protéine non caractérisée au milieu des activateurs connus du complexe Arp2/3. Cette protéine ne possède pas le motif WH2, essentiel lui aussi à l’activation du complexe Arp2/3. A.G. a appelé cette protéine Arpin en hommage à sa directrice de thèse, Monique Arpin. Dans des tests in vitro de polymérisation d’actine et de formation de réseaux branchés, Arpin est apparue comme inhibant le complexe Arp2/3, ce qui était en accord avec l’absence de motif WH2. En fait, Arpin est un inhibiteur compétitif de l’activateur grâce à son motif acide. « Arpin » s’est donc avéré un nom mnémotechnique de l’activité de la protéine : Arp2/3
inhibition… Mais dans la cellule, le complexe Arp2/3 exerce différentes fonctions au niveau de la membrane plasmique ou de différents compartiments intracellulaires. Nous avons donc ensuite cherché à caractériser dans quel site cellulaire Arpin exerce sa fonction inhibitrice. |
Arpin inhibe localement la protrusion des lamellipodes Nous avons localisé Arpin à l’extrémité du lamellipode, suggérant que la protéine joue un rôle dans la migration cellulaire. Il était cependant surprenant de trouver un inhibiteur de la polymérisation d’actine exactement là où l’actine est polymérisée ! Nous avons donc cherché à déterminer si l’interaction d’Arpin avec le complexe Arp2/3 dépendait de Rac ; effectivement, Arpin perd son interaction avec Arp2/3 dans des cellules dépourvues (knock-out) de Rac qui sont incapables de générer des lamellipodes [
4]. Finalement, nous avons inhibé par interférence à l’ARN l’expression d’Arpin dans les cellules et observé que les lamellipodes progressaient alors plus vite, ce qui confirme le rôle inhibiteur d’Arpin localisée à l’extrémité du lamellipode. Intuitivement, on anticipe une signalisation activatrice locale associée à une inhibition globale de la polymérisation d’actine pour que se forme un lamellipode à l’avant de la cellule. Cependant, nos résultats indiquent de manière non ambiguë qu’Arpin est un inhibiteur local du complexe Arp2/3. De manière surprenante, Rac, qui déclenche la formation des lamellipodes grâce à l’activation d’Arp2/3 par Wave, déclenche aussi l’inhibition d’Arp2/3 par Arpin. Un tel circuit est qualifié d’incoherent feedforward loop. Ce n’est pas une rétroaction, parce qu’il y a deux voies pour aller de l’avant, de Rac à Arp2/3 (Figure 1), mais ces voies sont incohérentes en ce qu’elles délivrent des signaux contradictoires. En fait, ce type de circuit paradoxal est répandu dans les réseaux de transcription, où il régule la temporalité de la réponse [
5]. Typiquement, il produit une réponse transitoire, une courbe « en cloche », en réponse à une stimulation. Mais est-ce que ce circuit est important pour la migration cellulaire ? |
Arpin est le frein et le volant de la migration cellulaire Nous avons examiné des embryons de poisson-zèbre, dans lesquels nous avions marqué les cellules de la plaque préchordale, qui migrent de manière concertée lors de la gastrulation. En l’absence d’Arpin, ces cellules migrent d’une manière moins ordonnée. La greffe des cellules de la plaque préchordale dépourvues d’Arpin chez un embryon receveur sauvage a permis de montrer que les protrusions de ces cellules sont présentes plus longtemps, en accord avec l’hypothèse d’une régulation de la temporalité de la réponse par Arpin. De plus, cette expérience révélait un défaut des cellules en migration, qui n’était pas détecté dans les autres cellules de l’embryon. Ce défaut, qui est intrinsèque à la cellule, justifie une étude détaillée des paramètres de migration qu’Arpin contrôle dans des cultures de cellules isolées. Lorsque nous avons inactivé l’expression d’Arpin par interférence à l’ARN dans des cellules de mammifère ou par knock-out dans l’amibe Dictyostelium, nous avons observé les mêmes conséquences : les cellules migraient plus vite et suivaient une trajectoire plus rectiligne. Pour analyser les conséquences de la réintroduction de l’activité d’Arpin, nous avons donc sélectionné le modèle cellulaire le plus rapide et le plus stable dans sa direction, le kératocyte de poisson. Nous avons micro-injecté ces cellules primaires avec de l’Arpin recombinante. En réponse à l’introduction d’Arpin, des lamellipodes continuent à se former, mais ils deviennent extrêmement instables. Par conséquent, les kératocytes ralentissent et changent de direction, puisque le lamellipode est la structure qui définit l’avant de la cellule. Le maintien d’une direction donnée au cours du temps dépend d’une boucle de rétroaction qui détecte où les réseaux d’actine branchés sont formés et, en réponse, active localement Rac [
6,
7]. Dans le kératocyte intervient donc probablement une signalisation par rétroaction positive dynamique qui permet une migration efficace, à la fois dans sa vitesse et sa direction. Quand Arpin est injectée, cette boucle régulatrice peut bifurquer, en aval de Rac, sur la voie Arpin qui s’oppose à cette boucle de rétroaction positive passant par Wave (Figure 2). Ce circuit complexe permet de prédire que quand la boucle de rétroaction rencontre l’incoherent feedforward loop (voir plus haut), des courbes en cloches successives sont générées [
8,
9]. Et effectivement, des oscillations du lamellipode – successions périodiques de protrusions suivies de rétraction – ont été détectées dans les kératocytes injectés avec de l’Arpin.
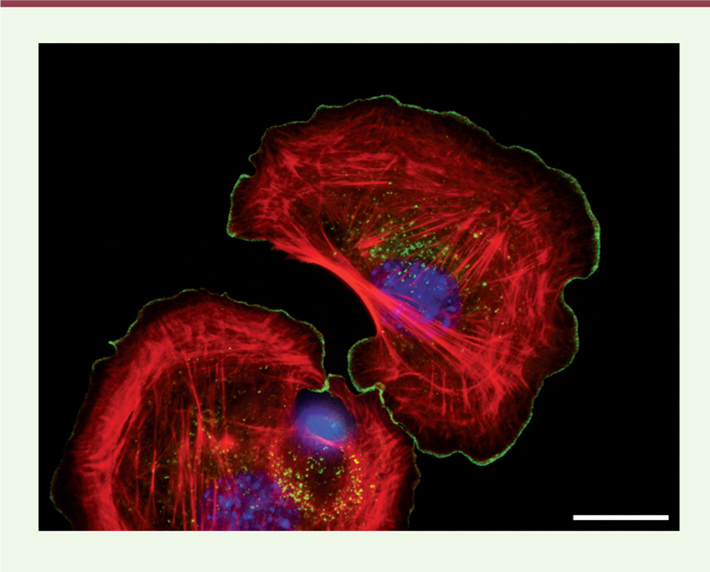
 | Figure 2.
Localisation d’Arpin à l’extrémité du lamellipode. Localisation d’Arpin (vert), de l’actine polymérisée (rouge) et des noyaux (bleus) dans des fibroblastes embryonnaires murins par immunofluorescence. Barre d’échelle : 20 µm. |
Arpin est donc un régulateur de la migration cellulaire : cette molécule ne fait pas partie de la machinerie motrice requise pour la migration, mais c’est un inhibiteur puissant de la migration cellulaire, qui diminue vitesse et direction, les deux paramètres majeurs qui déterminent l’efficacité de la migration [
10]. Nous nous attendons à ce qu’Arpin soit impliquée dans de nombreux processus physiologiques dans lesquels intervient une régulation fine de la migration cellulaire. En ce qui concerne la pathologie, des expériences préliminaires montrent une perte de l’expression d’Arpin dans les cancers du sein les plus invasifs, associée à la formation de métastases et à une moindre survie des patientes. Nous cherchons donc maintenant à caractériser les mécanismes par lesquels les cellules tumorales perdent l’expression d’Arpin. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Ridley
AJ
. Life at the leading edge . Cell.
2011; ; 145 : :1012.–1022. 2.
Pollard
TD
. Regulation of actin filament assembly by Arp2/3 complex and formins . Annu Rev Biophys Biomol Struct.
2007; ; 36 : :451.–477. 3.
Derivery
E
,
Gautreau
A
. Generation of branched actin networks: assembly and regulation of the N-WASP and WAVE molecular machines . Bioessays.
2010; ; 32 : :119.–131. 4.
Steffen
A
,
Ladwein
M
,
Dimchev
GA
, et al.
Rac function is crucial for cell migration but is not required for spreading and focal adhesion formation . J Cell Sci.
2013; ; 126 : :4572.–4588. 5.
Hart
Y
,
Alon
U
. The utility of paradoxical components in biological circuits . Mol Cell.
2013; ; 49 : :2131.–221. 6.
Neilson
MP
,
Neilson
MP
,
Veltman
DM
, et al.
Chemotaxis: a feedback-based computational model robustly predicts multiple aspects of real cell behaviour . PLoS Biol.
2011; ; 9 : :e1000618.. 7.
Castro-Castro
A
,
Ojeda
V
,
Barreira
MIA
, et al.
Coronin 1A promotes a cytoskeletal-based feedback loop that facilitates Rac1 translocation and activation . EMBO J.
2011; ; 30 : :3913.–3927. 8.
Allard
J
,
Mogilner
A
. Traveling waves in actin dynamics and cell motility . Curr Opin Cell Biol.
2013; ; 25 : :107.–115. 9.
Brandman
O
,
Brandman
O
,
Meyer
T
, et al.
Feedback loops shape cellular signals in space and time . Science.
2008 ; :322. : 390–395. 10.
Petrie
RJ
,
Doyle
AD
,
Yamada
KM
. Random versus directionally persistent cell migration . Nat Rev Mol Cell Biol.
2009; ; 10 : :538.–549. |