| |
| Med Sci (Paris). 2014 April; 30(4): 348–349. Published online 2014 May 5. doi: 10.1051/medsci/20143004003.Sexualité et mémoire : ce que la levure peut nous apprendre Fabrice Caudron1 and Yves Barral1* 1Institute of biochemistry, department of biology, ETH Zurich, Otto-Stern-weg 3, 8093Zurich, Suisse MeSH keywords: Saccharomyces cerevisiae, génétique, physiologie |
La mémoire est un phénomène que l’on associe le plus souvent au cerveau, aux neurones et à leurs connexions synaptiques. On l’associe aussi le plus spontanément du monde à l’école et à l’apprentissage par cœur de longs poèmes ennuyeux. Mais d’où nous vient cette mémoire, en termes évolutifs ? Est-elle propre à l’homme ? Ou au règne animal ? Sépare-t-elle l’esprit, et son siège, le cerveau, du corps ? Pourtant, certains organismes unicellulaires paraissent aussi mémoriser les stress thermiques ou alimentaires qu’ils subissent. Quoiqu’il en soit, cette question est l’objet de bien des supputations, et les bases moléculaires de la mémoire restent mystérieuses. Cependant il nous semble que la levure, dans toute sa simplicité unicellulaire, peut nous en apprendre un rayon sur ces questions, y compris en ce qui concerne leurs mécanismes moléculaires. |
Une levure qui fait la cour… La levure de bière est le plus souvent diploïde, mais, lors de conditions difficiles, elle entre en méiose et forme des spores haploïdes. Les levures haploïdes adoptent l’un des deux types sexuels possibles, le type a ou le type α. Chacune de ces cellules émet alors une phéromone spécifique de leur type a ou α pour attirer un partenaire du type opposé et conjuguer. En présence d’un partenaire, la cellule arrête de se diviser en phase G1, et forme une extension cellulaire (le shmoo) en direction de la source de phéromone. Lorsqu’ils s’atteignent, les deux partenaires fusionnent et forment un zygote diploïde qui prolifère ensuite par division asexuée. |
…mais ne trouve pas de partenaire Mais que se passe-t-il lorsque la rencontre n’a pas lieu, par exemple parce que le partenaire est trop éloigné, s’est décidé pour un autre, ou est stérile ? Grâce à la microfluidique, nous pouvons maintenant exposer les cellules à la phéromone en l’absence de partenaire, et étudier cette question. Après quelques heures et la formation du shmoo, les cellules échappent à l’arrêt en G1 et se remettent à se diviser [
1]. En même temps, elles deviennent réfractaires à la phéromone : après un premier cycle de division, alors que l’on pourrait penser que dès leur retour en G1 elles redeviennent sensibles à la phéromone, il n’en est rien, et elles continuent d’ignorer la phéromone et de proliférer [1]. Elles ne répondront à nouveau que si la concentration de phéromone augmente significativement, comme à l’approche d’un partenaire. La cellule a intégré qu’elle a été trompée. Une fois établie, cette adaptation se perpétue dans la cellule longtemps après la déception originelle, virtuellement pour le reste de son existence ; comme une mémoire. Mais peut-on vraiment parler de mémoire ? Deux observations suggèrent que oui. Tout d’abord, le maintien de cet état réfractaire ne dépend pas de la présence de phéromone : lorsqu’on enlève la phéromone, les cellules ne recouvrent pas leur sensibilité. Enfin, cette mémoire ne nécessite pas que la cellule ait préalablement échappé à la phéromone. Même après une courte exposition à la phéromone, les cellules acquièrent déjà l’état réfractaire. Donc, cet état indique que la cellule se « souvient » avoir vu une phéromone trompeuse. |
Les cellules de levure se divisent par bourgeonnement. On peut donc se demander si les bourgeons héritent de la mémoire de leur mère ? Et bien non. Elles naissent naïves et forment de très beaux shmoos en présence de phéromone. Elles doivent apprendre par elles-mêmes si cette phéromone est digne de confiance. |
La mémoire, une perte de fonction ? Quelles sont les bases moléculaires de ce phénomène ? Elles impliquent Whi3, une protéine qui lie des ARN messagers, notamment l’ARNm de la cycline Cln3 [
2]. En phase G1 et en association avec Cdc28 (la kinase dépendant des cyclines), Cln3 engage la cellule à entrer en phase S et à se diviser [
3]. Whi3, en liant l’ARNm de Cln3, inhibe la traduction de ce dernier et donc la synthèse de Cln3, permettant aux cellules de rester en G1 pour répondre à la phéromone et faire un shmoo. Whi3 possède aussi deux domaines riches en glutamine et asparagine (Q/N) [
4]. Dans certains cas, ces domaines polymérisent en fibres amyloïdes et rendent la protéine hôte insoluble [
5]. En présence de phéromone, Whi3 forme des agrégats protéiques, des superassemblages dans lesquels Whi3 est inactif. l’ARNm de Cln3 est libéré et le cycle cellulaire reprend [1]. La phéromone n’est plus assez forte pour maintenir la cellule arrêtée. Ce superassemblage est potentiellement capable de recruter et transformer les protéines Whi3 nouvellement synthétisées. En revanche, lorsque Whi3 a perdu ses domaines Q/N, la protéine n’agrège plus, les cellules échappent difficilement à l’arrêt en G1, et lorsqu’elles y parviennent, elles ne restent pas réfractaires - elles oublient vite ! L’agrégation de Whi3 est en quelque sorte un système qui s’auto-maintient, expliquant la stabilité de la mémoire qu’elle engendre(Figure 1.
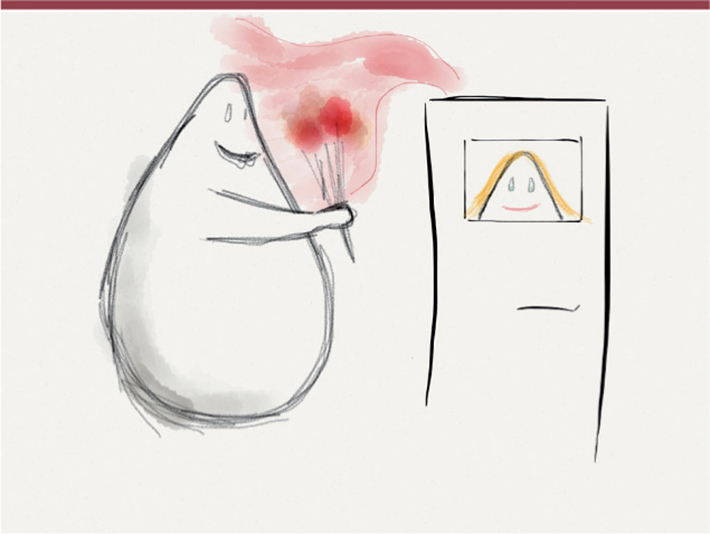
 | Figure 1.
Une mémoire de l’absence de partenaire sexuel. Lorsqu’une levure détecte de la phéromone, elle arrête son cycle cellulaire en phase G1 et forme un shmoo. Que se passe-t-il lorsque la phéromone est présente mais que la conjugaison n’aboutit pas ? |
|
Des mnemons, pas des prions ! Les superassemblages de Whi3 ressemblent beaucoup aux prions. En effet : (1) les domaines Q/N de Whi3, comme ceux des prions, forment des superassemblages ; (2) des chaperonnes régulent ce processus, comme pour les prions ; (3) ces assemblages inactivent la protéine, comme la plupart des prions (la mémoire est donc ici une perte de fonction !). Mais, à la différence des prions, les assemblages de Whi3 restent dans la cellule mère et ne se propagent pas aux cellules filles. Nous nommons ces nouveaux assemblages mnemons pour marquer à la fois cette différence et leur rôle dans la mémoire. |
Le mnemon Whi3, un cas isolé ? Cet exemple de Whi3 et de ses domaines Q/N serait-il un cas isolé ? Probablement pas. Il existe environ 200 protéines à domaines Q/N chez S. cerevisiae [4]. Très peu forment des prions. Dans la plupart des cas, ils n’ont pas de fonction connue, et un grand nombre des protéines hôtes régulent l’expression des gènes, souvent en liant les ARN, comme Whi3. Beaucoup d’entre elles pourraient donc être des mnemons. Certainement, l’association entre domaine Q/N et liaison des ARN est troublante et pourrait nous aider à mieux comprendre les mécanismes de mémoire cellulaire. |
Des mnemons dans d’autres organismes ? On trouve des protéines à domaines Q/N chez tous les eucaryotes. De même, l’association de ces domaines avec des domaines de liaison aux ARN est aussi observée chez l’homme [
6]. Mais alors, les cellules humaines utiliseraient-elles aussi des mnemons pour encoder de la mémoire ? Et peut-être même dans les neurones ? C’est bien possible. L’agrégation des protéines synaptiques CPEB et Orb2 contribue à la formation d’une mémoire de long terme chez l’aplysie et la mouche, respectivement [
7–
9]. Orb2 sert, entre autres, aux mouches mâles à apprendre à distinguer les femelles déjà fécondées, et à les éviter… Il est remarquable que, au moins chez la levure et la mouche, c’est l’étude des mécanismes sexuels qui révèle les cas de mémoire les plus évidents. Ainsi, se pourrait-il que la mémoire, de la levure à la mouche, ait coévolué avec la sexualité, et avec la complexité associée à l’identification d’un partenaire digne de foi ? Et que les mécanismes d’encodage de la mémoire soient très similaires - par agrégation et immobilisation de mnemons – chez la levure et dans nos neurones ? Dans la levure, le mnemon Whi3 reste dans la cellule mère. Dans les neurones, chaque synapse forme un compartiment distinct des autres, chacun susceptible de contenir son jeu de mnemons. Mais la mémoire des levures nous suggère aussi une autre idée fondamentale : la mémoire est probablement une capacité intrinsèque de toutes les cellules. Se pourrait-il alors que notre histoire soit portée par toutes nos cellules ? |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Caudron
F
,
Barral
Y
. A super-assembly of Whi3 encodes memory of deceptive encounters by single cells during yeast courtship . Cell.
2013; ; 155 : :1244.–1257. 2.
Garì
E
,
Volpe
T
,
Wang
H
, et al.
Whi3 binds the mRNA of the G1 cyclin CLN3 to modulate cell fate in budding yeast . Genes Dev.
2001; ; 15 : :2803.–2808. 3.
Dirick
L
,
Nasmyth
K
. Positive feedback in the activation of G1 cyclins in yeast . Nature.
1991; ; 351 : :754.–757. 4.
Alberti
S
,
Halfmann
R
,
King
O
, et al.
A systematic survey identifies prions and illuminates sequence features of prionogenic proteins . Cell.
2009; ; 137 : :146.–158. 5.
Halfmann
R
,
Lindquist
S
. Epigenetics in the extreme: prions and the inheritance of environmentally acquired traits . Science.
2010; ; 330 : :629.–632. 6.
King
OD
,
Gitler
AD
,
Shorter
J
. The tip of the iceberg: RNA-binding proteins with prion-like domains in neurodegenerative disease . Brain Res.
2012; ; 1462 : :61.–80. 7.
Si
K
,
Choi
Y-B
,
White-Grindley
E
, et al.
Aplysia CPEB can form prion-like multimers in sensory neurons that contribute to long-term facilitation . Cell.
2010; ; 140 : :421.–435. 8.
Si
K
,
Lindquist
S
,
Kandel
ER
. A neuronal isoform of the aplysia CPEB has prion-like properties . Cell.
2003; ; 115 : :879.–891. 9.
Keleman
K
,
Krüttner
S
,
Alenius
M
, et al.
Function of the Drosophila CPEB protein Orb2 in long-term courtship memory . Nat Neurosci.
2007; ; 10 : :1587.–1593. |