Des sphéroïdes cultivés ex vivo
Cette question a été abordée en utilisant le système
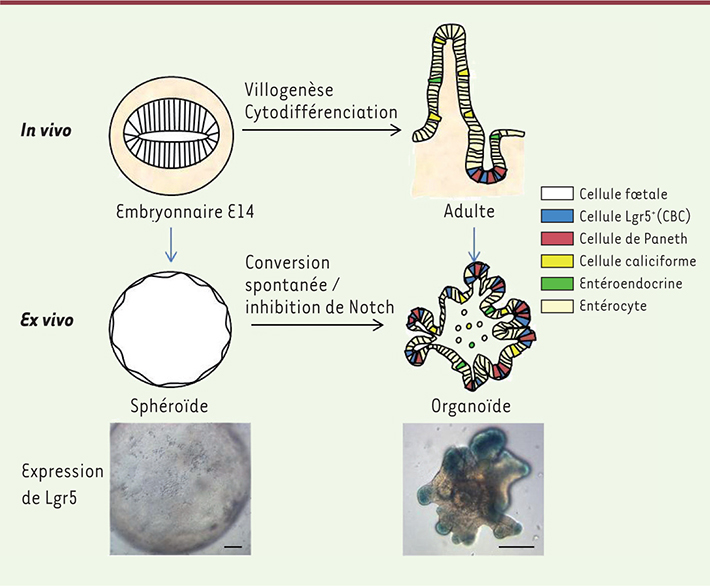
ex vivo développé pour la culture tridimensionnelle de cellules souches intestinales adultes sous forme d’organoïdes, aussi décrits comme des « mini-intestins adultes » [
6]. Les intestins de souris ont été prélevés à différents stades du développement fœtal et postnatal, puis cultivés
ex vivo [
7]. Nous avons constaté que la culture d’intestins à E14 génère, non pas des organoïdes, mais des sphéroïdes constitués de cellules épithéliales polarisées monostratifiées d’origine intestinale, capables de renouvellement à long terme. La proportion des sphéroïdes produits en culture décroît au cours du développement, ces derniers étant progressivement remplacés par des organoïdes, tels qu’on les obtient par la culture de cellules souches adultes. Ceci indique que les cellules générant les sphéroïdes sont le reflet d’un stade particulier du développement de l’épithélium intestinal fœtal.
Un transcriptome différent de celui des CBC
Le profil d’expression génique de ces sphéroïdes fœtaux diffère de celui des organoïdes par l’absence d’expression de marqueurs de différenciation des lignées cellulaires de l’épithélium adulte et par des niveaux faibles, voire indétectables, des marqueurs de CBC, tels que le récepteur Lgr5. L’analyse de cultures d’intestins provenant de souris invalidées pour le récepteur Lgr5 a montré que ce marqueur n’est pas requis pour la croissance des sphéroïdes, au contraire du récepteur paralogue Lgr4 qui, lui, est apparu essentiel pour leur génération [
7]. Bien que radicalement différents des CBC, les sphéroïdes fœtaux sont caractérisés par l’expression de gènes décrits comme marqueurs de cellules souches/progénitrices ou impliqués dans la régénération cellulaire dans certains tissus. La pertinence
in vivo des marqueurs de sphéroïdes (cultivés
ex vivo) a été ensuite confirmée en analysant leur expression sur de l’épithélium intestinal d’embryons de souris. Parmi ces marqueurs figurent le
tumor-associated calcium signal transducer 2 (Trop2/Tacstd2), proposé comme marqueur diagnostique de cancer colorectal, et la connexine 43, aussi nommée
gap junction protein 1 (Cnx43/Gja1) car impliquée dans les communications intercellulaires [
8,
9]. Au stade précédant la phase de villogenèse (E14), ces deux molécules apparaissent fortement exprimées dans l’épithélium, tandis que leur expression disparaît progressivement après le début de la cytodifférenciation [
7]. Des expériences complémentaires de traçage cellulaire ont été réalisées à l’aide de souris transgéniques
Cnx43-CreER/Rosa26R exprimant une Cre recombinase placée sous le contrôle du promoteur du gène
Cnx43 et activable de façon conditionnelle par le tamoxifène. Les données obtenues ont montré que les cellules exprimant la Cnx43 contribuent essentiellement à la villogenèse fœtale. Au contraire, des expériences similaires réalisées avec des souris transgéniques
Lgr5-CreERT2/Rosa26R ont confirmé le rôle majeur des cellules exprimant le récepteur Lgr5 dans la villogenèse adulte et postnatale, mais une contribution mineure à la villogenèse fœtale [
7]. Ces observations ont permis de conclure que l’épithélium intestinal se développe en deux phases successives, l’une fœtale transitoire et l’autre adulte définitive, et que ces phases dépendent de deux types différents de cellules souches
(Figure 1).
 | Figure 1.
Représentation schématique de l’épithélium intestinal murin aux stades embryonnaire (E14) et adulte. Les cellules progénitrices foetales et souches adultes Lgr5+ génèrent respectivement des sphéroïdes et des organoïdes lorsqu’elles sont cultivées ex vivo. L’expression de Lgr5, marqueur de cellules souches adultes, y est visualisée par mesure de l’activité β-galactosidase (cellules bleues) à partir de la lignée de souris transgénique Lgr5-LacZ. échelle : 200 μm. |
Conversion des sphéroïdes en organoïdes
Afin d’établir s’il existe un lien possible entre ces deux types de cellules impliquées dans les villogenèses fœtale et adulte, la conversion de sphéroïdes fœtaux en organoïdes adultes a été recherchée
ex vivo. Une conversion spontanée a pu être constatée, conduisant à l’apparition de CBC dans les organoïdes néoformés, mais elle est peu active [
7]. Ce taux de conversion augmente si les cultures sont traitées avec des agents modulant négativement la cascade de signalisation Notch, voie bien connue pour contrôler la différenciation des cellules souches intestinales [
7]. Bien que les mécanismes moléculaires impliqués dans la transition de sphéroïde à organoïde ne soient pas encore élucidés, ces données indiquent toutefois que les cellules fœtales ont la capacité intrinsèque de se convertir en cellules souches adultes et suggèrent l’existence d’un processus similaire
in vivo.
Dans un article paru simultanément au nôtre, Fordham et al. ont aussi rapporté l’existence de cellules fœtales murines et humaines (au stage gestationnel de 10 semaines) de l’épithélium intestinal capables de générer des sphéroïdes ex vivo [
10]. Dans une expérience destinée à établir la preuve de concept, les cellules de sphéroïdes fœtaux murins ont pu être utilisées comme source de greffe dans un modèle de colite induite dans des souris adultes immunodéficientes ; elles se montrent capables de générer des cellules différenciées dans le tissu hôte [10].
L’identification de cellules progénitrices à l’origine de l’épithélium fœtal intestinal et en amont des cellules souches adultes laisse penser que des types de cellules similaires pourraient exister dans d’autres organes du tube digestif embryonnaire. L’isolement et la caractérisation de ces populations cellulaires feront certainement l’objet de recherches futures.