| |
| Med Sci (Paris). 2014 April; 30(4): 429–435. Published online 2014 May 5. doi: 10.1051/medsci/20143004018.Microenvironnement tumoral Cellules régulatrices et cytokines immunosuppressives Mélanie Bruchard1* and François Ghiringhelli1,2 1Inserm, faculté de médecine et de pharmacie de Dijon, 7, boulevard Jeanne d’Arc, Dijon, France 2Centre Georges François Leclerc, 1 rue du Professeur Marion, Dijon, France |
Le traitement du cancer a été marqué par de nombreux progrès au cours de ces dernières années. La biologie du cancer a aussi connu de grands changements, mais elle reste cependant un sujet de recherches actives. Weinberg et al. [
1] ont présenté en 2011 un modèle identifiant 10 grandes caractéristiques des cellules cancéreuses permettant, notamment, d’expliquer les processus biologiques de la maladie cancéreuse et, ainsi, de montrer qu’un cancer se caractérise par des anomalies de la cellule tumorale, mais aussi du stroma [
38,
39] (→).
(→) Voir les Synthèses de W.H. Fridman et C. Sautès-Fridman, et de S. Provot, pages 359 et 366 de ce numéro
Les mutations et l’instabilité du génome sont à l’origine des cellules cancéreuses. Ces changements du génome sont liés à l’accumulation successive de mutations qui permettent à la cellule cancéreuse d’acquérir les nouvelles fonctions nécessaires à sa transformation. L’une de ces fonctions est la capacité qu’ont les cellules cancéreuses à proliférer grâce à leur production autocrine de signaux de croissance. Deux caractéristiques complémentaires renforcent la capacité des cellules cancéreuses à proliférer : elles échappent à l’action des gènes suppresseurs de tumeurs, qui régulent négativement cette prolifération, et elles développent un potentiel de réplication illimité grâce à l’expression de la télomérase [
2] ; cette enzyme protège les extrémités des chromosomes, ce qui évite l’entrée des cellules cancéreuses en sénescence. Autre modification, celle du métabolisme du glucose : la glycolyse est la voie métabolique prédominante dans les cellules cancéreuses, que la cellule soit en situation d’aérobie ou d’anaérobie [
40] (→). Ce changement peut sembler étrange sachant que la glycolyse libère environ 18 fois moins d’ATP que la voie mitochondriale. Cependant, la glycolyse produit une variété plus importante d’intermédiaires glycolytiques participant à diverses voies de biosynthèse, dont celles des acides aminés ou encore des nucléosides, augmentant ainsi la production de ces voies de biosynthèse au bénéfice d’une prolifération cellulaire active [
3]. De plus, les cellules cancéreuses peuvent, en effectuant une transition épithélio-mésenchymateuse de façon transitoire ou stable, acquérir la capacité d’envahir les tissus et de former des métastases dans des organes différents de celui de la tumeur primaire [
4,
41,
42] (→→).
(→) Voir la Synthèse de J. Razungles et al, m/s n° 11, novembre 2013, page 1026
(→→) Voir les Synthèses de M. Hasmim et al. et de S. Hubert et J.P. Abastado, pages 422 et 378 de ce numéro
À ces caractéristiques de la cellule tumorale s’ajoutent des modifications du stroma, indispensables à la biologie de la tumeur. En effet, celle-ci représente une masse de cellules nouvellement formées, et elle a besoin de mettre en place un réseau de vaisseaux sanguins lui permettant d’échanger des métabolites. Une angiogenèse active est l’une des caractéristiques retrouvées dans de nombreuses tumeurs solides, et elle est nécessaire à leur développement [
5,
43] (→). Cette angiogenèse est activée grâce aux cytokines inflammatoires produites au sein de la tumeur par des cellules immunosuppressives et par les cellules tumorales [
6].
(→) Voir la Synthèse de S. Azzi et J. Gavard, page 408 de ce numéro
Les cellules tumorales sont caractérisées par des taux élevés de mutations, et les molécules mutées peuvent être détectées par le système immunitaire, qui joue alors un rôle dans le contrôle du développement tumoral. À l’inverse, une réponse immunitaire prolongée, par l’inflammation chronique qu’elle instaure, facilite la progression tumorale et la dissémination de métastases, et favorise l’instabilité génétique de la tumeur ainsi que l’immunosuppression locale. Ainsi, la réponse immunitaire antitumorale intervient-elle de façon majeure dans l’initiation, le développement et le contrôle de la progression tumorale [
7]. La théorie de l’immunosurveillance propose que le système immunitaire soit capable de reconnaître et d’éliminer les cellules cancéreuses dès leur émergence [
44] (→). Cependant, les tumeurs peuvent, dans certains cas, progresser et échapper, au moins en partie, à la surveillance du système immunitaire. Elles le font via la diminution du complexe majeur d’histocompatibilité de classe I (CMH I) [
8] à la surface des cellules cancéreuses, ainsi que via la mise en place de cellules immunosuppressives et la sécrétion de certaines cytokines par les cellules cancéreuses, comme nous allons le décrire dans cette revue.
(→) Voir la Synthèse de J. Galon et al. page 439 de ce numéro
|
Les cellules immunosuppressives Lymphocytes T régulateurs (Treg) Trois types de cellules immunitaires jouent un rôle primordial dans l’immunosuppression. Les lymphocytes T régulateurs (Treg) sont des lymphocytes T CD4 + exprimant la chaîne a du récepteur de l’interleukine-2 (IL-2) (CD25) et le facteur de transcription FoxP3 ( forkhead box P3). Ils sont impliqués dans le maintien de la tolérance immunitaire, empêchant l’apparition de maladies auto-immunes. Cependant, dans un organisme atteint de cancer, les Treg vont se multiplier et migrer au site de la tumeur où ils supprimeront l’immunité antitumorale via différents mécanismes [
9]. Il existe deux sous-populations de Treg : les Treg naturels et les Treg induits. Ces deux sous- populations se distinguent grâce à leur expression différentielle en neuropiline 1 [
10]. Les Treg naturels sont issus du thymus où ils sont sélectionnés grâce à des interactions de haute affinité entre le TCR (T cell receptor) et le complexe CMH présentant des peptides endogènes du soi. Ils exercent leur activité suppressive par contact direct via plusieurs mécanismes : (1) le système perforine/granzyme, ce qui aboutit à la lyse des lymphocytes T effecteurs ; (2) la molécule CTLA-4 (cytotoxin T-lymphocyte antigen-4), qui interagit avec les molécules de costimulation CD80/86 présentes à la surface des cellules dendritiques ; il en résulte une diminution des fonctions activatrices des cellules dendritiques ; (3) la voie Fas/Fas ligand, qui entraîne l’apoptose des lymphocytes T effecteurs ; (4) l’expression de TGF-β (transforming growth factor-β) membranaire [
11] ; ce dernier induit les ectonucléotidases CD39 et CD73 qui hydrolysent l’ATP ou l’ADP en adénosine, connue pour inhiber les lymphocytes T effecteurs (Tableau I).
Tableau I.
|
Cellules |
Molécules |
Cibles |
Effets |
|
|
Perforine/granzyme |
T effecteurs |
Lyse |
|
|
CTLA-4 sur CD80 et CD86 |
Cellules dendritiques |
Diminution des fonctions activatrices |
|
Treg naturel |
Fas/FasL |
T effecteurs |
Apoptose |
|
|
Adénosine |
T effecteurs |
Inhibition de la production de cytokines |
|
|
TGF-β |
Th17 |
Apparition de CD39 et CD73 |
|
|
|
|
Capture d’IL-2 |
T effecteurs |
Diminution de la prolifération |
|
Treg induit |
IL-10 |
NK, cellules dendritiques, macrophages |
Diminution de CD80 et CD86 |
|
|
TGF-β |
Th17 |
Apparition de CD39 et CD73 |
|
|
|
Effets négatifs
|
Th17 |
IL-17a |
|
Augmentation de l’angiogenèse et de la lymphangiogenèse |
|
Adénosine |
T effecteurs |
Inhibition de la production de cytokines |
|
|
|
|
ROS |
T CD8 |
TCR non fonctionnel |
|
|
iNOS/arginase sur L-arginine |
T effecteurs |
TCR non fonctionnel |
|
MDSC |
IL-6 |
MDSC |
Activation des fonctions immunosuppressives |
|
|
IL-10 |
NK, cellules dendritiques, macrophages |
Diminution de CD80 et CD86 |
|
|
TGF-β |
Th17 |
Apparition de CD39 et CD73 |
|
|
|
|
Th17 |
Diminution de la production d’IL-17 |
|
|
|
|
|
|
T CD4 |
Limite inflammation |
|
|
|
|
Limite réponse antimicrobienne |
|
Effets positifs
|
Treg |
|
NK |
|
|
|
IL-21 |
T CD8 cytotoxiques |
Augmentation des fonctions antitumorales |
|
|
|
T effecteurs |
Augmentation de la production d’IFN-γ et de TNF-α |
|
|
|
Th17 |
CXCL9, CXCL10, CXCL11 |
T CD4 |
Augmentation du recrutement à la tumeur |
|
|
|
|
|
Diminution de la croissance tumorale |
|
IFN-γ |
T effecteurs |
Diminution de la croissance tumorale |
Effets négatifs et positifs des principales cellules immunosuppressives.
|
Les Treg induits ne sont pas sélectionnés dans le thymus ; ils sont convertis en cellules suppressives à partir de T CD4+ souvent lors d’une inflammation chronique, d’une maladie auto-immune ou d’un cancer, sous l’influence de TGF-β et d’IL-2. Ils agissent à distance en modulant l’environnement cytokinique, et notamment en adsorbant l’IL-2 indispensable à la prolifération des lymphocytes T effecteurs, via le récepteur α de l’IL-2 (CD25) qu’ils expriment à leur surface. De plus, les Treg produisent les cytokines immunosuppressives TGF-β et IL-10, dont les effets seront abordés plus loin. Dans la plupart des cancers, l’infiltration des cellules Treg est associée à un mauvais pronostic [
12]. Cependant, de façon surprenante, de multiples études ont montré que, chez l’homme, un pourcentage élevé de lymphocytes T FoxP3 infiltrant la tumeur était de bon pronostic dans les cancers colorectaux, les cancers ORL et les lymphomes non hodgkiniens [
13,
14]. La capacité des lymphocytes T FoxP3+ à limiter l’inflammation et les réponses immunitaires antimicrobiennes [12], ainsi que leur capacité à supprimer la prolifération et la production d’IL-17 des lymphocytes T helper 17 (Th17) [
15] au sein de la tumeur, expliquent probablement le lien entre un fort infiltrat intratumoral de lymphocytes T FoxP3+ et un pronostic favorable. Lymphocytes Th17 Le rôle joué par les lymphocytes Th17 dans le cancer est encore très controversé. Cette sous-population de lymphocytes T CD4 est caractérisée par l’expression du facteur de transcription RORγT ( orphan nuclear receptor) et la synthèse des cytokines IL-17α, IL-17f, IL-21 et IL-22 [
16]. Les lymphocytes Th17 sont générés en présence de TGF-β, d’IL-6, d’IL-23 et d’IL-1β et sont impliqués dans des maladies auto-immunes, comme le psoriasis et la sclérose en plaques. Lorsqu’un cancer se développe, les Th17 sont présents parmi les lymphocytes infiltrant la tumeur, suggérant leur recrutement, leur induction et leur prolifération par le microenvironnement tumoral. Ces infiltrats de cellules Th17 ont un rôle ambigu, source de résultats contradictoires en fonction du type de cancer. Plusieurs études ont montré que les Th17 pouvaient avoir des effets antitumoraux. Leur production d’IL-21 augmente les fonctions antitumorales des NK (natural killer) et des lymphocytes T CD8+ cytotoxiques, ainsi que la production d’IFN-γ (interféron-γ) et de TNF-α (tumor necrosis factor-α), entre autres. La présence de Th17 augmenterait le recrutement de lymphocytes T CD4+ dans la tumeur et s’accompagnerait d’une diminution de la croissance tumorale [
17] (Tableau I). Le transfert adoptif de Th17 chez des souris porteuses de mélanome B16 permet de faire régresser les tumeurs. Ce résultat est attribuable est en grande partie à la production d’IFN-γ par des Th17 exprimant un phénotype mixte Th17/Th1 et coexprimant les facteurs de transcription spécifiques des lignées Th1 et Th17, Tbet et RORγt, respectivement. De plus, lorsqu’ils sont générés en présence d’IL-1β, d’IL-6 et d’IL-23, les Th17 produisent de l’IFN-γ, n’expriment ni CD39 ni CD73, et ne sont pas immunosuppresseurs [
18] (Figure 1).
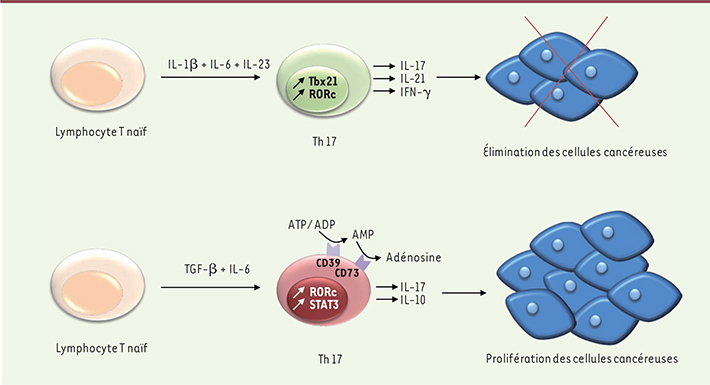
 | Figure 1.
Impact de l’environnement cytokinique sur la polarisation Th17 et conséquences sur les cellules cancéreuses. Les cellules T naïves polarisées en Th17 en présence d’IL-1β, d’IL-6 et d’IL-23 vont produire de l’IL-17, de l’IL-21 et de l’IFN-γ. Elles présentent un phénotype mixte Th17/Th1 et sont antitumorales. À l’inverse, lorsque la polarisation se fait en présence de TGF-β et d’IL-6, les Th17 produisent de l’IL-17 et de l’IL-10, et expriment à leur surface les ectonucléotidases CD39 et CD73, qui transforment l’ATP en adénosine. Leur production d’IL-17, d’IL-10 et d’adénosine a des effets protumoraux. |
La plasticité des Th17 se manifeste également par leur capacité à se différencier en Treg en fonction du microenvironnement cytokinique. La balance entre Treg et Th17 est ainsi contrôlée par la balance entre les taux de TGF-β et d’IL-6 ; une forte concentration de TGF-β induit des Treg ; la présence d’IL-6 orientera la différenciation vers un phénotype Th17. L’IL-17a est principalement responsable des propriétés protumorales des Th17. Elle augmente la production de VEGF (vascular endothelial growth factor) et d’autres facteurs pro-angiogéniques par les cellules tumorales et les fibroblastes, permettant la création de nouveaux vaisseaux sanguins pour alimenter la tumeur. Elle promeut également la lymphangiogenèse, processus de développement des vaisseaux lymphatiques qui concourent à la colonisation des ganglions lymphatiques par les cellules métastatiques. Par ailleurs, l’IL-17 peut directement favoriser la prolifération de cellules tumorales ou leur résistance à l’apoptose [
19]. Tout comme les Treg, les Th17 expriment à leur surface les ectonucléotidases CD39 et 73, transformant l’ATP et l’ADP relargués par les cellules mourantes en adénosine, puissante molécule immunosuppressive.
Myeloid derived suppressor cell (MDSC) Les MDSC ( myeloid derived suppressor cell) sont des cellules hématopoïétiques immatures qui peuvent se différencier en cellules dendritiques ou en macrophages. Si elles sont présentes à l’état normal en très faible nombre chez l’homme comme chez le rongeur, leur population augmente en cas d’infection chronique (tuberculose) ou de cancer. Dans ce dernier cas, des facteurs sécrétés par la tumeur, tels que le GM-CSF ( granulocyte macrophage-colony stimulating factor), stimulent l’expansion des MDSC. L’activation des fonctions immunosuppressives est dépendante de multiples signaux pro-inflammatoires, dont la stimulation du récepteur TLR2 ( toll like receptor 2). Ces signaux sont, pour la plupart, dépendants de l’activation du facteur de transcription Stat3 ( signal transducer and activator of transcription 3). Dans le microenvironnement tumoral, les MDSC peuvent, entre autres, se différencier en macrophages de polarisation M2 ou en cellules endothéliales, qui, tous deux, exercent des fonctions immunosuppressives. Chez la souris, cette population exprime les molécules de surface Gr1 et CD11b. CD11b est une α intégrine présente à la surface de nombreux leucocytes ; Gr1 est présent sur les cellules précurseurs de la lignée myéloïde ; il possède deux épitopes, Ly6C et Ly6G, qui permettent de distinguer deux sous-populations de MDSC : les MDSC granulocytiques, qui sont CD11b+Gr1
hi
Ly6G+Ly6Clow/mid, et les MDSC monocytiques, qui sont CD11b+Gr1
mid
Ly6G-Ly6Chi [
20]. Les MDSC granulocytiques représentent environ 80 % des MDSC en cas de cancer. Elles suppriment la réponse des CD8+ spécifique d’un antigène, principalement via la production d’espèces réactives de l’oxygène (ROS, reactive oxygen species). Les MDSC monocytiques diminuent la quantité de L-arginine disponible en la transformant, soit en NO et citrulline, soit en urée et L-ornithine, grâce à deux enzymes, l’iNos (nitric oxide synthase) et l’arginase 1, respectivement [
21]. La L-arginine est nécessaire à la génération du CD3ζ, partie essentielle du TCR. La diminution de la quantité de L-arginine disponible influence l’expression du CD3ζ et, en conséquence, la formation d’un TCR fonctionnel, ainsi que la prolifération des lymphocytes T. Les MDSC produisent également des cytokines immunosuppressives, telles que l’IL-6, l’IL-10 et le TGF-β, qui sont essentielles à la génération de Treg, Tr1 et de Th17 (Tableau I). |
Les molécules immunosuppressives Les molécules sécrétées par les cellules cancéreuses et par diverses populations cellulaires immunosuppressives sont des éléments clés de l’immunosuppression. Elles sont à l’origine de l’apparition et du développement de populations immunosuppressives, bloquent l’action du système immunitaire contre la tumeur, et contribuent ainsi à la mise en place d’un environnement favorable au développement de la tumeur, par exemple via l’angiogenèse. L’interleukine 10 L’IL-10 est une cytokine majeure dans l’immunosuppression tumorale. Cette cytokine anti-inflammatoire peut être sécrétée par de nombreux types cellulaires, dont les mastocytes, les lymphocytes B et les lymphocytes T CD4 ; en cas de cancer, les Treg représentent la source principale [
22]. L’IL-10 supprime la production d’IFN-γ par les NK, et celle de cytokines pro-inflammatoires (IL-12, TNF-α) par les cellules dendritiques et les macrophages [
23]. L’absence d’IL-12 limite la différenciation Th1, et donc les réponses antitumorales liées à cette population. L’IL-10 induit également une diminution des molécules de costimulation CD80 et CD86 à la surface des cellules présentatrices d’antigènes et, donc, de la capacité de ces cellules à activer les lymphocytes T. Elle a néanmoins un effet positif sur la différenciation et la migration des lymphocytes T cytotoxiques, et elle active les lymphocytes B en augmentant leur expression du CMH II, induisant une plus grande production d’IgA. Le transforming growth factor β Le TGF-β est aussi produit par les Treg. C’est un puissant inhibiteur de la prolifération, qui joue un rôle central dans le maintien de l’homéostasie des cellules épithéliales, endothéliales et hématopoïétiques. Chez l’homme, sa présence à des stades précoces du développement de différents cancers contribue à l’élimination des cellules cancéreuses [
24]. Cependant, une fois que les cellules cancéreuses échappent aux systèmes de contrôle de la prolifération dépendant du TGF-β, cette cytokine facilite l’invasion de nouveaux tissus et la progression de la tumeur. Le TGF-β participe à la mise en place de populations immunosuppressives, attire les macrophages dans la tumeur, induit leur polarisation en macrophages de type 2 (immunosuppresseurs) et stimule leur sécrétion de cytokines, dont l’IL-10 et le TGF-β. Il est également indispensable à la génération de lymphocytes Tr1 et à la prolifération des Treg [
25]. En présence d’IL-6, il polarise les cellules T CD4 naïfs en Th17. La présence de TGF-β induit également l’expression de CD39 et CD73 sur les lymphocytes T CD4 et CD8, les cellules dendritiques (DC) et les macrophages, provoquant une production d’adénosine [
26]. La prostaglandine E2 (PGE2) La PGE2 est produite par les cellules myéloïdes, stromales et par les cellules tumorales ; elle s’y forme à partir de l’acide arachidonique via l’action de la cyclo-oxygénase et de la PG synthase. Les récepteurs de la PGE2, EP-1 à EP-4, sont présents sur de multiples types cellulaires, reflétant le caractère ubiquitaire de cette molécule. Celle-ci est, entre autres, impliquée dans l’hématopoïèse, la régulation de la pression sanguine et la signalisation neuronale. Si la PGE2 permet l’attraction et l’activation des neutrophiles, des macrophages et des cellules dendritiques, elle induit également la production d’IL-10 par les macrophages et les cellules dendritiques [
27] ; elle supprime les fonctions cytolytiques des NK, ainsi que leur production d’IFN-γ [
28], influençant directement les réponses antitumorales des lymphocytes Th1 et des lymphocytes T CD8 cytotoxiques. À haute dose, la PGE2 bloque la production d’IL-2 nécessaire à l’expansion et à l’activation des lymphocytes T. À faible dose, elle module la polarisation des cellules T CD4, favorisant les Th2 et Th17 [
29]. L’IL-6 et l’IL-1β IL-6 et IL-1β sont des cytokines pro-inflammatoires. L’IL-6 est produite par les monocytes, les macrophages et, parfois, par les cellules tumorales, et elle joue un rôle essentiel dans le développement tumoral. L’IL-6 favorise la prolifération des cellules tumorales en stimulant l’angiogenèse et, donc, la vascularisation de la tumeur [
30,
45] (Figure 2) ( →). Elle est aussi impliquée dans la résistance de certaines cellules cancéreuses à la chimiothérapie, via l’activation de Stat3, un intermédiaire de la voie de signalisation du récepteur de l’IL-6 qui induit l’augmentation de l’expression de différentes protéines antiapoptotiques [
31]. Chez la souris, les exosomes issus de la tumeur activent la voie TLR2/MyD88 ( myeloid differentiation primary response 88) dans les MDSC, induisant une production d’IL-6 par ces dernières. Cette IL-6 agit de manière autocrine sur les MDSC et induit la phosphorylation de Stat3, qui relaye l’activité immunosuppressive des MDSC [
32]. L’IL-6 agit aussi sur les lymphocytes Th17, en influençant l’expression à leur surface des ectonucléotidases CD39 et CD73, qui jouent un rôle essentiel dans l’immunosuppression via leur production d’adénosine [ 18]. Chez l’homme, il a été montré qu’elle pouvait bloquer la maturation des cellules dendritiques [
33]. De plus, le niveau d’IL-6 présent dans le sérum de patients atteints de cancer colorectal a été associé avec la taille de la tumeur, la progression tumorale, ainsi qu’avec une survie plus courte [
34].
(→) Voir la Synthèse de L. Borriello et Y.A. DeClerck, page 445 de ce numéro
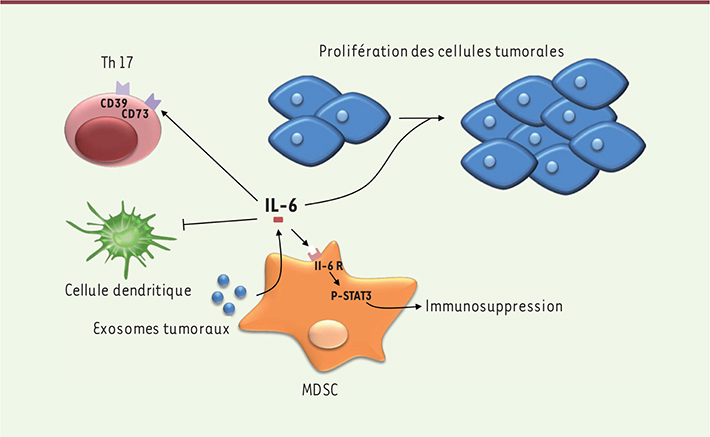
 | Figure 2.
Les divers rôles protumoraux de l’IL-6. L’IL-6 est produite après stimulation du TLR2 à la surface des MDSC par des exosomes tumoraux. L’IL-6 induit l’expression des ectonucléotidases à la surface des Th17, aide la prolifération des cellules tumorales en stimulant l’angiogenèse et, de façon autocrine, induit la phosphorylation de STAT3 menant au potentiel immunosuppresseur des MDSC. L’IL-6 va également inhiber la différenciation des cellules dendritiques à partir des précurseurs CD34+. |
L’IL-1β a comme sources principales les macrophages et les cellules dendritiques. La forme inactive proIL-1β est clivée en IL-1β active par la caspase-1, elle-même activée principalement lors de la formation d’un complexe macromoléculaire appelé inflammasome [
46] (→). L’action de l’IL-1β sur le système immunitaire dépend de sa concentration. La présence de grandes quantités d’IL-1β, comme lors d’une inflammation aiguë, augmente la production d’IFNγ par les lymphocytes T CD8 et favorise donc une immunité antitumorale [
35]. À l’inverse, une production d’IL-1β modérée mais prolongée, par exemple lors d’une inflammation chronique, induit l’expansion des MDSC [
36], ainsi que le développement et la multiplication de Th17, favorisant ainsi le développement de populations immunosuppressives et, donc, une réponse immunitaire non optimale, favorisant la croissance tumorale [
37] (Figure 3).
(→) Voir la Synthèse de Y. Jamilloux et T. Henry, m/s n° 11, novembre 2013, page 975
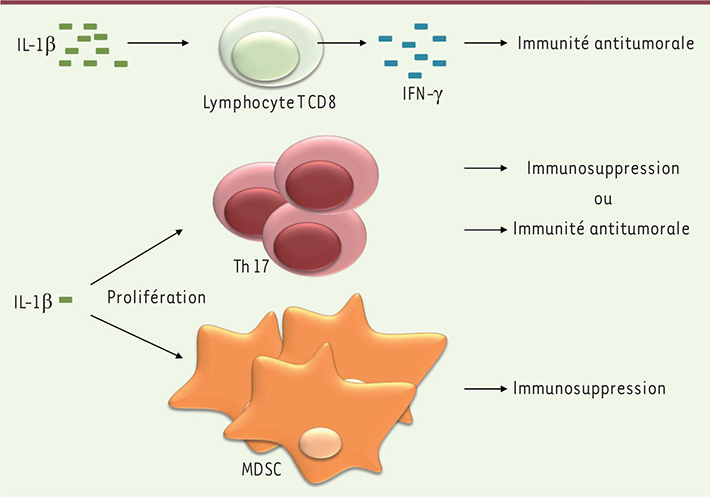
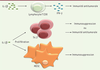 | Figure 3.
Effets dépendants de la dose d’IL-1 β. À forte dose, comme dans le contexte d’une inflammation aiguë, l’IL-1β augmente la production d’IFN-γ par les lymphocytes T CD8, provoquant une réponse immunitaire antitumorale. À l’inverse, une production faible, mais prolongée, d’IL-1β induit une prolifération des Th17 et des MDSC immunosuppresseurs. Selon les cytokines présentes lors de leur différenciation, les Th17 seront pro- ou antitumoraux. |
|
La dualité des populations immunitaires et des cytokines dans un environnement tumoral reflète la complexité du système immunitaire face au cancer. Les connaissances sur le sujet s’accumulent et soulignent la multitude de réseaux d’interactions qui régissent le système immunitaire. La maitrise et l’élimination des évènements immunosuppressifs protégeant les cellules tumorales représentent un défi en perpétuelle évolution. La prise en considération de l’immunosuppression générée en cas de cancer est nécessaire à l’élaboration de traitements anticancéreux efficaces et adaptés, et constitue un des grands défis de l’immunothérapie moderne. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Hanahan
D
,
Weinberg
RA.
, Hallmarks of cancer: the next generation . Cell.
2011; ; 144 : :64674.. 2.
Blasco
MA
. Telomeres and human disease: ageing, cancer and beyond . Nat Rev Genet.
2005; ; 6 : :611.–622. 3.
Warburg
O
. On the origin of cancer cells . Science.
1956; ; 123 : :309.–314. 4.
Klymkowsky
MW
,
Savagner
P
. Epithelial-mesenchymal transition: a cancer researcher’s conceptual friend and foe . Am J Pathol.
2009; ; 174 : :1588.–1593. 5.
Hanahan
D
,
Folkman
J
. Patterns and emerging mechanisms of the angiogenic switch during tumorigenesis . Cell.
1996; ; 86 : :353.–364. 6.
Ferrara
N
. Pathways mediating VEGF-independent tumor angiogenesis . Cytokine Growth Factor Rev.
2010; ; 21 : :21.–26. 7.
Grivennikov
SI
,
Greten
FR
,
Karin
M
. Immunity, inflammation, and cancer . Cell.
2010; ; 140 : :883.–899. 8.
Garcia-Lora
A
,
Algarra
I
,
Garrido
F
. MHC class I antigens, immune surveillance, and tumor immune escape . J Cell Physiol.
2003; ; 195 : :346.–355. 9.
Ghiringhelli
F
,
Larmonier
N
,
Schmitt
E
, et al.
CD4+CD25+ regulatory T cells suppress tumor immunity but are sensitive to cyclophosphamide which allows immunotherapy of established tumors to be curative . Eur J Immunol.
2004; ; 34 : :336.–344. 10.
Weiss
JM
,
Bilate
AM
,
Gobert
M
, et al.
Neuropilin 1 is expressed on thymus-derived natural regulatory T cells, but not mucosa-generated induced Foxp3+ T reg cells . J Exp Med.
2012; ; 209 : :1723.–1742. 11.
Ghiringhelli
F
,
Ménard
C
,
Terme
M
, et al.
CD4+CD25+ regulatory T cells inhibit natural killer cell functions in a transforming growth factor-beta-dependent manner . J Exp Med.
2005; ; 202 : :1075.–1085. 12.
Ladoire
S
,
Martin
F
,
Ghiringhelli
F
. Prognostic role of FOXP3+ regulatory T cells infiltrating human carcinomas: the paradox of colorectal cancer . Cancer Immunol Immunother.
2011; ; 60 : :909.–918. 13.
Badoual
C
,
Hans
S
,
Rodriguez
J
, et al.
Prognostic value of tumor-infiltrating CD4+ T-cell subpopulations in head and neck cancers . Clin Cancer Res.
2006; ; 12 : :465.–472. 14.
Carreras
J
,
Lopez-Guillermo
A
,
Fox
BC
, et al.
High numbers of tumor-infiltrating FOXP3-positive regulatory T cells are associated with improved overall survival in follicular lymphoma . Blood.
2006; ; 108 : :2957.–2964. 15.
Crome
SQ
,
Clive
B
,
Wang
AW
, et al.
Inflammatory effects of ex vivo human Th17 cells are suppressed by regulatory T cells . J Immunol.
2010; ; 185 : :3199.–3208. 16.
Martin
F
,
Apetoh
L
,
Ghiringhelli
F
. Controversies on the role of Th17 in cancer: a TGF-beta-dependent immunosuppressive activity?
Trends Mol Med.
2012; ; 18 : :742.–749. 17.
Nunez
S
,
Saez
JJ
,
Fernandez
D
, et al.
Th17 cells contribute to anti-tumor immunity and promote the recruitment of th1 cells to the tumor . Immunology.
2012; ; 139 : :61.–71. 18.
Chalmin
F
,
Mignot
G
,
Bruchard
M
, et al.
Stat3 and Gfi-1 transcription factors control Th17 cell immunosuppressive activity via the regulation of ectonucleotidase expression . Immunity.
2012; ; 36 : :362.–373. 19.
Mantovani
A
. Molecular pathways linking inflammation and cancer . Curr Mol Med.
2010; ; 10 : :369.–373. 20.
Hestdal
K
,
Ruscetti
FW
,
Ihle
JN
, et al.
Characterization and regulation of RB6–8C5 antigen expression on murine bone marrow cells . J Immunol.
1991; ; 147 : :22.–28. 21.
Movahedi
K
,
Guilliams
M
,
Van den Bossche
J
, et al.
Identification of discrete tumor-induced myeloid-derived suppressor cell subpopulations with distinct T cell-suppressive activity . Blood.
2008; ; 111 : :4233.–4244. 22.
O’Garra
A
,
Vieira
P
. Regulatory T cells and mechanisms of immune system control . Nat Med.
2004; ; 10 : :801.–805. 23.
Moore
KW
,
de Waal Malefyt
R
,
Coffman
RL
,
O’Garra
A
. Interleukin-10 and the interleukin-10 receptor . Annu Rev Immunol.
2001; ; 19 : :683.–765. 24.
Connolly
EC
,
Akhurst
RJ
. The complexities of TGF-beta action during mammary and squamous cell carcinogenesis . Curr Pharm Biotechnol.
2011; ; 12 : :2138.–2149. 25.
Flavell
RA
,
Sanjabi
S
,
Wrzesinski
SH
,
Licona-Limon
P
. The polarization of immune cells in the tumour environment by TGFbeta . Nat Rev Immunol.
2010; ; 10 : :554.–567. 26.
Regateiro
FS
,
Howic
D
,
Nolan
KF
, et al.
Generation of anti-inflammatory adenosine by leukocytes is regulated by TGF-beta . Eur J Immunol.
2011; ; 41 : :2955.–2965. 27.
Kalinski
P
,
Hilkens
CM
,
Snijders
A
, et al.
IL-12-deficient dendritic cells, generated in the presence of prostaglandin E2, promote type 2 cytokine production in maturing human naive T helper cells . J Immunol.
1997; ; 159 : :28.–35. 28.
Mailliard
RB
,
Alber
SM
,
Shen
H
, et al.
IL-18-induced CD83+CCR7+ NK helper cells . J Exp Med.
2005; ; 202 : :941.–953. 29.
Kalinski
P
. Regulation of immune responses by prostaglandin E2 . J Immunol.
2012; ; 188 : :21.–28. 30.
Dankbar
B
,
Padro
T
,
Leo
R
, et al.
Vascular endothelial growth factor and interleukin-6 in paracrine tumor-stromal cell interactions in multiple myeloma . Blood.
2000; ; 95 : :2630.–2636. 31.
Pu
YS
,
Hour
TC
,
Chuang
SE
, et al.
Interleukin-6 is responsible for drug resistance and anti-apoptotic effects in prostatic cancer cells . Prostate.
2004; ; 60 : :120.–129. 32.
Chalmin
F
,
Ladoire
S
,
Mignot
G
, et al.
Membrane-associated Hsp72 from tumor-derived exosomes mediates STAT3-dependent immunosuppressive function of mouse and human myeloid-derived suppressor cells . J Clin Invest.
2010; ; 120 : :457.–471. 33.
Menetrier-Caux
C
,
Montmain
G
,
Dieu
MC
, et al.
Inhibition of the differentiation of dendritic cells from CD34+ progenitors by tumor cells: role of interleukin-6 and macrophage colony-stimulating factor . Blood.
1998; ; 92 : :4778.–4791. 34.
Nikiteas
NI
,
Tzanakis
N
,
Gazouli
M
, et al.
Serum IL-6, TNFalpha and CRP levels in Greek colorectal cancer patients: prognostic implications . World J Gastroenterol.
2005; ; 11 : :1639.–1643. 35.
Ghiringhelli
F
,
Apetoh
L
,
Tesniere
A
, et al.
Activation of the NLRP3 inflammasome in dendritic cells induces IL-1beta-dependent adaptive immunity against tumors . Nat Med.
2009; ; 15 : :1170.–1178. 36.
Bunt
SK
,
Yang
L
,
Sinha
P
, et al.
Reduced inflammation in the tumor microenvironment delays the accumulation of myeloid-derived suppressor cells and limits tumor progression . Cancer Res.
2007; ; 67 : :10019.–10026. 37.
Bruchard
M
,
Mignot
G
,
Derangère
V
, et al.
Chemotherapy-triggered cathepsin B release in myeloid-derived suppressor cells activates the Nlrp3 inflammasome and promotes tumor growth . Nat Med.
2013; ; 19 : :57.–64. 38.
Fridman
WH
,
Sautès-Fridman
C
. Le microenvironnement tumoral : matrice nourricière, champ de bataille etcible thérapeutique des cancers . Med Sci (Paris).
2014; ; 30 : :359.–365. 39.
Provot
S
. Contrôle de la croissance et de la dissémination tumorales par le microenvironnement : certitudes et hypothèses émergentes . Med Sci (Paris).
2014; ; 30 : :366.–371. 40.
Razungles
J
,
Cavaillès
V
,
Jalaguier
S
,
Teyssier
C
. L’effet Warburg . Med Sci (Paris).
2013; ; 29 : :1026.–1033. 41.
Hasmim
M
,
Messai
Y
,
Noman
MZ
,
Chouaib
S
. L’hypoxie tumorale : un déterminant clé de la réactivité stromale et de la réponse antitumorale . Med Sci (Paris).
2014; ; 30 : :422.–428. 42.
Hubert
S
,
Abastado
JP
. Les étapes précoces du processus métastatique . Med Sci (Paris).
2014; ; 30 : :378.–384. 43.
Azzi
S
,
Gavard
J
. Vaisseaux sanguins et tumeurs ou l’art du dialogue . Med Sci (Paris).
2014; ; 30 : :408.–414. 44.
Galon
J
,
Bindea
G
,
Mlecnik
B
, et al.
Microenvironnement immunitaire et cancer : intérêt de l’Immunoscore pour prédire l’évolution clinique . Med Sci (Paris).
2014; ; 30 : :339.–344. 45.
Borriello
L
,
DeClerck
YA
. Le microenvironnement tumoral et la résistance thérapeutique . Med Sci (Paris).
2014; ; 30 : :445.–451. 46.
Jamilloux
Y
,
Henry
T
. Les inflammasomes. Plates-formes de l’immunité innée . Med Sci (Paris).
2013; ; 29 : :975.–984. |