| |
| Med Sci (Paris). 2014 May; 30(5): 499–502. Published online 2014 June 13. doi: 10.1051/medsci/20143005008.Les cordes mycobactériennes Un nouveau moyen d’échappement au système immunitaire ? Audrey Bernut,1 Jean-Louis Herrmann,3 Georges Lutfalla,1 and Laurent Kremer1,2* 1Laboratoire de dynamique des interactions membranaires normales et pathologiques (DIMNP), CNRS UMR5235, université Montpellier2, place Eugène Bataillon, Montpellier, France 2Inserm, DIMNP, place Eugène Bataillon, 34095Montpellier Cedex 05, France 3EA3647-EPIM, UFR des sciences de la santé, université de Versailles St Quentin, 2, avenue de la source de la Bièvre, 78180Montigny-le-Bretonneux, France MeSH keywords: Animaux, Modèles animaux de maladie humaine, Embryon non mammalien, Humains, Souris, Mycobacterium, classification, pathogénicité, Infections à mycobactéries non tuberculeuses, complications, anatomopathologie, Infections opportunistes, Tropisme, Danio zébré |
On distingue deux groupes de mycobactéries : celles à croissance lente (MCL), incluant de nombreux agents pathogènes comme Mycobacterium tuberculosis, et celles à croissance rapide (MCR), avec environ 60 espèces répertoriées vivant en milieu hydrotellurique, dont certaines sont responsables d’infections opportunistes. Décrite depuis 1953, Mycobacterium abscessus apparaît comme la principale MCR pathogène pour l’homme [
1]. Parmi les symptômes qu’elle entraîne, les atteintes pulmonaires dominent le tableau clinique et se révèlent particulièrement sévères chez les patients atteints de mucoviscidose [
2]. Les infections à M. abscessus sont associées au développement de lésions granulomateuses pseudotuberculeuses. Du fait de son extrême résistance aux antibiotiques, les possibilités de lutte contre cette bactérie restent très limitées. M. abscessus existe sous la forme de deux morphotypes : le variant R (rough) d’aspect rugueux, et le variant S (smooth) d’aspect lisse [
3]. Des études ex vivo (macrophages ou cultures cellulaires pulmonaires humaines) et in vivo (souris) ont montré que le morphotype R était impliqué dans des manifestations plus sévères associées à une réponse pro-inflammatoire intense [
4,
5]. Malheureusement, le nombre limité de modèles animaux disponibles n’a pas encore permis de déterminer les mécanismes physiopathologiques et les facteurs de virulence nécessaires à l’installation du processus infectieux. Très prisé des aquariophiles, le danio (Danio rerio ou zebrafish), petit poisson d’eau douce originaire d’Asie, offre de nombreux avantages qui en font un bon modèle pour l’étude des maladies infectieuses [
6,
7] : (1) la transparence optique de ses embryons, qui permet un suivi spatiotemporel non invasif de l’agent infectieux in vivo ; (2) une vaste panoplie d’outils génétiques et immunologiques ; (3) un système immunitaire (inné et adaptatif) homologue à celui de l’homme. La réponse adaptative n’apparaissant qu’un mois après fécondation, les embryons ne possèdent qu’une immunité innée assurée par des macrophages et des granulocytes. Dans cette étude, nous avons exploité la transparence de l’embryon de danio pour appréhender la physiopathologie de l’infection à M. abscessus [
8]. |
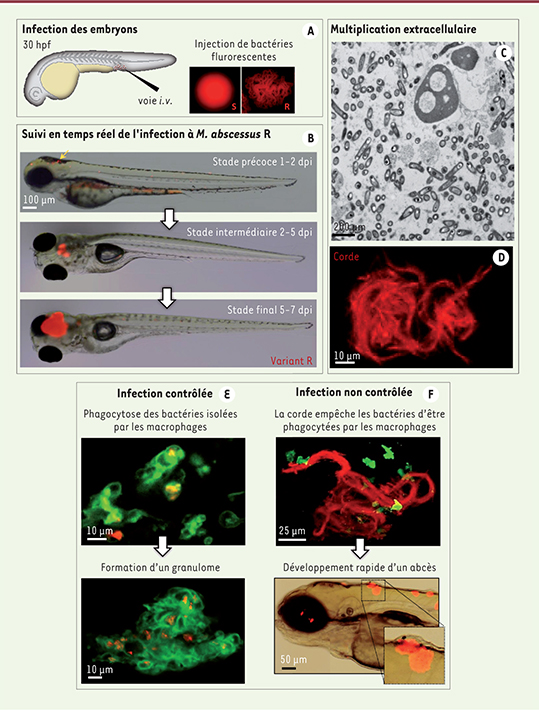
Un tropisme tissulaire inattendu Différentes techniques de microscopie permettent l’analyse dynamique in vivo du devenir des bactéries injectées dans l’embryon, tant en termes de prolifération que de localisation dans l’animal (Figure 1A). Nous avons pu confirmer que le variant R est plus virulent que le variant S. Seule la forme R déclenche une infection robuste et létale avec le développement précoce de foyers infectieux au niveau du système nerveux central, notamment dans le cerveau et/ou la moelle épinière (Figure 1B) [8]. Cette observation est d’autant plus intéressante que ce neurotropisme a été évoqué récemment dans des cas cliniques où M. abscessus traverse la barrière hémato-encéphalique et cause des lésions du système nerveux central. L’exploration ultrastructurale de ces lésions montre des abcès avec une intense division bactérienne extracellulaire (Figure 1C), ce qui est particulièrement surprenant pour des mycobactéries réputées intracellulaires.
 | Figure 1.
Le cording pour promouvoir les infections à M. abscessus. A. Les infections sont réalisées par l’injection de suspensions de bactéries fluorescentes rouges (R ou S), par voie intraveineuse, dans la veine caudale d’embryons de danio 30 heures après la fécondation (hpf). B. Le suivi en temps réel des infections à R par microscopie à épifluorescence montre dès 1-2 jours post-infection (dpi) l’apparition d’agrégats bactériens précoces (flèche rouge) spécifiquement localisés au niveau du système nerveux central, évoluant à 5-7 dpi en abcès volumineux entraînant une mort rapide du poisson. C. La microscopie électronique révèle des foyers infectieux avec une forte charge en bactéries extracellulaires. D. La microscopie confocale illustre la propension du variant R à former des cordes dès 2 ou 3 dpi. Elle montre également, dans une lignée transgénique de danio arborant des macrophages fluorescents (vert), des bactéries isolées (rouge) qui sont phagocytées par les macrophages évoluant en un granulome (E). Une fois les cordes établies (F), les macrophages, beaucoup plus petits en taille que ces dernières, se révèlent incapables de phagocyter les bactéries, qui peuvent donc se multiplier activement, entraînant la formation d’un abcès.
|
|
Quand les mycobactéries s’emmêlent … Les cordes mycobactériennes sont des réseaux tridimensionnels formés de longs « cordons » compacts constitués de multiples chaînettes parallèles de bacilles agencés bout à bout. Utilisées comme critère diagnostique de la tuberculose, ces structures sont également observées chez d’autres mycobactéries, dont M. abscessus. La conversion spontanée du morphotype S en R s’accompagne d’une capacité accrue à former des cordes in vitro et d’une acquisition de virulence [8]. La corrélation formation de cordes/virulence est admise, mais elle ne repose sur aucune démonstration directe in vivo. Des travaux ont permis de montrer que ce phénotype n’était observable que lorsque les mycobactéries sont extracellulaires [7]. Dans notre étude, des analyses complémentaires ont corroboré cet état extracellulaire de M. abscessus en révélant que, à la différence du variant S, le morphotype R forme des cordes localisées au niveau du système nerveux central (Figure 1D) [8]. Du fait d’une réplication extracellulaire intense, la taille des cordes augmente rapidement et entraîne le développement d’abcès volumineux associés à une destruction tissulaire causant la mort rapide des embryons [8]. La taille démesurée des cordes bactériennes (souvent > 100 µm) par rapport à celle des phagocytes professionnels tels que les macrophages, pourrait expliquer l’échec du système immunitaire inné à contrôler l’infection par le variant R. Nous avons montré que les bactéries isolées sont prises en charge par les macrophages qui se regroupent pour former un granulome (Figure 1E) [8], alors qu’en présence de cordes, les macrophages se révèlent incapables de phagocyter les bactéries (Figure 1F). Ces observations permettent d’établir une corrélation réelle entre formation de cordes et virulence in vivo, en soulignant le rôle de ce phénomène : (1) comme nouveau moyen d’échappement au système immunitaire en empêchant la phagocytose des bactéries ; (2) comme moyen de promouvoir la réplication extracellulaire de la bactérie et, par conséquent, l’extension de l’infection. La capacité de transition de la forme S vers la forme R permettrait à la bactérie de moduler sa taille en développant ces cordes, et cet exemple de plasticité morphologique représenterait une stratégie permettant à M. abscessus de commuter d’un phénotype de colonisation (S) vers un phénotype invasif et virulent (R) en contournant le système immunitaire inné, et ainsi garantir sa survie dans l’hôte. Cette hypothèse est confortée par des études épidémiologiques qui ont rapporté la persistance plus fréquente du variant R chez les patients atteints de mucoviscidose ou son association avec un syndrome de détresse respiratoire aiguë [
9]. |
Le macrophage, un cheval de Troie pour M. abscessus
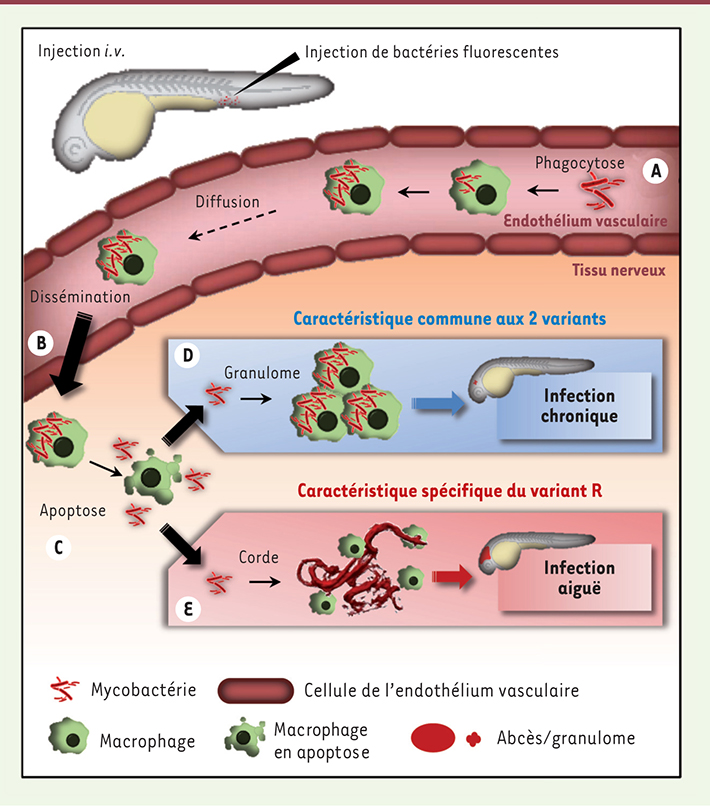
Comment expliquer le neurotropisme particulier de M. abscessus sachant que les bactéries sont injectées par voie intraveineuse ? Au site d’infection, les bactéries sont rapidement phagocytées par les macrophages (Figure 2A). Une fois infectés, ceux-ci traversent l’endothélium vasculaire et transportent les mycobactéries dans les tissus profonds du système nerveux central, suggérant leur rôle clé dans le transport et la dissémination de M. abscessus (Figure 2B). Des expériences complémentaires menées dans des embryons dépourvus de macrophages (par déplétion) ont validé ces observations en montrant que les bactéries étaient alors incapables de rejoindre le système nerveux central par leurs propres moyens, et restaient confinées dans le système vasculaire [8]. Implanté au sein du tissu nerveux, le macrophage infecté entre en apoptose, libérant ainsi le pathogène dans le milieu extracellulaire (Figure 2C) [8]. Des mécanismes propres à chacun des deux morphotypes ainsi libérés se mettent ensuite en place : (1) un processus commun aux deux variants conduit au développement de granulomes et permet un contrôle de l’infection (Figure 2D) ; (2) un processus spécifique aux infections par les mycobactéries de phénotype R, déclenché par la formation de cordes, entraîne la formation d’abcès et de lésions tissulaires (Figure 2E).
 | Figure 2.
Evénements physiopathologiques des infections à M. abscessus. Les événements précoces sont communs aux variants R et S (A-C). L’injection des bactéries par voie intraveineuse entraîne un recrutement massif de macrophages au niveau du site d’infection, lesquels phagocytent rapidement les pathogènes (A), traversent l’endothélium et transportent les mycobactéries dans les tissus profonds du système nerveux central (B). Implantés dans le tissu nerveux, les macrophages infectés entrent en apoptose, libérant ainsi les bactéries dans le milieu extracellulaire (C). D-E. À des stades plus tardifs, les infections par les variants R et S divergent. La libération des bactéries dans le milieu extracellulaire aboutit au recrutement de nouveaux macrophages et à la formation de granulomes qui permettent de contenir l’infection (D). Un processus spécifique est alors mis en place par le variant R (E), caractérisé par la formation des cordes, qui conférent aux bactéries une protection efficace vis-à-vis du système immunitaire inné leur permettant de proliférer de manière incontrôlée, ce qui conduit à la formation d’abcès et d’importants dommages tissulaires, accélérant la mort de l’embryon. |
|
Vers une approche translationnelle ? Deux autres aspects clés, encore non élucidés, sont l’extrême sensibilité des patients atteints de mucoviscidose à M. abscessus, et la résistance intrinsèque de M. abscessus à la plupart des antibiotiques. L’embryon de danio étant particulièrement propice au criblage à haut débit [
10], l’optimisation de ce système biologique pourrait permettre, en testant des librairies de composés chimiques, d’identifier des molécules actives contre M. abscessus. De plus, le rôle des cordes dans la virulence de M. abscessus pourrait être exploité en tant que nouvelle cible thérapeutique, et ainsi ouvrir la voie à de nouvelles approches prophylactiques qui constitueraient une alternative aux traitements actuels chez les patients atteints de mucoviscidose. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Medjahed
H
,
Gaillard
JL
,
Reyrat
JM
.
Mycobacterium abscessus: A new player in the mycobacterial field . Trends Microbiol.
2010; ; 18 : :117.–123. 2.
Roux
AL
,
Catherinot
E
,
Ripoll
F
, et al.
Multicenter study of prevalence of nontuberculous mycobacteria in patients with cystic fibrosis in France . J Clin Microbiol.
2009; ; 47 : :4124.–4128. 3.
Pawlik
A
,
Garnier
G
,
Orgeur
M
, et al.
Identification and characterization of the genetic changes responsible for the characteristic smooth-to-rough morphotype alterations of clinically persistent Mycobacterium abscessus
. Mol Microbiol.
2013; ; 90 : :612.–629. 4.
Byrd
TF
,
Lyons
CR
. Preliminary characterization of a Mycobacterium abscessus mutant in human and murine models of infection . Infect Immun.
1999; ; 67 : :4700.–4707. 5.
Catherinot
E
,
Clarissou
J
,
Etienne
G
, et al.
Hypervirulence of a rough variant of the Mycobacterium abscessus type strain . Infect Immun.
2007; ; 75 : :1055.–1058. 6.
van der Sar
AM
,
Appelmelk
BJ
,
Vandenbroucke-Grauls
CM
,
Bitter
W
. A star with stripes: zebrafish as an infection model . Trends Microbiol.
2004; ; 12 : :451.–457. 7.
Clay
H
,
Davis
JM
,
Beery
D
, et al.
Dichotomous role of the macrophage in early Mycobacterium marinum infection of the zebrafish . Cell Host Microbe.
2007; ; 2 : :29.–39. 8.
Bernut
A
,
Herrmann
JL
,
Kissa
K
, et al.
Mycobacterium abscessus cording prevents phagocytosis and promotes abscess formation . Proc Natl Acad Sci USA 2014. ; 111 : :E943.–E952. 9.
Catherinot
E
,
Roux
AL
,
Macheras
E
, et al.
Acute respiratory failure involving an R variant of Mycobacterium abscessus
. J Clin Microbiol.
2009; ; 47 : :271.–274. 10.
Takaki
K
,
Cosma
CL
,
Troll
MA
,
Ramakrishnan
L
. An in vivo platform for rapid high-throughput antitubercular drug discovery . Cell Rep.
2012; ; 2 : :175.–184. |