| |
| Med Sci (Paris). 2014 May; 30(5): 508–510. Published online 2014 June 13. doi: 10.1051/medsci/20143005011.Les anticorps anti-VIH-1 et la transmission virale de cellule à cellule Marine Malbec,1,2 Hugo Mouquet,2 and Olivier Schwartz1* 1Institut Pasteur, département de virologie, unité virus et immunité, CNRS, URA3015, 28 rue du docteur Roux, F-75015, Paris, France 2Institut Pasteur, département d’immunologie, groupe G5 réponse humorale aux pathogènes, CNRS URA1961, 28, rue du docteur Roux, F-75015, Paris, France MeSH keywords: Anticorps neutralisants, immunologie, usage thérapeutique, Anticorps antiviraux, Infections à VIH, thérapie, virologie, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), physiologie, Cellules HeLa, Humains, Jonctions intercellulaires, effets des médicaments et des substances chimiques, Pénétration virale |
Une des avancées majeures de ces cinq dernières années concernant la lutte contre l’infection par le virus de l’immunodéficience humaine de type 1 (VIH-1) est l’isolement et la caractérisation d’anticorps humains neutralisants, à large spectre ou broadly neutralizing antibodies (bNAb), agissant à basse concentration sur la majorité des isolats viraux [
11] (→). L’activité antivirale de ces anticorps était généralement mesurée in vitro contre des particules virales libres. Cependant, le VIH-1 se propage préférentiellement et beaucoup plus efficacement par contacts directs entre cellules. Nous avons donc étudié la capacité de ces anticorps à inhiber la transmission virale de cellule à cellule. Seuls quelques bNAb présentent cette propriété, et bloquent chacune des étapes de l’infection intercellulaire. Des essais cliniques avec ces anticorps devraient permettre d’évaluer leur potentiel thérapeutique.
(→) Voir la Synthèse de M. Peressin et al., m/s n° 1, janvier 2014, page 69
|
Les anticorps à large spectre neutralisant le VIH-1 Un mécanisme de défense du système immunitaire en réponse aux infections virales est la production d’anticorps neutralisants. Trente ans après la découverte du VIH-1, un vaccin induisant de tels anticorps se fait toujours attendre. Cela est en partie dû à la grande variabilité génétique du virus. Le VIH-1 est divisé en groupes (ou clades), eux-mêmes subdivisés en sous-types parmi lesquels on trouve différentes souches. Certains patients, après deux à quatre ans d’infection, développent des anticorps neutralisants à large spectre (bNAb), dits cross-clade, neutralisant in vitro la plupart des isolats de VIH-1. Alors qu’ils étaient considérés comme des exceptions il y a quelques années, ces individus représenteraient jusqu’à 10 à 20 % des personnes infectées. Malheureusement pour ces patients, la présence de bNAb n’est pas corrélée avec une évolution favorable de la maladie en absence de traitement antirétroviral, des virus résistants à la réponse humorale apparaissant continuellement [
1]. Jusqu’à récemment, les anticorps neutralisants clonés à partir de lymphocytes B humains disponibles étaient souvent peu actifs ou peu cross-réactifs. La mise au point de nouvelles techniques de criblage et d’isolement d’anticorps monoclonaux humains a révolutionné ce domaine de recherche. Grâce à ces évolutions technologiques, plusieurs dizaines de bNAb « de nouvelle génération », inhibant in vitro, à de très faibles concentrations, près de 90 % des isolats viraux connus sont maintenant disponibles [
2]. Les anticorps neutralisants agissent en se fixant à l’enveloppe virale, et ils inhibent l’entrée du virus dans la cellule. La protéine d’enveloppe (Env), présente sous forme de trimères à la surface des virions, est constituée de deux sous-unités : la glycoprotéine gp120, responsable de la liaison au récepteur CD4, et la glycoprotéine transmembranaire gp41, qui assure la fusion des membranes. Malgré la capacité du VIH-1 à masquer les régions les plus conservées de son enveloppe, par exemple en les protégeant d’un bouclier de glycanes, quatre domaines de l’enveloppe représentent les cibles privilégiées des bNAb : le site de liaison à CD4 (CD4bs, CD4 binding site), les boucles variables V1/V2 et V3 associées aux glycanes, ainsi que la région proximale externe de la sous-unité gp41 (MPER) [2]. |
Le VIH-1, un virus qui se transmet de cellule à cellule via des synapses L’activité antivirale des bNAb est habituellement évaluée in vitro sur des lignées de cellules modifiées dérivées des cellules HeLa, en testant leur capacité à inhiber l’infection par des particules virales « libres », ajoutées dans le milieu de culture. Cependant, le VIH-1 se propage 100 à 1 000 fois plus efficacement par contact direct entre un lymphocyte infecté et un lymphocyte non infecté qu’à partir de particules virales libres [
3]. Il existe différents modes de transmission cellule-cellule, comme par exemple par des filopodes ou des nanotubes. Le mode de transmission le plus efficace est probablement par formation d’une synapse virologique (Figure 1). Cette structure correspond à la zone de jonction entre la cellule infectée et la cellule cible. Les protéines virales s’y accumulent (notamment Env et la capside Gag), et les virions bourgeonnent grâce à la mobilisation du cytosquelette d’actine. Sur la cellule cible, ce contact induit la relocalisation des récepteurs CD4 et des corécepteurs CCR5 ou CXCR4 à la synapse [
4,
5]. La transmission intercellulaire est un processus rapide, dynamique et continu qui peut être décomposé en différentes étapes : (1) formation de conjugués entre la cellule infectée et la cible en réponse à l’interaction Env-CD4 ; (2) établissement de la synapse avec polarisation des protéines virales et cellulaires à l’interface ; (3) transfert physique des virions via la fente synaptique, de la cellule infectée vers la cible ; (4) entrée massive des virus et infection de la cellule cible [4]. La forte multiplicité d’infection ainsi créée pourrait diminuer la sensibilité aux traitements antirétroviraux [
6], et faciliter l’échappement viral en réponse à la pression exercée par le système immunitaire.
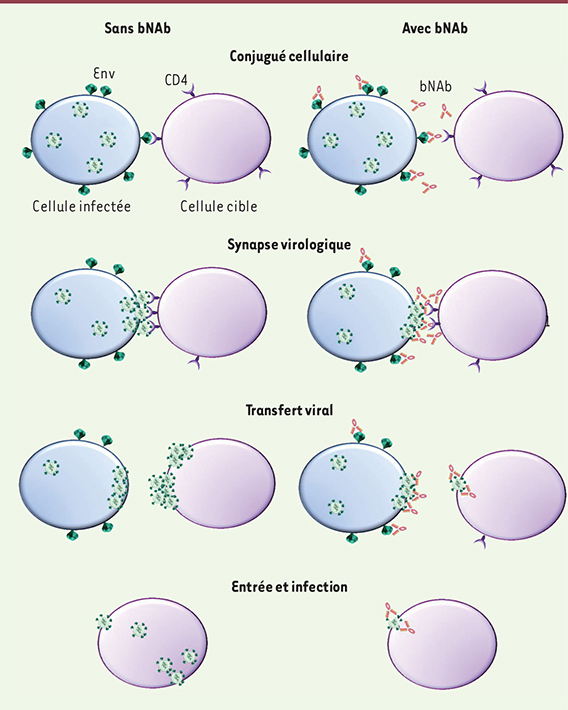
 | Figure 1.
Représentation schématique de la transmission cellule-cellule du VIH et mécanismes de neutralisation des broadly neutralizing antibodies (bNAb). La transmission cellule-cellule du VIH peut être décomposée en différentes étapes. (1) Formation d’un conjugué entre une cellule infectée et une cellule cible grâce à l’interaction entre les molécules d’enveloppe virale (Env) exprimées à la surface de la cellule infectée et le récepteur CD4. (2) Formation de la synapse virologique avec accumulation des virions, Env et CD4 au niveau de la zone de contact. (3) Transfert des particules virales nouvellement formées vers la cellule cible. (4) Entrée des virions capturés dans le cytoplasme de la cellule cible et infection. Les bNAb interfèrent avec chacune de ces étapes. Ils agissent en se fixant à l’enveloppe virale empêchant l’interaction Env-CD4. Les bNAb bloquent donc la formation de conjugués et de synapses virologiques. Ils s’associent aux particules virales capturées par les cellules cibles inhibant ainsi leur infection. |
|
Effet des anticorps neutralisants sur la transmission du VIH-1 de cellule à cellule Il nous a paru important de déterminer si les bNAb de nouvelle génération empêchaient la transmission intercellulaire du VIH-1. En collaboration avec l’équipe de Michel C. Nussenzweig (The Rockefeller University, New York) qui a généré la plupart de ces nouveaux anticorps [2], nous avons confirmé qu’ils bloquent, quel que soit l’épitope de Env ciblé, l’infection par des particules virales « libres ». Ces bNAb sont puissants, agissant à des concentrations inhibitrices (IC50) entre 0,05 et 1 µg/mL selon l’anticorps. De façon surprenante, la plupart de ces bNAb ne bloquent pas la transmission directe de cellule à cellule. Seuls certains anticorps ciblant le CD4bs (anticorps NIH45-46, 3BNC60) et la boucle V3 et les glycanes environnants (PGT121 et 10-1074), inhibent efficacement ce mode de transmission virale. De plus, pour ces quatre bNAb, les IC50 sont de 10 à 20 fois supérieures à celles qui sont nécessaires à la neutralisation des virus libres [
7]. Ces quatre anticorps partagent certaines particularités, dont celle d’être parmi les meilleurs neutralisateurs de virus libres. Mais si cette condition est nécessaire, elle n’est pas suffisante pour obtenir un anticorps bloquant la transmission intercellulaire du virus. Nous avons donc étudié plus précisément le mode d’action de ces bNAb (Figure 1). Par microscopie confocale, nous avons observé qu’ils s’accumulaient au niveau de la synapse virologique (Figure 2). De plus, en se fixant aux protéines Env exprimées à la surface des cellules infectées, les bNAb inhibent la formation de conjugués entre cellules infectées et cellules cibles. Leur liaison aux particules virales diminue les interactions entre enveloppe et récepteurs, limite fortement la capture de matériel viral par les cellules cibles, l’étape d’entrée du virus dans la cellule et donc le processus d’infection productive (Figure 1) [7] .
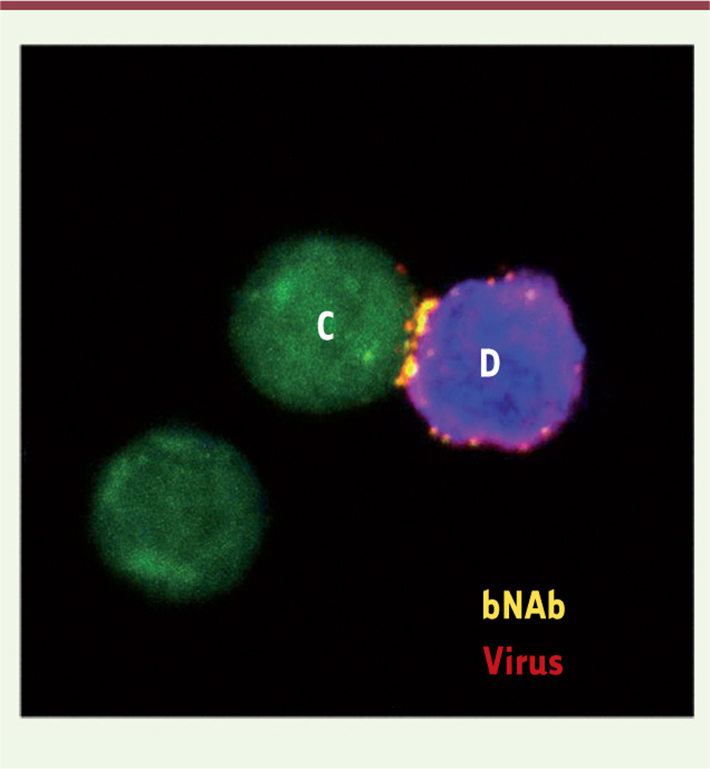
 | Figure 2.
Synapse virologique en présence de bNAb. Synapse virologique formée entre un lymphocyte infecté (cellule donneuse D en bleu) et un lymphocyte non infecté (cellule cible C en vert). Les virus (en rouge) et les bNAb (en jaune) s’accumulent au niveau de la zone de contact. |
Ces anticorps présentent également d’autres caractéristiques. Ils agissent non seulement sur la transmission du virus entre lymphocytes, mais inhibent aussi le transfert du VIH-1 aux cellules dendritiques plasmacytoïdes et la production d’interféron par ces cellules en réponse à l’infection [7]. En résumé, nos résultats indiquent que seuls quelques bNAb de nouvelle génération, parmi les plus puissants, bloquent la transmission du virus de cellule à cellule. La propriété de neutralisation de la dissémination virale par contact cellulaire doit donc être considérée comme une caractéristique essentielle pour évaluer le potentiel thérapeutique ou prophylactique des bNAb. |
Prochaine étape : essais cliniques Des résultats spectaculaires ont aussi été récemment obtenus chez l’animal (chez le singe ou chez la souris humanisée) [
8–
10]. L’administration passive de bNAb de nouvelle génération, ou leur sécrétion dans la circulation sanguine par des vecteurs de type adeno-associated virus (AAV), induit un effet antiviral thérapeutique ou prophylactique. Deux équipes américaines ont ainsi montré que la combinaison de deux bNAb ciblant le CD4bs (3BNC117) et la bouche V3-glycanes (10-1074 ou PGT121) supprime pendant plusieurs semaines la virémie de macaques infectés chroniquement par le SHIV (virus chimère constitué du génome de l’immunodéficience simienne et de l’enveloppe du VIH-1) [8,
9]. Ces bNAb confèrent également individuellement une immunité stérilisante contre le SHIV [8, 9]. Il est intéressant de noter que les bNAb actifs chez l’animal sont ceux qui sont capables de bloquer la propagation virale de cellule à cellule en culture [7]. Les anticorps monoclonaux sont utilisés chez l’homme pour le traitement de nombreuses pathologies tumorales, inflammatoires ou auto-immunes1. Les premiers essais cliniques chez l’homme utilisant le transfert passif de bNAb anti-VIH-1 devraient apporter des éléments de réponse cruciaux dans un avenir relativement proche. Si ils s’avèrent efficaces, ils pourraient rejoindre la panoplie des molécules antivirales disponibles sur le marché, et être utilisés à visée préventive ou thérapeutique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Euler
Z
,
van den Kerkhof
TL
,
van Gils
MJ
, et al.
Longitudinal analysis of early HIV-1-specific neutralizing activity in an elite neutralizer and in five patients who developed cross-reactive neutralizing activity . J Virol.
2012; ; 86 : :2045.–2055. 2.
Klein
F
,
Mouquet
H
,
Dosenovic
P
, et al.
Antibodies in HIV-1 vaccine development and therapy . Science.
2013; ; 341 : :1199.–1204. 3.
Sourisseau
M
,
Sol-Foulon
N
,
Porrot
F
, et al.
Inefficient human immunodeficiency virus replication in mobile lymphocytes . J Virol.
2007; ; 81 : :1000.–1012. 4.
Dale
BM
,
Alvarez
RA
,
Chen
BK
. Mechanisms of enhanced HIV spread through T-cell virological synapses . Immunol Reviews.
2013; ; 251 : :113.–124. 5.
Rudnicka
D
,
Feldmann
J
,
Porrot
F
, et al.
Simultaneous cell-to-cell transmission of human immunodeficiency virus to multiple targets through polysynapses . J Virol.
2009; ; 83 : :6234.–6246. 6.
Sigal
A
,
Kim
JT
,
Balazs
AB
, et al.
Cell-to-cell spread of HIV permits ongoing replication despite antiretroviral therapy . Nature.
2011; ; 477 : :95.–98. 7.
Malbec
M
,
Porrot
F
,
Rua
R
, et al.
Broadly neutralizing antibodies that inhibit HIV-1 cell to cell transmission . J Exp Med.
2013; ; 210 : :2813.–2821. 8.
Barouch
DH
,
Whitney
JB
,
Moldt
B
, et al.
Therapeutic efficacy of potent neutralizing HIV-1-specific monoclonal antibodies in SHIV-infected rhesus monkeys . Nature.
2013; ; 503 : :224.–228. 9.
Shingai
M
,
Nishimura
Y
,
Klein
F
, et al.
Antibody-mediated immunotherapy of macaques chronically infected with SHIV suppresses viraemia . Nature.
2013; ; 503 : :277.–280. 10.
Horwitz
JA
,
Halper-Stromberg
A
,
Mouquet
H
, et al.
HIV-1 suppression and durable control by combining single broadly neutralizing antibodies and antiretroviral drugs in humanized mice . Proc Natl Acad Sci USA.
2013; ; 110 : :16538.–16543. 11.
Peressin
M
,
Holl
V
,
Moog
C
. Les anticorps anti-VIH: multiples activités antivirales . Med Sci (Paris).
2014; ; 30 : :69.–75. |