| |
| Med Sci (Paris). 2014 June; 30(6-7): 627–630. Published online 2014 July 11. doi: 10.1051/medsci/20143006010.Plasticité de la barrière hémato-hypothalamique Rôle dans l’homéostasie énergétique Bénédicte Dehouck,1,2* Vincent Prévot,1 and Fanny Langlet1 1Inserm U837, JPARC - développement et plasticité du cerveau postnatal, 59045Lille cedex, France; Université de Lille Nord de France, faculté de médecine, 59044Lille Cedex, France 2Université d’Artois, 62800Liévin, France MeSH keywords: Animaux, Barrière hémato-encéphalique, physiologie, Métabolisme énergétique, Jeûne, métabolisme, Homéostasie, Humains, Hypoglycémie, Hypothalamus, Souris, Facteur de croissance endothéliale vasculaire de type A |
L’homéostasie énergétique est en partie régulée au niveau des noyaux hypothalamiques. Parmi ces noyaux, le noyau arqué joue un rôle clé en intégrant les informations périphériques l’informant de l’état énergétique de l’individu [
1]. Ce noyau communique avec les autres noyaux hypothalamiques pour réguler la prise alimentaire et la dépense énergétique en fonction des besoins de l’organisme [
2,
17] (Figure 1) (→). Dans ce contexte, l’accès des molécules périphériques au noyau arqué est une étape importante dans la régulation de la balance énergétique. Nous nous sommes intéressés aux capillaires cérébraux qui irriguent le noyau arqué, et dont l’environnement et la provenance diffèrent des capillaires des autres structures cérébrales ; ces caractéristiques permettent une régulation spécifique et dynamique de l’accès des molécules circulantes au noyau arqué dans le cadre de la régulation de la balance énergétique.
(→) Voir la Nouvelle de E. Balland et V. Prévot, page 624 de ce numéro
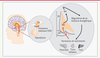 | Figure 1.
Localisation et rôle du noyau arqué hypothalamique. Le noyau arqué et l’éminence médiane sont situés à la base du troisième ventricule dans la région tubérale de l’hypothalamus. Le noyau arqué joue un rôle important en intégrant les informations hormonales et humorales provenant des tissus adipeux et du tractus digestif. Ces messages l’informent de l’état énergétique de l’individu. Le noyau arqué communique avec les autres noyaux hypothalamiques pour réguler la prise alimentaire et la dépense énergétique en fonction des besoins de l’organisme. Dans ce contexte, l’accès des molécules périphériques au noyau arqué est une étape importante dans la régulation de la balance énergétique. Nos études s’intéressent aux capillaires cérébraux qui irriguent le noyau arqué, et dont l’environnement et la provenance diffèrent des capillaires des autres structures cérébrales de part la proximité de ce noyau avec l’éminence médiane (figure 2). 3V : troisième ventricule ; EM : éminence médiane; NA : noyau arqué; NH : noyaux hypothalamiques. |
|
Interface sang/noyau arqué hypothalamique Les capillaires cérébraux irriguant le noyau arqué sont différents des vaisseaux de la barrière hémato-encéphalique dans le reste du système nerveux central. Cette particularité est liée à la proximité de ce noyau avec un organe circumventriculaire appelé éminence médiane, dont les vaisseaux sont de type « fenêtrés ». Ces vaisseaux sont dépourvus des jonctions serrées caractéristiques des cellules endothéliales des vaisseaux de la barrière hémato-encéphalique et lui conférant des propriétés de barrière1. De plus, ces vaisseaux présentent des fenestrations (pores) qui permettent une diffusion passive et non sélective des molécules vers le parenchyme cérébral. Ils ne forment donc pas une barrière [
3,
4]. Le noyau arqué et l’éminence médiane partagent des propriétés structurales. Tous deux sont alimentés par les artères hypophysaires, et certains vaisseaux irriguant l’éminence médiane irriguent aussi le parenchyme du noyau arqué. Alors que ces vaisseaux sont fenêtrés dans le parenchyme de l’éminence médiane, ils vont acquérir des propriétés de barrière lorsqu’ils atteignent le parenchyme du noyau arqué. La majorité des capillaires cérébraux forment la barrière hémato-encéphalique dont les propriétés sont induites par les astrocytes qui les entourent [
5], et au niveau de laquelle s’effectuent les échanges sélectifs sang/cerveau [4]. Au niveau du noyau arqué, les capillaires sont entourés par des pieds tanycytaires, et non par des astrocytes [4]. Les tanycytes sont les cellules épendymaires, initialement décrites au niveau de l’éminence médiane, qui régulent les échanges entre le compartiment ventriculaire, baigné par le LCR, et les vaisseaux fenêtrés : on parle de barrière tanycytaire [
6, 17] (→). Habituellement observés au niveau des organes circumventriculaires, ces tanycytes forment, via l’expression de complexes jonctionnels organisés, une barrière tanycytaire qui permet de maintenir l’homéostasie cérébrale là où les vaisseaux fenêtrés de ces structures ne l’assurent pas [4,
7] (Figure 2).
(→) Voir la Nouvelle de E. Balland et V. Prévot, page 624 de ce numéro
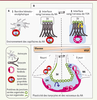 | Figure 2.
Plasticité de l’interface sang/noyau arqué hypothalamique lors d’une mise à jeun. A. L’environnement des capillaires cérébraux (rouge) au niveau du noyau arqué hypothalamique (NA) diffère de celui des autres régions du cerveau : les pieds astrocytaires (1) sont remplacés par des pieds tanycytaires (2). Ces tanycytes forment la paroi ventriculaire bordant le NA et envoient leurs prolongements sur des vaisseaux présentant des propriétés de barrière (rouge). Bien qu’exprimant des protéines de jonctions serrées (trait vert), les tanycytes du NA ne s’organisent pas en barrière tanycytaire ; le contrôle des échanges sang/cerveau s’effectue au niveau des capillaires cérébraux (flèche bleue). Au contraire, les tanycytes situés au niveau des organes circumventriculaires (3) régulent les échanges entre le compartiment ventriculaire et les vaisseaux fenêtrés (rose). Ces tanycytes forment une barrière tanycytaire (hexagone vert) qui permet de maintenir l’homéostasie cérébrale malgré la présence de fenestrations dans ces structures (flèche jaune). B. Lors d’un jeûne de 24 h, les capillaires du NA deviennent fenêtrés, perdant ainsi leur propriété de barrière sélective. Ces propriétés de barrière sont alors acquises par les cellules qui les entourent : les tanycytes. Ainsi, lors d’un déséquilibre énergétique, l’interface sang/cerveau du NA acquiert les propriétés décrites au niveau de l’éminence médiane (EM) (flèches noires dans A et B) : ceci permet aux signaux périphériques d’atteindre leurs cibles neuronales (fond bleu) afin de rétablir la balance énergétique. Ces modifications structurales sont induites par l’hypoglycémie, qui engendre une augmentation de la synthèse de VEGFA par les tanycytes. 3V : troisième ventricule. |
Il y a donc deux barrières : une barrière tanycytaire entre le sang et le LCR, et une barrière hémato-encéphalique entre le sang et le parenchyme. Ce qui change, c’est la place des jonctions serrées, qui sont sur les cellules endothéliales ou sur les tanycytes. Ainsi, les tanycytes caractéristiques de l’éminence médiane s’étendent à la paroi ventriculaire bordant le noyau arqué. Ils y envoient des prolongements sur les capillaires du noyau arqué qui, contrairement à ceux de l’éminence médiane, présentent des jonctions serrées et pas de fenestrations (Figure 2A). Ainsi la provenance et l’environnement des capillaires du noyau arqué diffèrent de ceux des vaisseaux irriguant les autres parties du cerveau. Nos travaux ont montré que ces caractéristiques structurales avaient un rôle fonctionnel dans la régulation de l’accès des messages sanguins au niveau des neurones du noyau arqué [
8]. |
Plasticité de l’interface sang/noyau arqué hypothalamique Lors d’un déséquilibre énergétique, telle que la mise à jeun, un rétablissement de la balance énergétique nécessite un échange d’informations entre le noyau arqué et la périphérie. Nos résultats montrent qu’en effet l’accès de signaux métaboliques au noyau arqué est augmenté lors d’un jeûne de 24 h chez la souris [8,
9]. Ceci résulte d’une modification structurale des vaisseaux du noyau arqué. Certains de ces capillaires deviennent fenêtrés, perdant ainsi leur propriété de barrière sélective. Ces propriétés sont alors exercées par les cellules qui les entourent, les tanycytes. Ainsi, lors d’un déséquilibre énergétique (animal à jeun), l’interface sang/noyau arqué se réorganise pour permettre aux signaux périphériques d’atteindre leurs cibles neuronales (Figure 2B) : la barrière hémato-encéphalique disparaît, et une barrière tanycytaire se forme. Chez l’animal nourri, c’est l’inverse. L’hypoglycémie est responsable de la plasticité de l’interface sang/noyau arqué lors du jeûne Le rôle du glucose dans la régulation de la balance énergétique est établi depuis 1953 [
10]. La théorie dite « glucostatique » est basée sur l’observation suivante : une hypoglycémie entraîne la sensation de faim et la prise alimentaire ; au contraire, une hyperglycémie entraîne la satiété et l’arrêt de l’alimentation. Ces modifications de comportements sont en partie entraînées par l’activation et/ou l’inhibition des neurones orexigènes et/ou anorexigènes du noyau arqué. Nous nous sommes posés la question du rôle du glucose dans l’accès des signaux périphériques responsables de l’activité neuronale de ce noyau. Afin de déterminer si l’hypoglycémie induite par le jeûne de 24 h joue un rôle dans la plasticité des capillaires et des tanycytes du noyau arqué, les animaux mis à jeun ont été perfusés avec une solution de glucose rétablissant la glycémie. Cette expérience a montré que le maintien de la glycémie lors du jeûne inhibe la fenestration des capillaires du noyau arqué ainsi que la réorganisation de l’épendyme en barrière tanycytaire. Le rôle du statut glucidique est donc prépondérant dans l’accès des signaux périphériques aux noyaux hypothalamiques impliqués dans la régulation de l’équilibre énergétique. Le VEGFA est impliqué dans la plasticité de l’interface sang/noyau arqué Le facteur de croissance vasculaire (VEGF pour vascular endothelial growth factor) est principalement décrit pour son rôle dans la formation de nouveaux vaisseaux. Cependant, il est aussi à l’origine des fenestrations de l’endothélium présentes physiologiquement dans divers organes [
11]. Dans le cerveau, il permet le maintien des fenestrations de l’endothélium des plexus choroïdes, structures à l’origine de la production du liquide céphalorachidien [
12]. Nos travaux montrent l’implication directe du VEGFA (une des cinq isoformes du VEGF) dans la plasticité de l’endothélium des capillaires cérébraux du noyau arqué. En effet, l’injection de VEGFA dans le troisième ventricule d’un animal nourri permet d’induire de manière sélective la fenestration des vaisseaux du noyau arqué qui présentaient initialement des propriétés de barrière. À l’inverse, l’injection d’anticorps bloquant la fixation du VEGFA à ses récepteurs inhibe la fenestration des vaisseaux induite par le jeûne. |
Les tanycytes sont la source du VEGFA impliqué dans les fenestrations endothéliales Nos travaux ont montré que les tanycytes synthétisent et sécrètent le VEGFA qui serait à l’origine des fenestrations de l’endothélium des organes circumventriculaires. Lors de la période de jeûne, la synthèse du VEGFA par les tanycytes est augmentée, concommitament à l’apparition de fenestrations au niveau des vaisseaux du noyau arqué. Si on inhibe cette synthèse spécifiquement dans les tanycytes, la plasticité des capillaires et de l’épendyme, normalement induite par le jeûne au niveau du noyau arqué, est abolie [8]. Ceci confirme le rôle primordial des tanycytes dans la plasticité de l’interface sang/noyau arqué via une variation du taux de VEGFA. Bien que cela ne soit pas démontré, ces cellules pourraient aussi détecter l’hypoglycémie induite par le jeûne. En effet, à l’instar des neurones dits glucosenseurs ou des cellules bêta des cellules pancréatiques, les tanycytes sont capables de répondre au glucose [
13,
14]. Ces études confortent l’étroite corrélation observée entre la glycémie et la synthèse de VEGFA [
15]. |
La plasticité de l’interface sang/noyau arqué assure des réponses métaboliques et comportementales adaptées au maintien de l’homéostasie énergétique Chez l’animal nourri, l’absence de barrière tanycytaire au niveau de la paroi ventriculaire jouxtant le noyau arqué favorise les échanges entre le liquide céphalo-rachidien (LCR) et le parenchyme cérébral [4]. Au contraire, lors du jeûne, la réorganisation des tanycytes en une barrière ainsi que la fenestration des vaisseaux privilégient le dialogue entre le sang et le parenchyme du noyau arqué et l’accessibilité du noyau arqué aux messages venant de la périphérie. En revanche, ces molécules circulantes qui passent librement dans le parenchyme ne peuvent pas traverser la paroi ventriculaire : elles s’accumulent dans le parenchyme du noyau arqué. Cette barrière tanycytaire empêche les molécules d’accéder au liquide céphalo rachidien, et donc de diffuser dans le reste du cerveau, préservant l’homéostasie cérébrale. En effet, après le jeûne, nous observons une augmentation du taux de ghréline – molécule orexigène synthétisée par l’estomac – dans le noyau arqué ainsi que la stimulation des neurones cibles de cette molécule [9]. Ce phénomène explique le pic d’hyperphagie observé lors de la réalimentation des animaux, dont le but est de rétablir la balance énergétique. Cependant, l’accès au noyau arqué n’est pas réservé à la ghréline ; nos travaux ont montré que toute molécule (< 40 kDa) circulante pouvait y pénétrer lors de la réorganisation de l’endothélium du noyau arqué. À l’écoute de notre organisme via le noyau arqué, les noyaux hypothalamiques adaptent les réponses métaboliques et comportementales nécessaires au maintien de l’homéostasie énergétique. |
Nos études proposent un nouveau concept de régulation des échanges entre le compartiment sanguin et le parenchyme cérébral via l’apparition de fenestrations au niveau des capillaires cérébraux, qui perdent leurs propriétés de barrière alors que les tanycytes en organisent une. Le glucose joue un rôle crucial dans cette réorganisation et donc dans le contrôle de l’accès des molécules périphériques au noyau arqué. On peut également faire l’hypothèse d’une altération de cette communication sang/noyaux hypothalamiques dans certaines pathologies métaboliques telles que l’obésité, le diabète et l’anorexie. En effet, celles-ci ont en commun des phénomènes de « résistance hormonale » dans lesquels les signaux périphériques sont incapables d’induire leurs effets sur les centres nerveux. Ces études soulignent aussi le rôle des organes circumventriculaires dans le contrôle de l’accès des molécules circulantes à leurs cibles neuronales. Ces structures, bien que discrètes, ont une position stratégique car elles sont proches de nombreux centres régulateurs. Compte tenu de leur organisation commune [7], il est possible que des phénomènes de plasticité des interfaces sang/cerveau interviennent de la même façon dans la régulation d’autres fonctions nécessaires au maintien de l’homéostasie de notre organisme, par exemple dans la fonction de reproduction [
16]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été financés par l’ANR-05-JCJC, ANR-09-BLAN-0267 et la Fondation pour la recherche médicale (équipe FRM 2005). Fanny Langlet a bénéficié d’une allocation de recherche du ministère de la Recherche pour le financement de sa thèse.
|
Footnotes |
1.
Bouret
S
. Être connecté pour mieux manger . Med Sci (Paris).
2004; ; 20 : :958.–959. 2.
Luquet
S
. Du nouveau dans la régulation de la prise alimentaire ? . Med Sci (Paris).
2008; ; 24 : :680.–682. 3.
Ciofi
P
,
Garret
M
,
Lapirot
O
, et al.
Brain-endocrine interactions: a microvascular route in the mediobasal hypothalamus . Endocrinology.
2009; ; 150 : :5509.–5519. 4.
Mullier
A
,
Bouret
SG
,
Prevot
V
,
Dehouck
B
. Differential distribution of tight junction proteins suggests a role for tanycytes in blood-hypothalamus barrier regulation in the adult mouse brain . J Comp Neurol.
2010; ; 518 : :943.–962. 5.
Gosselet
F
,
Candela
P
,
Cecchelli
R
,
Fenart
L
. La barrière hémato-encéphalique : une nouvelle cible thérapeutique dans la maladie d’Alzheimer . Med Sci (Paris).
2011; ; 27 : :987.–992. 6.
Balland
E
,
Dam
J
,
Langlet
F
, et al.
Hypothalamic Tanycytes Are an ERK-Gated Conduit for Leptin into the Brain . Cell Metab.
2014; ; 19 : :293.–301. 7.
Langlet
F
,
Mullier
A
,
Bouret
SG
, et al.
Tanycyte-like cells form a blood-cerebrospinal fluid barrier in the circumventricular organs of the mouse brain . J Comp Neurol.
2013; ; 521 : :3389.–3405. 8.
Langlet
F
,
Levin
BE
,
Luquet
S
, et al.
Tanycytic VEGF-A boosts blood-hypothalamus barrier plasticity and access of metabolic signals to the arcuate nucleus in response to fasting . Cell Metab.
2013; ; 17 : :607.–617. 9.
Schaeffer
M
,
Langlet
F
,
Lafont
C
, et al.
Rapid sensing of circulating ghrelin by hypothalamic appetite-modifying neurons . Proc Natl Acad Sci USA.
2013; ; 110 : :1512.–1517. 10.
Van Itallie
TB
,
Beaudoin
R
,
Mayer
J
. Arteriovenous glucose differences, metabolic hypoglycemia and food intake in man . J Clin Nutr.
1953; ; 1 : :208.–217. 11.
Kamba
T
,
Tam
BY
,
Hashizume
H
, et al.
VEGF-dependent plasticity of fenestrated capillaries in the normal adult microvasculature . Am J Physiol Heart Circ Physiol.
2006; ; 290 : :H560.–H576. 12.
Esser
S
,
Wolburg
K
,
Wolburg
H
, et al.
Vascular endothelial growth factor induces endothelial fenestrations in vitro . J Cell Biol.
1998; ; 140 : :947.–959. 13.
Frayling
C
,
Britton
R
,
Dale
N
. ATP-mediated glucosensing by hypothalamic tanycytes . J Physiol.
2011; ; 589 : :2275.–2286. 14.
Bolborea
M
,
Dale
N
. Hypothalamic tanycytes: potential roles in the control of feeding and energy balance . Trends Neurosci.
2013; ; 36 : :91.–100. 15.
Larger
E
. Hyperglycémie et angiogenèse . Med Sci (Paris).
2003; ; 19 : :840.–846. 16.
Bellefontaine
N
,
Chachlaki
N
,
Parkash
J
, et al.
Leptin facilitates reproduction through neuronal nitric oxide signaling in the hypothalamic preoptic region . J Clin Invest.
2014; ; 124 : :2550.–2559. 17.
Balland
E
,
Prévot
V
. Les tanycytes hypothalamiques : porte d’entrée de la leptine dans le cerveau . Med Sci (Paris).
2014; ; 30 : :624.–627. |