| |
| Med Sci (Paris). 2014 June; 30(6-7): 665–670. Published online 2014 July 11. doi: 10.1051/medsci/20143006017.La synapse immunologique Une plate-forme de signalisation dynamique pour l’activation des lymphocytes T Jérôme Bouchet1** and Andrés Alcover1* 1Institut Pasteur, département d’immunologie, unité de biologie cellulaire des lymphocytes, Paris, France 2CNRS, unité de recherche associée1961, Paris, France |

Le terme « synapse immunologique » a été utilisé pour la première fois en 1984 par analogie à la synapse neuronale [
1] ; il est utilisé couramment depuis 1998, suite à la date de la caractérisation d’éléments clés de sa composition moléculaire et de son organisation spatiale [
2,
3]. Si la synapse neuronale présente une structure intercellulaire stable dans la durée, les échanges entre les cellules du système immunitaire sont, quant à eux, plus transitoires [
4]. Dans les ganglions lymphoïdes, les lymphocytes T circulants interagissent de façon dynamique avec des cellules présentatrices d’antigènes (par exemple, les cellules dendritiques) ayant migré dans ces organes après capture d’antigènes (par exemple, des bactéries, virus, toxines) dans les épithéliums et tissus interstitiels. Ces rencontres cellulaires permettent aux lymphocytes T de détecter, avec leur récepteur à l’antigène (récepteur T), des peptides antigéniques présentés par les molécules du complexe majeur d’histocompatibilité (CMH) exprimées à la surface des cellules présentatrices d’antigènes. Les lymphocytes T balayent la surface des cellules présentatrices d’antigènes, formant des interfaces cellulaires très transitoires appelées kinapses (synapses en mouvement), qui peuvent devenir des synapses immunologiques en se stabilisant. La transition de kinapse à synapse dépend de la détection d’un certain seuil d’antigènes à la surface de la cellule présentatrice et de la signalisation du récepteur T qui en résulte. Les kinapses et les synapses immunologiques semblent jouer toutes deux un rôle dans le déclenchement et le maintien de la réponse immune spécifique [
5]. La synapse immunologique est le résultat d’un processus de polarisation cellulaire du lymphocyte T qui conduit à la relocalisation vers la zone de contact intercellulaire du récepteur T, des corécepteurs, de protéines de signalisation intracellulaire et de protéines d’adhérence. Cette structure joue donc un rôle clé dans l’organisation de la machinerie de signalisation précoce du récepteur T. La formation de la synapse et la polarisation du lymphocyte T sont largement régulées par des remaniements du cytosquelette d’actine et des microtubules, mais également par un trafic vésiculaire intracellulaire qui coordonne l’arrivée des récepteurs et des molécules de signalisation vers la synapse, ainsi que leur départ. Une des fonctions clés de la synapse immunologique est le contrôle du signal d’activation transmis par le récepteur T, mis en œuvre par la génération de complexes de signalisation impliquant plusieurs protéines de signalisation intracellulaire [
6]. |
Réorganisation du cytosquelette des lymphocytes T après engagement du récepteur T L’engagement du récepteur T mène à une réorganisation extensive et finement contrôlée du cytosquelette au niveau de la synapse immunologique. Aussi bien le cytosquelette d’actine que le réseau de microtubules [
37] sont réorganisés de manière dynamique et coordonnée, ce qui permet de définir l’architecture et la fonction de la synapse. Ces réarrangements coordonnés du cytosquelette sont régulés par des voies de signalisation en aval du récepteur T et interviennent lors de son engagement par un peptide antigénique, ou in vitro par des anticorps antirécepteurs T. Après l’engagement du récepteur T, le réarrangement du réseau de microtubules [37] provoque la polarisation du centrosome vers la synapse immunologique, ce qui permet le rapprochement des compartiments vésiculaires intracellulaires (appareil de Golgi, endosomes, mitochondries). Ces compartiments vésiculaires sont impliqués dans la formation de la synapse immune (voir plus loin) et l’exécution des fonctions effectrices, comme la sécrétion de cytokines par les lymphocytes T auxiliaires, ou dans la formation des composants des granules lytiques par les lymphocytes T cytotoxiques. Les liens entre les voies de signalisation du récepteur T et la polarisation du réseau des microtubules vers la synapse immune restent encore largement à explorer. Cependant, on connaît l’implication de plusieurs acteurs de la signalisation, comme les kinases Fyn, Lck (lymphocyte-specific protein tyrosine kinase) et ZAP70 (zeta-chain-associated protein kinase 70), les adaptateurs LAT (adaptor linker for activation of T cell) et SLP76 (SH2 domain-containing leukocyte phosphoprotein of 76-kDa), ainsi que d’autres molécules clés telles que Vav1, le diacylglycérol ou la phospholipase Cγ. Le processus de contrôle de la polymérisation et dépolymérisation des microtubules par ces molécules de signalisation est encore méconnu. De même, les points d’ancrage stabilisant les microtubules à la synapse sont mal définis. Des liens physiques entre le récepteur T et EB1 (end binding 1), une protéine de l’extrémité plus des microtubules, ont été néanmoins rapportés. Cette liaison pourrait faciliter les interactions entre les microtubules et la membrane plasmique ; elle pourrait aussi participer au transport du récepteur T vers la synapse [
7,
8]. L’ancrage du réseau de microtubules à la synapse immunologique pourrait enfin mettre en jeu des moteurs moléculaires microtubulaires, comme la dynéine [
9], ou des régulateurs de la polarité cellulaire, comme Dlg1 (discs large homolog 1) [
10]. La régulation de l’organisation du réseau microtubulaire à la synapse immunologique dépend aussi d’effecteurs du cytosquelette d’actine, tels que la GTPase Rac, et de certains facteurs de nucléation de l’actine de la famille des formines, tels que Dia-1, FMNL-1 (formin-like protein 1) et INF-2 (inverted formin-2) [
11,
12]. Par ailleurs, IQGAP1 (Ras GTPase-activating-like protein 1), un effecteur des protéines G Rac1 et Cdc42, permet des interactions entre l’actine corticale et les microtubules, et agit comme un inhibiteur de l’activation des lymphocytes T et de l’organisation d’actine à la synapse immunologique [
13]. Enfin, l’ezrine, une protéine qui relie le cytosquelette d’actine à la membrane plasmique, stabilise le réseau de microtubules à la synapse par le biais de la protéine de polarité Dlg1 [10]. Le réarrangement du cytosquelette d’actine est contrôlé par la cascade de signalisation du récepteur T, impliquant les molécules Nck (non-catalytic region of tyrosine kinase adaptor protein 1), LAT, SLP76 et Vav. Ces molécules contrôlent à leur tour des protéines régulatrices de la dynamique d’actine communes aux autres types cellulaires. Ainsi, les GTPases dynamine-2, Rho, Rac, et Cdc42 agissent sur les régulateurs de la polymérisation de l’actine, tels que WASP (Wiskott-Aldrich syndrome protein), WAVE-2 (WASP family verprolin-homologous protein) et la cofiline, qui assurent sa réorganisation aux sites de signalisation du récepteur T [
14]. Il est à noter que l’organisation conjointe du cytosquelette d’actine et des microtubules à la synapse immunologique, induite par la signalisation du récepteur T, permet à son tour la régulation des voies de signalisation du récepteur T. Il existe donc un mécanisme de rétrocontrôle entre la signalisation du récepteur T et le cytosquelette, qui assure l’architecture de la synapse immune et sa fonction dans l’activation du lymphocyte T [
15]. |
Trafic vésiculaire vers la synapse immunologique : assemblage des voies de signalisation La formation de la synapse immunologique se caractérise par une concentration de récepteurs et de molécules de signalisation du lymphocyte T pour former des complexes moléculaires capables de transmettre le signal d’activation. Cette concentration moléculaire est issue d’un ensemble de mécanismes, encore mal élucidés, qui permettent le transport et la rencontre de ces molécules à la synapse immune. Il a été montré que le transport de molécules vers la synapse immune pouvait avoir lieu par l’intermédiaire d’un mouvement latéral au niveau de la membrane plasmique, dépendant du cytosquelette d’actine [
16], mais aussi par un transport vésiculaire polarisé qui met en jeu plusieurs compartiments endosomaux [
17]. Ainsi, le récepteur T est transporté à la synapse par un processus d’endocytose et de recyclage polarisé, impliquant des endosomes de recyclage et le réseau des microtubules [
18]. De plus, des protéines de signalisation, comme la tyrosine kinase Lck ou l’adaptateur LAT, sont aussi associées à des compartiments vésiculaires exprimant des régulateurs de transport distincts (Figure 1) [17,
19]. Enfin, des protéines régulatrices de la fusion vésiculaire de la famille SNARE (soluble N-ethylmaleimide-sensitive-factor attachment protein receptor), présentes à la membrane plasmique, comme la syntaxine-4 et SNAP-23 (synaptosomal-associated protein-23), ou associées aux endosomes, comme VAMP3 (vesicle-associated membrane protein 3)/cellubrévine, ou VAMP7/Ti-VAMP, sont impliquées dans ces processus [18–
20]. Les SNARE membranaires syntaxine-4 et SNAP-23 se concentrent à la synapse immune et peuvent y faciliter la fusion des compartiments vésiculaires [18].
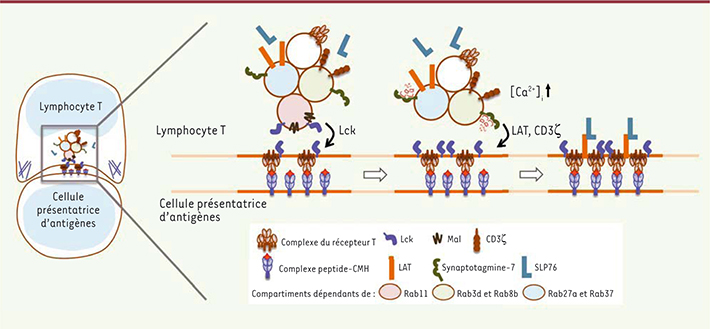
 | Figure 1.
Adressage séquentiel de Lck, LAT et CD3z à la synapse immunologique. Après reconnaissance de l’antigène par le récepteur T, Lck est relargué à la synapse immunologique à partir de vésicules dépendantes de Rab11, provoquant un flux calcique activant la synaptotagmine-7. CD3ζ et LAT sont alors recrutées, permettant l’assemblage d’un complexe de signalisation efficace [ 19]. |
Le transport et la fusion de ces différents compartiments endosomaux à la synapse immune sont différemment contrôlés. En effet, la kinase Lck est localisée au niveau des endosomes de recyclage qui dépendent de la GTPase Rab11. Son transport le long des microtubules vers la synapse immunologique dépendrait de la formine INF2, des protéines de transport Mal et UNC119 (uncoordinated 119 protein), et de l’activité des GTPases Cdc42 et Rac [
21]. Le ciblage de Lck à la membrane est insensible à l’augmentation de calcium intracellulaire. En revanche, l’adressage de LAT et CD3ζ est déclenché par une augmentation de calcium intracellulaire, et est contrôlé par la synaptotagmine-7, une protéine régulatrice de la fusion vésiculaire sensible au calcium. Les compartiments transportant LAT et CD3ζ expriment la protéine SNARE VAMP7/Ti-VAMP, qui interagit avec la synaptotagmine-7 [19, 20]. Notre hypothèse de travail propose que l’engagement du récepteur T par l’antigène provoque un flux calcique qui est dépendant de la concentration de Lck à la synapse, concentration qui nécessite le transport vésiculaire de Lck vers la synapse contrôlé par la protéine MAL. Le calcium conditionnerait à son tour l’adressage de vésicules portant LAT et CD3ζ au niveau de la synapse immunologique (Figure 1) [19]. Le transport de Lck vers la synapse et la fusion de LAT et CD3ζ déterminent l’organisation à l’échelle nanométrique d’agrégats de protéines de signalisation, notamment ceux contenant le complexe d’amplification de la signalisation formé par les adaptateurs LAT et SLP76 phosphorylés (Figure 1) [19]. Le rôle de VAMP7/Ti-VAMP dans l’apport de vésicules à la synapse immunologique reste sujet à discussion ; deux mécanismes ont été proposés. Dans le premier mécanisme, VAMP7/Ti-VAMP contrôlerait l’arrimage et la fusion des vésicules contenant LAT et CD3ζ à la synapse immunologique de façon dépendante du calcium et de la synaptotagmine-7 [19]. Dans le second mécanisme, les vésicules seraient concentrées autour du centrosome, puis recrutées à la synapse immunologique en même temps que le centrosome, auquel elles s’arrimeraient, mais sans fusionner avec la membrane plasmique [20]. Ces deux hypothèses ne sont pas incompatibles et les deux mécanismes pourraient coexister. Ainsi, dans le lymphocyte T, un site de signalisation pourrait se former au niveau de la synapse immunologique impliquant la membrane plasmique et plusieurs compartiments vésiculaires. |
Dynamique moléculaire à la synapse immunologique Le transport polarisé du récepteur T et des protéines de signalisation à la synapse immune facilite la formation de complexes de signalisation. Ceux-ci se forment de préférence à la périphérie de la synapse générant des micro-amas moléculaires contenant le récepteur T et des protéines de signalisation, comme LAT, GADS (Grb2-related adaptor downstream of Shc), SLP76 et Grb2, ainsi que des effecteurs, tels que Vav1, la PLC-γ1 et l’activateur de nucléation d’actine N-WASP [17,
22]. Formés à la périphérie de la synapse immunologique où ces protéines sont phosphorylées, les complexes de signalisation convergent ensuite vers le centre de la synapse, par un mouvement radial centripète, le long des microtubules (Figure 2). Le récepteur T se concentre au centre de la synapse, tandis que ZAP70, LAT et SLP76 sont internalisées avant d’arriver au centre. Ce mouvement centripète dépend de la dynamique de l’actine et de son moteur moléculaire la myosine IIA [
23], ainsi que de l’organisation des microtubules et de leur moteur moléculaire, la dynéine [10,
24].
 | Figure 2.
Dynamique des complexes de signalisation des lymphocytes T à la synapse immunologique. Représentation schématique du mouvement radial centripète des complexes de signalisation le long des microtubules. Les complexes se forment à la périphérie de la synapse et migrent en direction du centre. Le récepteur T atteint le centre de la synapse, alors que d’autres composants sont plus rapidement internalisés [ 10]. |
|
Dynamique moléculaire au départ de la synapse immunologique La migration des complexes de signalisation vers le centre de la synapse est nécessaire à la régulation négative de la signalisation du récepteur T [15, 22]. Ce processus implique le retrait du récepteur T et des différentes molécules de signalisation de la synapse immunologique. Ainsi, le récepteur T disparaît de la synapse par un processus d’internalisation impliquant un mécanisme d’endocytose et de phagocytose [
25,
26]. Les récepteurs internalisés sont adressés vers les endosomes de recyclage pour un retour vers la membrane plasmique, ou pour un adressage vers les lysosomes pour leur dégradation [25]. Si les complexes de signalisation du récepteur T sont internalisés, probablement après avoir atteint le centre de la synapse, ceux contenant les formes phosphorylées de ZAP70, SLP76 ou LAT disparaissent durant le transport vers le centre (Figure 2). Certaines de ces protéines seraient internalisées de façon indépendante de la clathrine, mais dépendante de structures membranaires riches en cholestérol, ainsi que de leur ubiquitination [
27]. Ces protéines internalisées pourraient continuer le processus de signalisation à partir de ces compartiments vésiculaires, puis être acheminées vers des compartiments de dégradation ou des compartiments permettant l’extinction du signal d’activation par l’action de tyrosine phosphatases. Enfin, la signalisation du récepteur T peut s’éteindre suite au désassemblage des complexes de signalisation au niveau de la synapse. Ainsi, la phosphorylation de SLP76 et de GADS par la sérine-thréonine kinase HPK1 (hematopoietic progenitor kinase 1) permet la liaison des protéines régulatrices 14-3-3 et le désassemblage du complexe LAT-GADS-SLP76 [
28,
29]. HPK1 régule ainsi négativement l’activation des lymphocytes T, en diminuant le maintien des complexes de signalisation à la synapse immunologique. |
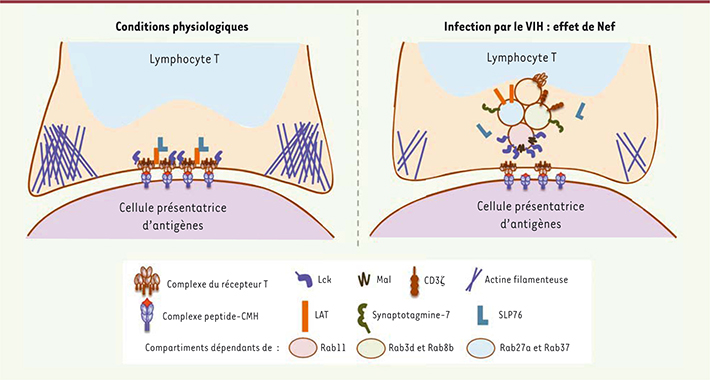
Détournement de la synapse immune par la protéine Nef du VIH-1 Les synapses immunologiques formées par les lymphocytes T infectés par le VIH-1 (virus de l’immunodéficience humaine-1) sont défectueuses et présentent des niveaux de molécules du récepteur T et de la kinase Lck diminués par rapport aux synapses formées par des cellules non infectées [
30]. En effet, le VIH-1, par l’intermédiaire de la protéine auxiliaire Nef (negative regulatory factor), détourne le trafic vésiculaire intracellulaire du récepteur T et de Lck (Figure 3). Nef inhibe également le relargage de l’adaptateur LAT de son compartiment vésiculaire vers la synapse, empêchant ainsi la formation des complexes de signalisation au niveau de la synapse. Les complexes de signalisation contenant LAT et SLP76 phosphorylés ne sont plus retrouvés à la synapse [
31] (Soares et al., données non publiées). Le détournement de la synapse immunologique pourrait également impliquer la capacité de Nef à accélérer l’internalisation et à diminuer l’expression de surface du corécepteur CD4 et de la molécule costimulatrice CD28 dans les lymphocytes T [
32]. Nef interfère enfin avec l’organisation du cytosquelette d’actine, en altérant son réarrangement lors de l’activation du récepteur T, par l’intermédiaire de son interaction avec la kinase PAK2 (p21 activated kinase 2) qui phosphoryle la cofiline, un facteur de dépolymérisation de l’actine [
33]. L’effet de Nef sur le cytosquelette d’actine s’exerce aussi par l’intermédiaire du régulateur de nucléation de l’actine N-WASP, dont la translocation à la périphérie cellulaire est bloquée par Nef [
34].
 | Figure 3.
L’infection par le VIH perturbe la dynamique moléculaire à la synapse immunologique. Lors de l’infection des lymphocytes T par le VIH, ceux ci forment des synapses défectueuses. Lck reste concentrée dans le compartiment de recyclage et son ciblage à la synapse est bloqué. Ainsi, le récepteur T et les molécules de signalisation LAT et SLP76 ne sont plus relocalisées. Enfin, Le VIH perturbe le réarrangement du cytosquelette d’actine [ 30, 31]. |
De manière étonnante, si Nef inhibe la formation de la synapse immunologique et les étapes précoces de signalisation du récepteur T, elle augmente l’état d’activation des lymphocytes T infectés en réponse à l’engagement du récepteur T. L’activation des facteurs de transcription NFAT (nuclear factor of activated T-cell) et NF-ĸB est ainsi augmentée, ce qui a pour effet d’élever la production d’IL-2 (interleukine-2) dans les cellules infectées par le VIH-1 ou exprimant Nef. Cet effet activateur de Nef se traduit par l’induction d’un programme transcriptionnel fortement semblable à celui induit par une activation par un anticorps antirécepteur T [
35]. Les mécanismes impliqués dans ces effets paradoxaux de Nef sont encore mal définis. Ces modulations fines de l’état d’activation des lymphocytes T permettraient la diminution de la réponse antigénique des lymphocytes T infectés, tout en induisant un état d’activation de ces cellules favorable à la réplication virale [
36]. Ainsi, l’infection par le VIH-1 module de façon très ciblée les voies d’activation des lymphocytes T. En ciblant, par le biais principal de la protéine Nef, le cytosquelette et le trafic vésiculaire vers la synapse immune, le VIH-1 découple des évènements clés d’activation du récepteur T à la synapse immunologique, pouvant en même temps augmenter des évènements plus tardifs conduisant à l’expression de certains gènes et à la production des cytokines. |
L’assemblage d’une synapse immunologique capable de transmettre et de contrôler l’activation du lymphocyte T requiert la coordination précise des réarrangements du cytosquelette d’actine et des microtubules avec l’organisation d’un trafic vésiculaire intracellulaire. Lorsqu’elle est assemblée, la synapse immunologique reste une structure très dynamique au sein de laquelle le récepteur T et les protéines de signalisation sont recrutés et se rassemblent, formant des complexes de signalisation qui transitent rapidement vers le centre de la synapse, puis disparaissent. Des mécanismes sophistiqués et diversement régulés coordonnent cette dynamique multimoléculaire. L’ensemble de ces mécanismes font de la synapse immune une plate-forme de signalisation hautement sensible et contrôlée, permettant une large variété de réponses à des antigènes très différents. L’analyse de plus en plus précise de la dynamique moléculaire et de l’organisation spatiale et temporelle des voies de signalisation du récepteur T au sein de la synapse immunologique a permis ces dernières années d’approfondir notre connaissance de ce processus extrêmement complexe. Néanmoins, la compréhension de la hiérarchie et de la coordination de ces divers mécanismes moléculaires reste sommaire. Il est intéressant de mentionner que les mécanismes de détournement des lymphocytes T, développés par le VIH au cours de son évolution, nous ont procuré de nouveaux outils moléculaires pour l’étude de ces cellules. Ces outils nous permettent une meilleure compréhension de la physiologie du lymphocyte T et, en parallèle, ouvre la voie à l’étude des mécanismes pathologiques induits par le VIH dans cellule infectée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les travaux de notre laboratoire que nous décrivons ici ont été financés par l’Institut Pasteur, le CNRS, l’Agence nationale de recherche sur le sida et les hépatites virales (ANRS), l’Agence nationale de recherche (ANR), Sidaction, la Fondation ARC pour la recherche sur le cancer et la Ligue contre le cancer. J. Bouchet est financé par une allocation de recherche postdoctorale de l’ANRS. Nous remercions particulièrement Céline Cuche pour la relecture de cet article.
|
1.
Norcross
MA.
A synaptic basis for T-lymphocyte activation . Ann Immunol.
1984; ; 135D : :113.–134. 2.
Monks
CR
,
Freiberg
BA
,
Kupfer
H
, etal.
Three-dimensional segregation of supramolecular activation clusters in T cells . Nature.
1998; ; 395 : :82.–86. 3.
Grakoui
A
,
Bromley
SK
,
Sumen
C
, etal.
The immunological synapse: A molecular machine controlling T cell activation . Science.
1999; ; 285 : :221.–227. 4.
Trautmann
A
,
Revy
P
,
Donnadieu
E
, etal.
Synapses immunologiques et synapses neuronales . Med Sci (Paris).
2003; ; 19 : :429.–436. 5.
Dustin
ML
. T-cell activation through immunological synapses and kinapses . Immunol Rev.
2008; ; 221 : :77.–89. 6.
Acuto
O
,
Bartolo
V Di
,
Michel
F.
Tailoring T-cell receptor signals by proximal negative feedback mechanisms . Nat Rev Immunol.
2008; ; 8 : :699.–712. 7.
Martin-Cofreces
NB
,
Baixauli
F
,
Lopez
MJ
, etal.
End-binding protein 1 controls signal propagation from the T cell receptor . EMBO J.
2012; ; 31 : :4140.–4152. 8.
Lasserre
R
,
Alcover
A.
Microtubule dynamics and signal transduction at the immunological synapse: new partners and new connections . EMBO J.
2012; ; 31 : :4100.–4102. 9.
Martin-Cofreces
NB
,
Robles-Valero
J
,
Cabrero
JR
, etal.
MTOC translocation modulates IS formation and controls sustained T cell signaling . J Cell Biol.
2008; ; 182 : :951.–962. 10.
Lasserre
R
,
Charrin
S
,
Cuche
C
, etal.
Ezrin tunes T-cell activation by controlling Dlg1 and microtubule positioning at the immunological synapse . EMBO J.
2010; ; 29 : :2301.–2314. 11.
Gomez
TS
Kumar
K
,
Medeiros
RB
, etal.
Formins regulate the actin-related protein 2/3 complexindependent polarization of the centrosome to the immunological synapse . Immunity.
2007; ; 26 : :177.–190. 12.
Andres-Delgado
L
,
Anton
OM
,
Bartolini
F
, etal.
INF2 promotes the formation of detyrosinated microtubules necessary for centrosome reorientation in T cells . J Cell Biol.
2012; ; 198 : :1025.–1037. 13.
Gorman
JA
,
Babich
A
,
Dick
CJ
, etal.
The cytoskeletal adaptor protein IQGAP1 regulates TCRmediated signaling and filamentous actin dynamics . J Immunol.
2012; ; 188 : :6135.–6144. 14.
Burkhardt
JK
,
Carrizosa
E
,
Shaffer
MH.
The actin cytoskeleton in T cell activation . Annu Rev Immunol.
2008; ; 26 : :233.–259. 15.
Lasserre
R
,
Alcover
A.
Cytoskeletal cross-talk in the control of T cell antigen receptor signaling . FEBS Lett.
2010; ; 584 : :4845.–4850. 16.
Wulfing
C
,
Davis
MM.
A receptor/cytoskeletal movement triggered by costimulation during T cell activation . Science.
1998; ; 282 : :2266.–2269. 17.
Soares
H
R
Lasserre
, and
A.
Alcover
, Orchestrating cytoskeleton and intracellular vesicle traffic to build functional immunological synapses . Immunol Rev.
2013; ; 256 : :118.–132. 18.
Das
V
,
Nal
B
,
Dujeancourt
A
, etal.
Activation-induced polarized recycling targets T cell antigen receptors to the immunological synapse; involvement of SNARE complexes . Immunity.
2004; ; 20 : :577.–588. 19.
Soares
H
,
Henriques
R
,
Sachse
M
, etal.
Regulated vesicle fusion generates signaling nanoterritories that control T cell activation at the immunological synapse . J Exp Med.
2013; ; 210 : :2415.–2433. 20.
Larghi
P
,
Williamson
DJ
,
Carpier
J-M
, etal.
VAMP7 controls T cell activation by regulating the recruitment and phosphorylation of vesicular Lat at TCRactivation sites . Nat Immunol.
2013; ; 14 : :723.–731. 21.
Ventimiglia
LN
,
Alonso
MA.
The role of membrane rafts in Lck transport, regulation and signalling in T-cells . Biochem J.
2013; ; 454 : :169.–179. 22.
Yokosuka
T
,
Saito
T.
The immunological synapse, TCR microclusters, and T cell activation . Curr Top Microbiol Immunol.
2010; ; 340 : :81.–107. 23.
Hammer
JA
3rd
,
Burkhardt
JK.
Controversy and consensus regarding myosin II function at the immunological synapse . Curr Opin Immunol.
2013; ; 25 : :300.–306. 24.
Hashimoto-Tane
A
,
Yokosuka
T
,
Sakata-Sogawa
K
, etal.
Dynein-driven transport of T cell receptor microclusters regulates immune synapse formation and T cell activation . Immunity.
2011; ; 34 : :919.–931. 25.
Alcover
A
,
Alarcon
B.
Internalization and intracellular fate of TCR-CD3 complexes . Crit Rev Immunol.
2000; ; 20 : :325.–346. 26.
Martinez-Martin
N
,
Fernandez-Arenas
E
,
Cemerski
S
, etal.
T cell receptor internalization from the immunological synapse is mediated by TC21 and RhoG GTPase-dependent phagocytosis . Immunity.
2011; ; 35 : :208.–222. 27.
Balagopalan
L
Coussens
NP
,
Sherman
E
, etal.
The LAT story: a tale of cooperativity, coordination, and choreography . Cold Spring Harb Perspect Biol.
2010; ; 2 : :a005512.. 28.
Bartolo
V Di
,
Montagne
B
,
Salek
M
, etal.
A novel pathway down-modulating T cell activation involves HPK-1-dependent recruitment of 14–3-3 proteins on SLP-76 . J Exp Med.
2007; ; 204 : :681.–691. 29.
Lasserre
R
,
Cuche
C
,
Blecher-Gonen
R
, etal.
Release of serine/threoninephosphorylated adaptors from signaling microclusters down-regulates T cell activation . J Cell Biol.
2011; ; 195 : :839.–853. 30.
Thoulouze
MI
,
Sol-Foulon
N
,
Blanchet
F
, etal.
Human immunodeficiency virus type-1 infection impairs the formation of the immunological synapse . Immunity.
2006; ; 24 : :547.–261. 31.
Abraham
L
,
Bankhead
P
,
Pan
X
, etal.
HIV-1 Nef limits communication between linker of activated T cells and SLP-76 to reduce formation of SLP- 76-signaling microclusters following TCR stimulation . J Immunol.
2012; ; 189 : :1898.–1910. 32.
Benichou
S
,
Benmerah
A.
Proteines Nef du VIH et K3/K5 du virus associe au sarcoma de Kaposi : des ≪ parasites ≫ de la voie d’endocytose . Med Sci (Paris).
2003; ; 19 : :100.–106. 33.
Stolp
B
,
Reichman-Fried
M
,
Abraham
L
, etal.
HIV-1 Nef interferes with host cell motility by deregulation of Cofilin . Cell Host Microbe.
2009; ; 6 : :174.–186. 34.
Haller
C
Rauch
S
,
Michel
N
, etal.
The HIV-1 pathogenicity factor Nef interferes with maturation of stimulatory T-lymphocyte contacts by modulation of N-Wasp activity . J Biol Chem.
2006; ; 281 : :19618.–19630. 35.
Simmons
A
,
Aluvihare
V
,
McMichael
A.
Nef triggers a transcriptional program in T cells imitating single-signal T cell activation and inducing HIV virulence mediators . Immunity.
2001; ; 14 : :763.–777. 36.
Greenway
AL
,
Holloway
G
,
McPhee
DA
, etal.
HIV-1 Nef control of cell signalling molecules: multiple strategies to promote virus replication . J Biosci.
2003; ; 28 : :323.–335. 37.
Pilon
A
,
Pous
C
, Compartimentation et plasticite du reseau microtubulaire . Med Sci (Paris).
2013; ; 29 : :194.–199. |