| |
| Med Sci (Paris). 2014 June; 30(6-7): 693–698. Published online 2014 July 11. doi: 10.1051/medsci/20143006023.Le rôle des phénomènes aléatoires dans le cancer Jean-Pascal Capp1* 1INSA/Université de Toulouse, LISBP, UMR CNRS 5504, UMR INRA 792, 135, avenue de Rangueil, 31077Toulouse Cedex 4, France |

Dans la théorie du cancer qui prévaut actuellement, les modifications génétiques sont conçues comme les éléments initiateurs. Ce cadre fondamentalement réductionniste postule que ce sont des mutations géniques et/ou des altérations des chromosomes dans une ou quelques cellules d’un tissu qui provoquent un échappement des cellules au contrôle de la prolifération par l’environnement. Une tumeur maligne peut alors apparaître suite à l’accumulation d’altérations génétiques supplémentaires. Le processus est décrit en termes de sélections successives de clones cellulaires de plus en plus agressifs, selon un schéma darwinien au sein duquel l’apparition des modifications génétiques se fait clairement de manière aléatoire. |
L’hétérogénéité des modifications génétiques dans les tumeurs Les multiples séquençages de génomes cancéreux publiés depuis quatre ans ont montré qu’il existe toutefois quelques biais liés aux régions génomiques, certaines étant plus sujettes aux variations, ou à l’exposition à certains agents mutagènes qui génèrent plus spécifiquement certaines modifications génétiques [
1]. Selon les types tumoraux, le nombre et le type de modifications varient grandement, et le panel des modifications observées à un moment précis dépend des conditions sélectives qui ont prévalu au cours du développement de la tumeur. C’est notamment le cas des gènes dits « significativement mutés ». Ils sont appelés ainsi car leur mutation a joué un rôle moteur dans le développement de la maladie (d’où le terme mutation driver), et pour les distinguer des gènes dont les mutations n’ont pas de conséquence en termes d’avantage de croissance (mutation passenger) [
2,
31] (→). Au sein de cet ensemble d’études de génomique, plusieurs observations sont à souligner :
-
un nombre élevé de mutations est généralement observé (de quelques centaines à quelques dizaines de milliers de mutations) [
3], mais celles qui affectent la séquence des protéines sont beaucoup moins nombreuses [
4] ;
-
ces études révèlent une forte hétérogénéité intertumorale : par exemple, parmi 100 tumeurs du sein, des mutations driver affectant au moins 40 gènes ont été observées, avec un total de 73 combinaisons différentes de gènes mutés [
5]. De plus, cette hétérogénéité ne permet pas de révéler d’événement initial commun. Dans le cas des cancers du sein triple-négatifs1, même si certaines mutations semblent être précoces, aucune mutation ne peut être définie comme l’événement initial, au moins dans certains cas. Cela « pose la question de ce qui conduit à l’expansion clonale précoce » [
6] ;
-
ces études sont réalisées sur des populations cellulaires et, de ce fait, une grande part de la diversité génétique n’est probablement pas détectée. En effet, ce n’est que l’analyse des génomes de cellules individuelles qui permet de révéler l’ampleur de l’hétérogénéité génétique intratumorale. Diverses études de séquençage du génome de cellules cancéreuses individuelles dans des cas de carcinomes [
7] comme de leucémies [
8], ont montré qu’il existe des sous-populations distinctes avec des profils génétiques complexes, sans sous-population intermédiaire, ni événement génétique initial ;
-
enfin ces études de cellules individuelles ne permettent parfois même pas de caractériser de sous-population particulière, ni de mutation clonale [
9]. Cette hétérogénéité génétique à l’échelle de la cellule individuelle questionne l’origine génétique du processus.
(→) Voir l’article de E. Solary, page 683 de ce numéro
|
Modifications épigénétiques et variabilité phénotypique D’autres phénomènes aléatoires retiennent l’attention, en particulier les modifications épigénétiques de la chromatine. Celles-ci ont un rôle majeur dans la diversification phénotypique des cellules cancéreuses et représentent pour certains une alternative à une théorie seulement génétique de l’initiation du cancer. En effet, le processus pourrait débuter par des altérations épigénétiques, notamment d’origine environnementale [
10]. Toutefois, les modèles actuels admettent plus généralement leur rôle dans la progression tumorale, et le cadre réductionniste reste ici prédominant. Le « paysage » épigénétique, ou épigénome, est stable et reproductible dans les cellules différenciées normales, mais aberrant dans les cancers : les profils de méthylation de l’ADN ou de modifications des histones y sont fortement altérés [
11,
12]. Ces altérations apparaissent de manière aléatoire et les changements de méthylation de l’ADN lors de la transformation cellulaire « ne sont pas le résultat d’une reprogrammation orchestrée de l’épigénome, mais plutôt un processus passif » [
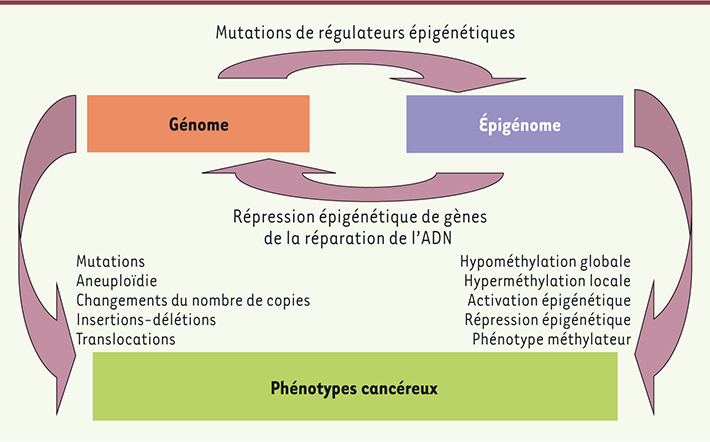
13]. Certaines altérations sont ensuite sélectionnées lors de la progression tumorale, comme certaines modifications génétiques le sont. Elles contribuent à l’apparition des phénotypes cancéreux [12] et sont souvent liées à des mutations de gènes codant pour des régulateurs épigénétiques [11]. Inversement, des modifications épigénétiques affectant des gènes impliqués dans la stabilité génétique sont observées, créant une interconnexion de ces deux types d’événements aléatoires dans le cancer (Figure 1).
 | Figure 1.
Les événements génétiques et épigénétiques aléatoires contribuent à l’apparition des phénotypes cancéreux. De plus, ils s’influencent réciproquement au travers de modifications génétiques de gènes codant pour des modificateurs de la chromatine, ou de modifications épigénétiques de promoteurs de gènes de la stabilité génétique (adapté de Shen et Laird [ 12]). |
|
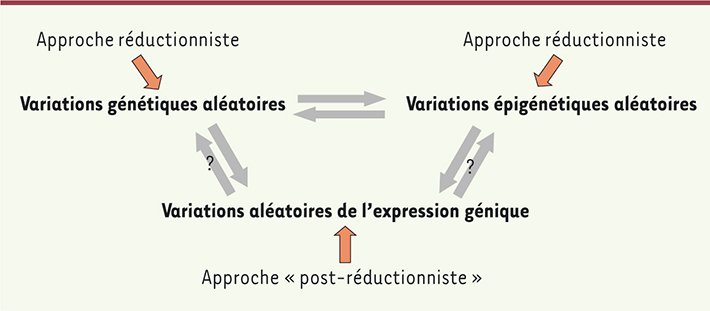
Les variations aléatoires de l’expression génique Enfin, les variations aléatoires de l’expression des gènes entre cellules constituent une troisième catégorie d’évènements aléatoires qui peuvent être considérés comme ayant un rôle causal. La stochasticité intrinsèque du processus d’expression génique crée des variations des niveaux d’expression entre cellules, qui ont d’abord été finement et quantitativement caractérisées au sein de populations de microorganismes. Mais elles caractérisent aussi les cellules des organismes pluricellulaires, en particulier les cellules souches, qui présentent une expression généralisée et très variable de leur génome [
14]. Des études ont montré la relation entre la structure de la chromatine et le niveau de variabilité d’expression des gènes [
15]. Dans le cas du cancer, les variations épigénétiques ont donc très certainement un impact sur ce phénomène (Figure 2). C’est également vrai pour des variations génétiques qui affectent ces variations aléatoires de l’expression des gènes [
16]. Même si ce phénomène n’a pas (encore) été caractérisé dans le cancer, un lien existe entre variabilité génétique et variabilité d’expression (Figure 2).
 | Figure 2.
Les trois types d’événements aléatoires étudiés ici sont interconnectés. Seul l’impact des variations aléatoires de l’expression génique sur les variations génétiques et épigénétiques restent à démontrer. Dans le cas du cancer, les différentes entrées dans ce cercle correspondent à des approches différentes. Alors que les théories génétiques et épigénétiques du cancer relèvent d’un schéma réductionniste, donner aux variations aléatoires de l’expression génique un rôle causal permet de dépasser les schémas réductionnistes. En effet, de fortes variations d’expression pourraient trouver leur origine dans le fait que les cellules ne seraient pas ou plus en mesure de stabiliser leur expression génique par la mise en place d’interactions cellulaires (si celles-ci sont perturbées par des agents chimiques par exemple). Ainsi l’interconnexion des niveaux génique et tissulaire est considérée comme primordiale et aucun niveau d’organisation n’est privilégié. |
Mais quel est le rôle des variations aléatoires de l’expression génique dans le cancer ? Certaines études lui attribuent un rôle dans la diversification fonctionnelle de cellules cancéreuses qui ont acquis des phénotypes très différents malgré un génome stable [
17]. D’autres supposent qu’elles sont impliquées dans les transitions stochastiques entre sous-populations différentes de cellules cancéreuses [
18]. Quoiqu’il en soit, il faut considérer cette source de variabilité phénotypique au même titre que les aspects génétiques et épigénétiques. Mais comment l’intégrer dans l’évolution de la tumeur ? Une première possibilité serait de la considérer uniquement dans le processus de progression tumorale, car elle diversifie les phénotypes au même titre que les altérations épigénétiques. Toutefois, il est aussi possible qu’elle intervienne dans les étapes très précoces, voire initiales. En effet, cette variabilité d’expression est particulièrement marquée dans les cellules souches, or des cellules possédant des propriétés de cellules souches sont de plus en plus incriminées dans les étapes précoces. Un nouveau schéma peut donc émerger. L’hypothèse des cellules souches cancéreuses, ou plus exactement des cellules cancéreuses possédant des propriétés de cellules souches, a permis à la fois de mieux expliquer l’origine de l’hétérogénéité fonctionnelle et cellulaire des cancers (à partir de cellules peu différenciées, des phénotypes plus divers peuvent être générés) et de mieux comprendre les phénomènes de résistance aux traitements (ces cellules souches cancéreuses prolifèrent peu et sont donc peu sensibles aux nombreux traitements visant les cellules proliférantes). Certains ont donc parlé de changement de paradigme, mais ce n’est pas le cas. Le schéma qui se développe actuellement n’est qu’une nouvelle variante de la théorie génétique, car il est seulement stipulé que des mutations de gènes de l’autorenouvellement et d’autres gènes spécifiques aux cellules souches doivent apparaître en plus de celles des oncogènes et gènes suppresseurs de tumeurs classiques [
19]. Toutefois : la fréquence des cellules souches cancéreuses dans une tumeur dépend du système expérimental utilisé pour les isoler [
20], ce qui met l’accent sur le rôle important de l’environnement où les cellules prolifèrent ; les marqueurs des cellules souches cancéreuses sont instables : un des marqueurs moléculaires qui les caractérisent peut apparaître fréquemment au sein d’une population de cellules cancéreuses, ce qui indique que l’état de cellules souches cancéreuses peut être acquis par n’importe quelle cellule à n’importe quel moment [
21]. Ces données nous permettent de renouveler notre vision de l’origine et du rôle des cellules souches cancéreuses. Il faut d’abord relever que si les cellules souches embryonnaires expriment leur génome de manière très aléatoire et généralisée in vitro [14] comme in vivo [
22], la structuration tissulaire est au contraire marquée par une diminution de la stochasticité de l’expression des gènes [
23,
24]. La pluripotence des cellules souches serait le fruit d’un état d’instabilité intrinsèque de l’expression des gènes, responsable lui-même du grand nombre de voies développementales possibles pour ces cellules. Cette instabilité serait donc une propriété statistique des populations de cellules souches, mais ne pourrait pas être définie au niveau individuel du fait de la variabilité intrinsèque de ces cellules [
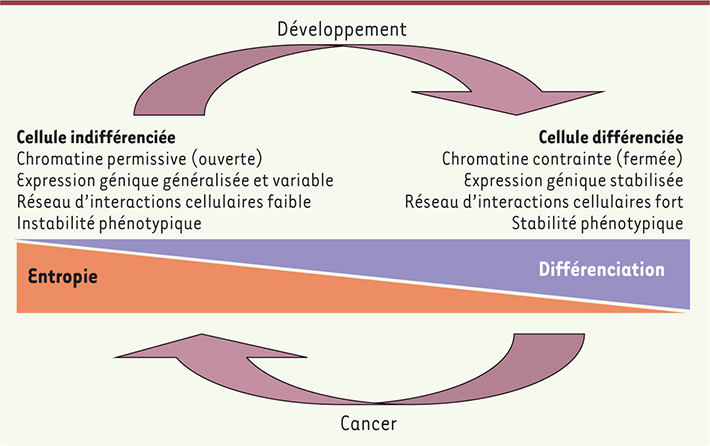
25]. Au contraire, la différenciation cellulaire représenterait le passage d’un état permissif de la chromatine permettant cette expression généralisée et variable à un état contraint (fermé), qui limite la variabilité d’expression dans le cadre d’une « régulation » spatiotemporelle de cette variabilité au cours du développement (Figure 3). Ce schéma est en accord avec la théorie de l’ontophylogenèse développée par Jean-Jacques Kupiec [
26,
32] (→) : selon celle-ci, la stochasticité de l’expression des gènes au sein des cellules indifférenciées permet un processus sélectif au niveau cellulaire aboutissant à la stabilisation de l’expression d’un panel de gènes adaptés à un environnement donné grâce aux interactions établies par la cellule avec cet environnement. Ce processus en deux phases, en particulier le rôle de la signalisation cellulaire issue des interactions cellulaires dans la phase de stabilisation de l’expression génique au cours du développement, a été confirmé expérimentalement [23].
(→) Voir l’article de J.J. Kupiec, page 699 de ce numéro
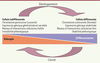 | Figure 3.
Les cellules indifférenciées présentent des caractères phénotypiques instables en raison de l’expression généralisée et variable de leur génome. Celle-ci est due à une chromatine permissive, elle-même liée au faible réseau d’interactions cellulaires autour de ces cellules qui ne permet pas les signalisations nécessaires à la stabilisation de l’expression. Au cours du développement et de la différenciation, la mise en place d’interactions cellulaires stabilise l’expression des gènes et ainsi les phénotypes cellulaires. La chromatine devient plus contrainte et fermée. Si les interactions cellulaires sont perturbées, les cellules redeviennent instables aux niveaux de l’expression génique et phénotypique, ce qui correspond à une dédifférenciation. Ces cellules risquent alors de se transformer en cellules cancéreuses si elles contiennent déjà, ou en acquérant, des altérations génétiques et/ou épigénétiques. Ce phénomène est aussi possible si des cellules souches restent indifférenciées parce qu’elles ne peuvent pas établir les interactions cellulaires nécessaires à leur différenciation (adapté de MacArthur et Lemischka [ 25] et de Capp [
28]). |
|
Perturbation des interactions cellulaires avec l’environnement et dérèglement de l’expression génique Si l’expression génique est stabilisée par les interactions cellulaires au sein des tissus normaux, l’inverse est-il possible dans le cancer ? Il semble bien que l’état cancéreux corresponde à un retour à un état permissif de la chromatine et à « une perte de l’information développementale » au niveau de la chromatine [
27] (Figure 3). L’acquisition de l’état fermé de la chromatine au cours de la différenciation étant liée à la mise en place des interactions cellulaires, la perturbation de ces interactions pourrait, en interrompant les voies de signalisation qui stabilisent l’expression des gènes, restaurer un état permissif de la chromatine et un niveau de variabilité d’expression plus élevé. Cela correspondrait à une dédifférenciation des cellules. Dans ce cas, la différenciation et la quiescence des cellules différenciées ne seraient plus maintenues, en conséquence de la nature stochastique de l’expression génique qui ne serait alors plus correctement « contrôlée » par le microenvironnement cellulaire2. Ces cellules pourraient ensuite dégénérer et se transformer en cellules souches cancéreuses si certaines altérations génétiques ou épigénétiques apparaissaient, ou étaient déjà présentes dans les cellules [
33] (→).
(→) Voir l’article de C. Sonnenschein et A.M. Soto, page 688 de ce numéro
Un schéma similaire peut être décrit à partir de cellules souches normales : si celles-ci ne peuvent pas, lorsqu’elles quittent leur niche, établir les interactions cellulaires nécessaires à leur canalisation vers un état différencié et à la stabilisation de leur expression génique, elles sont maintenues dans cet état indifférencié qui est susceptible de produire des cellules souches cancéreuses. Le cancer peut donc être considéré comme une maladie du développement et de la différenciation [28], et toute molécule capable d’altérer les membranes cellulaires, jonctions cellulaires, molécules d’adhésion, ou encore les molécules solubles comme les hormones ou les facteurs de croissance (qui diffusent entre les cellules et constituent un mode d’interactions à distance), pourrait être capable d’enclencher un processus de cancérogenèse. Cette théorie rejoint certaines des hypothèses d’Ana M. Soto et Carlos Sonnenschein [33] (→).
(→) Voir page 688 de ce numéro
La variabilité génétique et épigénétique des cellules cancéreuses pourrait d’ailleurs trouver son origine dans l’expression plus variable des gènes impliqués dans les voies qui maintiennent la stabilité du génome ou de l’épigénome [28], complétant ainsi les interconnexions entre les trois sources de variabilité biologique évoquées dans cet article (Figure 2). En effet, l’apparition aléatoire de mutations ponctuelles ou d’altérations chromosomiques pourrait se produire en réponse aux perturbations des voies de maintien de l’intégrité du génome que provoquerait l’expression fortement aléatoire des gènes impliqués dans ces voies. Mais il s’agirait surtout d’un phénomène inéluctable lorsque l’expression génique est fortement instable. La sélection d’altérations génétiques et épigénétiques aurait ensuite lieu en fonction de la pression sélective. |
Une perspective réconciliatrice : interactions entre les niveaux génétique et tissulaire Ainsi, il ne s’agit pas de nier le rôle des altérations génétiques et épigénétiques dans le cancer. Quand les conditions microenvironnementales le permettent, elles semblent primordiales (et inévitables) dans la progression tumorale. Mais il s’agit de renverser la perspective : la rupture de l’équilibre tissulaire serait l’événement initiateur et les altérations génétiques et épigénétiques seraient les éléments promoteurs et accélérateurs. Ainsi dans le cas des agents mutagènes et des prédispositions génétiques au cancer, l’initiation serait bien liée à un échec du contrôle microenvironnemental, mais la probabilité que les cellules précancéreuses soient plus agressives plus rapidement serait augmentée par des agents mutagènes ou de telles prédispositions au cancer. La probabilité qu’une tumeur se forme serait ainsi aussi augmentée, mais seulement si l’environnement correct du tissu n’est pas maintenu. De nombreux phénomènes observés dans les cancers peuvent être expliqués par cette théorie [
29], mais celle-ci aboutit surtout à une nouvelle manière d’envisager la thérapie par la différenciation. Elle pourrait consister à restabiliser l’expression génique dans les cellules cancéreuses en les faisant d’abord réexprimer les gènes nécessaires aux interactions cellulaires, puis en mimant le microenvironnement normal du tissu d’origine par l’introduction de molécules capables d’interagir avec ces cellules qui ont retrouvé la possibilité d’interagir normalement avec leur environnement, et donc d’être stabilisées [
30]. Pour conclure, l’accent mis sur la variabilité d’expression des gènes, au sein d’un cercle articulant les trois classes de phénomènes aléatoires (Figure 2), peut permettre de sortir du schéma réductionniste qui veut qu’on n’entre dans ce cercle que par les voies génétiques ou épigénétiques. En effet, la théorie décrite ici considère les interactions entre les niveaux génétique et tissulaire aux différents stades de la cancérogenèse en mettant en avant le rôle majeur de l’expression stochastique des gènes. Il s’agit donc d’une alternative aux théories réductionnistes, mais aussi holistes, grâce à la réconciliation des influences génétiques, épigénétiques et tissulaires dans le cancer. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
Autres articles de ce numéro relatifs au colloque
-
Zielinska A, Issad T. La recherche sur le cancer : un champ privilégié pour penser les rapports entre hasard, réductionnisme et holisme. Med Sci (Paris) 2014 ; 30 : 675–8.
-
Morange M. Les modèles explicatifs du cancer : aspects historiques. Med Sci (Paris) 2014 ; 30 : 679–82.
-
Solary E. Une approche réductionniste du cancer. Med Sci (Paris) 2014 ; 30 : 683–7.
-
Sonnenschein C, Soto AM. Le cancer et ses gènes insaisissables. Med Sci (Paris) 2014 ; 30 : 688–92.
-
Kupiec JJ. Comment le hasard intervient-il dans le débat entre holisme et réductionnisme ? Med Sci (Paris) 2014 ; 30 : 699–700.
|
POUR EN SAVOIR PLUS (sélection d’articles de m/s)
-
Microenvironnements tumoraux : conflictuels et complémentaires. Med Sci (Paris) 2014 ; 30 : 343–466.
-
Fridman WH, Sautès-Fridman C. Le microenvironnement tumoral. Med Sci (Paris) 2014 ; 30 : 359–65.
-
Provot S. Contrôle de la croissance et de la dissémination tumorales par le microenvironnement. Med Sci (Paris) 2014 ; 30 : 366–71.
-
Jordan B. Chroniques génomiques. The sound of silence. Med Sci (Paris) 2012 ; 28 : 435–7.
-
Billaud M. L’hétérogénéité intratumorale. Med Sci (Paris) 2012 ; 28 : 1116–9.
-
Ginestier C, Korkaya H, Dontu G. La cellule souche cancéreuse : un pilote aux commandes du cancer du sein. Med Sci (Paris) 2007 ; 23 : 1133–40.
-
Laget S, Defossez PA. Le double jeu de l’épigénétique. Med Sci (Paris) 2008 ; 24 : 725–730.
|
1.
Kandoth
C
,
McLellan
MD
,
Vandin
F
, et al.
Mutational landscape and significance across 12 major cancer types . Nature.
2013; ; 502 : :333.–339. 2.
Watson
IR
,
Takahashi
K
,
Futreal
PA
,
Chin
L
. Emerging patterns of somatic mutations in cancer . Nat Rev Genet.
2013; ; 14 : :703.–718. 3.
Alexandrov
LB
,
Nik-Zainal
S
,
Wedge
DC
, et al.
Signatures of mutational processes in human cancer . Nature.
2013; ; 500 : :415.–421. 4.
Vogelstein
B
,
Papadopoulos
N
,
Velculescu
VE
, et al.
Cancer genome landscapes . Science.
2013; ; 339 : :1546.–1558. 5.
Stephens
PJ
,
Tarpey
PS
,
Davies
H
, et al.
The landscape of cancer genes and mutational processes in breast cancer . Nature.
2012; ; 486 : :400.–404. 6.
Shah
SP
,
Roth
A
,
Goya
R
, et al.
The clonal and mutational evolution spectrum of primary triple-negative breast cancers . Nature.
2012; ; 486 : :395.–399. 7.
Navin
N
,
Kendall
J
,
Troge
J
, et al.
Tumour evolution inferred by single-cell sequencing . Nature.
2011; ; 472 : :90.–94. 8.
Anderson
K
,
Lutz
C
,
van Delft
FW
, et al.
Genetic variegation of clonal architecture and propagating cells in leukaemia . Nature.
2010; ; 469 : :356.–361. 9.
Xu
X
,
Hou
Y
,
Yin
X
, et al.
Single-cell exome sequencing reveals single-nucleotide mutation characteristics of a kidney tumor . Cell.
2012; ; 148 : :886.–895. 10.
Feinberg
AP
,
Ohlsson
R
,
Henikoff
S
. The epigenetic progenitor origin of human cancer . Nat Rev Genet.
2006; ; 7 : :21.–33. 11.
Plass
C
,
Pfister
SM
,
Lindroth
AM
, et al.
Mutations in regulators of the epigenome and their connections to global chromatin patterns in cancer . Nat Rev Genet.
2013; ; 14 : :765.–780. 12.
Shen
H
,
Laird
PW
. Interplay between the cancer genome and epigenome . Cell.
2013; ; 153 : :38.–55. 13.
Landan
G
,
Cohen
NM
,
Mukamel
Z
, et al.
Epigenetic polymorphism and the stochastic formation of differentially methylated regions in normal and cancerous tissues . Nat Genet.
2012; ; 44 : :1207.–1214. 14.
Efroni
S
,
Duttagupta
R
,
Cheng
J
, et al.
Global transcription in pluripotent embryonic stem cells . Cell Stem Cell.
2008; ; 2 : :437.–447. 15.
Brown
CR
,
Mao
C
,
Falkovskaia
E
, et al.
Linking stochastic fluctuations in chromatin structure, gene expression . PLoS Biol.
2013; ; 11 : :e1001621.. 16.
Sanchez
A
,
Golding
I
. Genetic determinants and cellular constraints in noisy gene expression . Science.
2013; ; 342 : :1188.–1193. 17.
Kreso
A
,
O’Brien
CA
,
van Galen
P
, et al.
Variable clonal repopulation dynamics influence chemotherapy response in colorectal cancer . Science.
2012; ; 339 : :543.–548. 18.
Gupta
PB
,
Fillmore
CM
,
Jiang
G
, et al.
Stochastic state transitions give rise to phenotypic equilibrium in populations of cancer cells . Cell.
2011; ; 146 : :633.–644. 19.
Rosen
JM
,
Jordan
CT
. The increasing complexity of the cancer stem cell paradigm . Science.
2009; ; 324 : :1670.–1673. 20.
Quintana
E
,
Shackleton
M
,
Sabel
MS
, et al.
Efficient tumour formation by single human melanoma cells . Nature.
2008; ; 456 : :593.–598. 21.
Roesch
A
,
Fukunaga-Kalabis
M
,
Schmidt
EC
, et al.
A temporarily distinct subpopulation of slow-cycling melanoma cells is required for continuous tumor growth . Cell.
2010; ; 141 : :583.–594. 22.
Little
SC
,
Tikhonov
M
,
Gregor
T
. Precise developmental gene expression arises from globally stochastic transcriptional activity . Cell.
2013; ; 154 : :789.–800. 23.
Ohnishi
Y
,
Huber
W
,
Tsumura
A
, et al.
Cell-to-cell expression variability followed by signal reinforcement progressively segregates early mouse lineages . Nat Cell Biol.
2014; ; 16 : :27.–37. 24.
Featherstone
K
,
Harper
CV
,
McNamara
A
, et al.
Pulsatile patterns of pituitary hormone gene expression change during development . J Cell Sci.
2011; ; 124 : :3484.–3491. 25.
MacArthur
BD
,
Lemischka
IR
. Statistical mechanics of pluripotency . Cell.
2013; ; 154 : :484.–489. 26.
Kupiec
JJ
. L’origine des individus . Paris: : Fayard; , 2008 : :315. p. 27.
Stergachis
AB
,
Neph
S
,
Reynolds
A
, et al.
Developmental fate and cellular maturity encoded in human regulatory DNA landscapes . Cell.
2013; ; 154 : :888.–903. 28.
Capp
JP
. Stochastic gene expression, disruption of tissue averaging effects and cancer as a disease of development . Bioessays.
2005; ; 27 : :1277.–1285. 29.
Capp
JP
. Nouveau regard sur le cancer. Pour une révolution des traitements . Paris: : Belin; , 2012 : :256. p. 30.
Capp
JP
. Stochastic gene expression stabilization as a new therapeutic strategy for cancer . Bioessays.
2012; ; 34 : :170.–173. 31.
Solary
E
. Une approche réductionniste du cancer . Med Sci (Paris).
2014; ; 30 : :683.–687. 32.
Kupiec
JJ
. Comment le hasard intervient-il dans le débat entre holisme et réductionnisme ? Conclusion du dossier Cancer/Haredhol . Med Sci (Paris).
2014; ; 30 : :699.–700. 33.
Sonnenschein
C
,
Soto
AM
. Le cancer et ses gènes insaisissables . Med Sci (Paris).
2014; ; 30 : :688.–692. |