| |
| Med Sci (Paris). 2014 August; 30(8-9): 721–724. Published online 2014 September 1. doi: 10.1051/medsci/20143008002.Lymphocytes B régulateurs : état des connaissances Jean-David Bouaziz,1,2,3* Adèle de Masson,1,2,3 Hélène Le Buanec,1,2 Martine Bagot,1,2,3 and Armand Bensussan1,2 1Inserm U976, F-75475, Paris, France 2Université Paris Diderot, Sorbonne Paris Cité, laboratoire d’immunologie, dermatologie et oncologie, UMR-S 976, F-75475, Paris, France 3service de dermatologie, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France MeSH keywords: Animaux, Lymphocytes B régulateurs, immunologie, Humains, Souris |
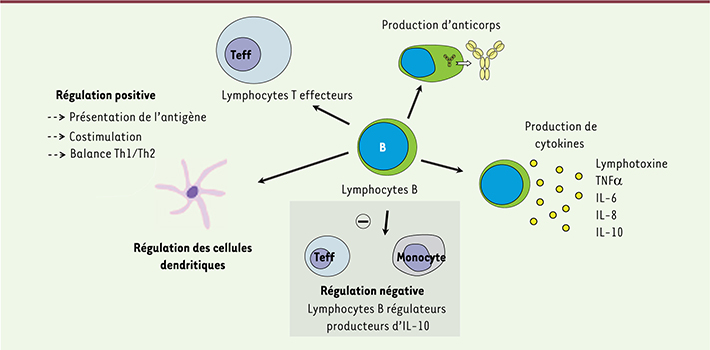
Les lymphocytes B sont considérés comme des acteurs effecteurs de la réponse immunitaire : ils donnent naissance, au cours de leur différenciation terminale, aux plasmocytes qui produisent les anticorps ; ils produisent des cytokines, présentent l’antigène aux lymphocytes T effecteurs pour les activer, et régulent la fonction des cellules dendritiques [
1] (Figure 1). La tolérance immunologique définit la capacité du système immunitaire à ne pas développer de réaction immunitaire forte vis-à-vis de certains antigènes et à réguler négativement les réponses immunitaires, afin, par exemple en cas d’infection, d’éteindre la réaction inflammatoire une fois le pathogène neutralisé. Plusieurs populations de lymphocytes T contribuent au maintien de la tolérance immunitaire, parmi lesquelles les lymphocytes T régulateurs naturels (nTreg) CD4+CD25+FoxP3+ et les lymphocytes T régulateurs de type 1 (Tr1) qui produisent de l’interleukine 10 (IL-10), une cytokine anti-inflammatoire [
2]. Parallèlement, de nombreux travaux chez la souris ont montré que les lymphocytes B pouvaient avoir des fonctions régulatrices, celles-ci étant pour l’instant essentiellement attribuées à la capacité de ces lymphocytes B à produire de l’IL-10 [
3]. Bien que la capacité des lymphocytes B humains à produire de l’IL-10 soit connue depuis longtemps [
4], l’existence de lymphocytes B régulateurs (Breg) humains n’a été démontrée que récemment, et leur ontogénie et leurs mécanismes d’action chez l’homme sont encore très mal compris.
 | Figure 1.
Rôles effecteur et régulateur des lymphocytes B. Teff : lymphocyte T effecteur. |
|
Historique de la découverte des lymphocytes B régulateurs chez la souris La description historique des Breg remonte à 1974. Dans un modèle murin d’eczéma de contact, le transfert adoptif de splénocytes totaux avait un effet suppresseur, alors que le transfert adoptif de splénocytes dont on avait retiré les lymphocytes B n’avait pas d’effet [
5]. En 1996, le rôle régulateur des lymphocytes B fut montré dans un modèle murin d’encéphalomyélite auto-immune expérimentale (EAE) [
6], puis, en 2002, ce rôle régulateur fut attribué à la capacité des lymphocytes B à produire de l’IL-10 [
7]. Bien que divers phénotypes aient été attribués à ces Breg murins producteurs d’IL-10 (appelés B10), plusieurs travaux ont montré que la majorité étaient de phénotype CD5+CD1dfort, et qu’ils exerçaient des fonctions suppressives importantes dans des modèles d’eczéma de contact [
8], d’EAE [
9], et de lupus [
10]. Le mécanisme exact selon lequel les Breg agissent in vivo chez la souris demeure incertain. Dans la plupart des travaux, il semblerait que les Breg aient une action spécifique d’antigène, que cette action nécessite un contact étroit entre le lymphocyte B et le lymphocyte T notamment par la voie du couple CD40-CD40L, et que cette interaction puisse inhiber la polarisation T CD4 de type Th1 [
11]. Une autre hypothèse est que les Breg murins puissent induire des lymphocytes T régulateurs [
12]. Les deux découvertes scientifiques les plus récentes concernant les Breg murins sont : (1) la découverte du rôle clé de l’interleukine 21 dans l’expansion des Breg producteurs d’IL-10 in vitro [
13], (2) le rôle régulateur des plasmocytes in vivo via l’IL-10 et l’interleukine 35 (IL-35) (première description des plasma Reg ou P-Reg) [
14]. La culture in vitro de lymphocytes B murins pendant neuf jours en présence de BAFF (B-cell activating factor of the TNF family), de CD40L combiné à de l’IL-4 pendant quatre jours puis à de l’IL-21 pendant cinq jours, permettait d’amplifier 4 millions de fois le nombre de Breg producteurs d’IL-10, et leur transfert adoptif permettait de guérir l’EAE [13]. L’IL-21 étant une cytokine majeure pour la différenciation des lymphocytes B en plasmocytes, il est légitime de se demander si cette population de Breg produite in vitro ne représente pas une population plus mature de plasmablastes ou plasmocytes. In vivo, dans un modèle d’infection bactérienne à Salmonella typhimurium, la source principale d’IL-10 parmi les cellules de la lignée lymphocytaire B était le plasmocyte, qui est le stade le plus différencié de lymphocyte B et qui produit les anticorps plasmatiques [14]. En particulier, dans ce modèle, les plasmocytes CD138fortCD22- étaient une source majeure d’IL-10 et exprimaient les transcrits IRF4 (interferon regulatory factor 4) et BLIMP-1 (B lymphocyte-induced maturation protein-1) qui régulent la production d’IL-10 par les lymphocytes T [
15]. Les auteurs de ce travail montraient également que les plasmocytes produisaient de l’interleukine 35 et que, in vivo, l’IL-10 comme l’IL-35 étaient des cytokines importantes pour maintenir la tolérance dans le modèle murin d’EAE. |
Historique des lymphocytes B régulateurs chez l’homme La première étape était d’identifier les conditions de culture cellulaire permettant de déclencher la production d’IL-10 par les lymphocytes B. Jusqu’à présent, les stimulus utilisés in vitro pour induire la production d’IL-10 par les lymphocytes B humains passaient par la stimulation du récepteur B pour l’antigène (BCR, B cell receptor) - stimulation mimée in vitro par un anticorps anti-immunoglobuline -, l’activation du CD40 exprimé à la surface du lymphocyte B - mimée par un anticorps monoclonal anti-CD40, par le CD40 ligand recombinant trimérique, ou par des cellules transfectées par le CD40 ligand -, ou la stimulation des toll-like receptors (TLR) exprimés par le lymphocyte B (TLR1, 2, 5, 6, 7, 9) - mimée par des agonistes des TLR. La plupart des équipes travaillant sur le sujet ont montré qu’une double stimulation via des agonistes de CD40 et des agonistes de TLR9 (CpG-B) était la plus appropriée pour induire au cours d’une culture cellulaire de courte durée (24 à 72 h) une production optimale d’IL-10 par les lymphocytes B [
16]. La deuxième étape consistait à déterminer si ces lymphocytes B producteurs d’IL-10 générés in vitro avaient un phénotype particulier. Les lymphocytes B expriment les marqueurs CD19 et CD20 (ce dernier étant partiellement perdu au stade de différenciation plasmocytaire), et les sous-populations de lymphocytes B sont identifiables en cytométrie de flux en fonction de la coexpression de marqueurs de surface tels que CD24, CD38 et CD27. Trois sous-populations principales de lymphocytes B conventionnels sont classiquement décrites chez l’homme : les lymphocytes B immatures transitionnels (CD19+CD20+CD24fortCD38fort), les lymphocytes B matures naïfs (CD19+CD20+CD24intCD38int), qui n’ont pas encore subi de maturation dans le centre germinatif du ganglion lymphatique, et les lymphocytes B mémoires (CD19+CD20+CD27+) qui ont subi une maturation dans le centre germinatif. L’expression du CD5 par les lymphocytes B humains correspond à un état d’activation, mais ne permet pas de définir une population particulière dans l’ontogénie B, à la différence du CD5 murin, qui définit une population de lymphocytes B non conventionnels dits B1. Deux équipes ont identifié en 2010 un phénotype particulier des Breg producteurs d’IL-10 : (1) celle de Claudia Mauri au Royaume-Uni les a définis comme CD19+CD24fortCD38fort (lymphocytes B immatures transitionnels) [
17], (2) l’équipe de Thomas F. Tedder aux États-Unis les a définis comme CD27+CD24fort [
18]. Notre groupe, à Paris, la même année, ne définissait pas de phénotype précis des Breg humains producteurs d’IL-10, mais montrait simplement que ces derniers étaient enrichis dans les populations CD24fort et CD27+ [
19]. Le groupe de Christophe Jamin à Brest montrait que tout lymphocyte B stimulé de façon adéquate pouvait produire de l’IL-10, et, qu’après activation, ces lymphocytes B producteurs d’IL-10 avaient un phénotype IgD+CD38fortCD24fortCD5fort [
20]. La troisième étape consistait à déterminer si ces lymphocytes B producteurs d’IL-10 avaient des fonctions suppressives in vitro. Les différents modes de suppression découverts pour les Breg humains producteurs d’IL-10 in vitro incluent, à ce jour, l’inhibition de la prolifération des lymphocytes T effecteurs [19], l’inhibition de la polarisation T Th1 [17], l’induction de lymphocytes T régulateurs [20], et la suppression de la production de TNF-α (tumor necrosis factor) par les monocytes [18] (Tableau I). Plus récemment, il a été montré que les lymphocytes B CD19+CD24fortCD38fort inhibaient in vitro non seulement la polarisation Th1 (production d’IFN-γ), mais aussi la polarisation Th17 (production d’IL-17) par les lymphocytes T effecteurs et étaient également capables de convertir les lymphocytes T conventionnels (CD4+CD25-) en T régulateurs (21).
Table 1.
| Phénotype |
Activation |
Action |
Effet |
Réf. |
| CD19+CD24fortCD38fort
|
Cellules transfectées avec CD40L |
Soluble : IL-10 Contact : CD80 et CD86 |
Inhibition de la production d’INF-γ et de TNFα par les T CD4+
|
[17] |
|
| CD27+ ou CD24fort
|
CpG-B et anti-Ig |
Soluble : IL-10 |
Inhibition de la prolifération des T effecteurs |
[19] |
|
| CD27+CD24fort
|
CpG-B et CD40L recombinant |
Soluble : IL-10 |
Inhibition de la production de TNFα par les monocytes |
[18] |
|
|
|
Soluble : IL-10 |
Inhibition de la production d’INF-γ et de TNFα par les T CD4+
|
|
| CD19fortIgD+CD38fort
CD24fortCD5fort
|
Cellules transfectées avec CD40L |
|
|
[20] |
|
|
Contact : induction de Treg FoxP3+
|
Inhibition de la prolifération des T effecteurs |
|
Description des lymphocytes B régulateurs chez l’homme.
|
Une diminution de la fréquence et/ou des capacités fonctionnelles des Breg a pour l’instant été décrite au cours des maladies auto-immunes comme le lupus [
21], le purpura thrombopénique auto-immun [
22], la polyarthrite rhumatoïde [21], et les vascularites à ANCA (anticorps anticytoplasme des polynucléaires neutrophiles) [
23]. Certaines maladies auto-immunes (pemphigus cutané, lupus) sont traitées avec un anticorps monoclonal anti-CD20 (rituximab), qui entraîne une déplétion à la fois des lymphocytes B effecteurs et des Breg. Le résultat de cette diminution globale des lymphocytes B explique l’amélioration des symptômes. Cela indique que le rôle des lymphocytes B effecteurs est probablement prépondérant dans ces maladies. De plus, après déplétion lymphocytaire B, une des premières populations B à réapparaître contient les Breg, ce qui pourrait expliquer les rémissions cliniques prolongées parfois induites par le rituximab [
24,
25]. |
Le rôle des lymphocytes B régulateurs producteurs d’IL-10 est maintenant bien démontré in vivo au cours de maladies auto-immunes chez la souris et chez l’homme. Certaines questions, néanmoins, demeurent sans réponse à ce jour : existe-t-il, comme c’est le cas pour les lymphocytes T régulateurs naturels, une population lymphocytaire B régulatrice homogène, identifiable par l’expression d’un ou plusieurs facteurs de transcription spécifiques, tels que FoxP3 pour les lymphocytes T régulateurs naturels ? Cette population est-elle stable, en termes de phénotype et de fonction régulatrice, in vivo ? Ou, au contraire, la capacité régulatrice peut-elle être acquise ou perdue après stimulation, à tout stade de la différenciation lymphocytaire B, par une plasticité fonctionnelle comparable à celle décrite pour les lymphocytes T CD4 ? |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Jacquot
S
,
Boyer
O
. Hétérogénéité et fonctions des lymphocytes B chez l’homme . Med Sci (Paris).
2006; ; 22 : :1075.–1080. 2.
Battaglia
M
,
Gregori
S
,
Bacchetta
R
,
Roncarolo
M-G
. Tr1 cells: from discovery to their clinical application . Semin Immunol.
2006; ; 18 : :120.–127. 3.
Bouaziz
J-D
,
Yanaba
K
,
Tedder
TF
. Regulatory B cells as inhibitors of immune responses and inflammation . Immunol Rev.
2008; ; 224 : :201.–214. 4.
Llorente
L
,
Richaud-Patin
Y
,
Wijdenes
J
, et al.
Spontaneous production of interleukin-10 by B lymphocytes and monocytes in systemic lupus erythematosus . Eur Cytokine Netw.
1993; ; 4 : :421.–427. 5.
Katz
SI
,
Parker
D
,
Turk
JL
. B-cell suppression of delayed hypersensitivity reactions . Nature.
1974; ; 251 : :550.–551. 6.
Wolf
SD
,
Dittel
BN
,
Hardardottir
F
,
Janeway
CA, Jr
. Experimental autoimmune encephalomyelitis induction in genetically B cell-deficient mice . J Exp Med.
1996; ; 184 : :2271.–2278. 7.
Fillatreau
S
,
Sweenie
CH
,
McGeachy
MJ
,
Gray
D
,
Anderton
SM
. B cells regulate autoimmunity by provision of IL-10 . Nat Immunol.
2002; ; 3 : :944.–950. 8.
Yanaba
K
,
Bouaziz
J-D
,
Haas
KM
,
Poe
JC
,
Fujimoto
M
,
Tedder
TF
. A regulatory B cell subset with a unique CD1dhiCD5+ phenotype controls T cell-dependent inflammatory responses . Immunity.
2008; ; 28 : :639.–650. 9.
Matsushita
T
,
Yanaba
K
,
Bouaziz
J-D
,
Fujimoto
M
,
Tedder
TF
. Regulatory B cells inhibit EAE initiation in mice while other B cells promote disease progression . J Clin Invest.
2008; ; 118 : :3420.–3430. 10.
Watanabe
R
,
Ishiura
N
,
Nakashima
H
, et al.
Regulatory B cells (B10 cells) have a suppressive role in murine lupus: CD19 and B10 cell deficiency exacerbates systemic autoimmunity . J Immunol.
2010; ; 184 : :4801.–4809. 11.
Mauri
C
,
Gray
D
,
Mushtaq
N
,
Londei
M
. Prevention of arthritis by interleukin 10-producing B cells . J Exp Med.
2003; ; 197 : :489.–501. 12.
Mann
MK
,
Maresz
K
,
Shriver
LP
,
Tan
Y
,
Dittel
BN
. B cell regulation of CD4+CD25+ T regulatory cells and IL-10 via B7 is essential for recovery from experimental autoimmune encephalomyelitis . J Immunol.
2007; ; 178 : :3447.–3456. 13.
Yoshizaki
A
,
Miyagaki
T
,
DiLillo
DJ
, et al.
Regulatory B cells control T-cell autoimmunity through IL-21-dependent cognate interactions . Nature.
2012; ; 491 : :264.–268. 14.
Shen
P
,
Roch
T
,
Lampropoulou
V
, et al.
IL-35-producing B cells are critical regulators of immunity during autoimmune and infectious diseases . Nature.
2014; ; 507 : :366.–370. 15.
Martins
GA
,
Cimmino
L
,
Shapiro-Shelef
M
, et al.
Transcriptional repressor Blimp-1 regulates T cell homeostasis and function . Nat Immunol.
2006; ; 7 : :457.–465. 16.
Bouaziz
JD
,
Le Buanec
H
,
de Masson
A.
Purification and immunophenotypic characterization of human B cells with regulatory functions . Methods Mol Biol.
2014
(sous presse).
17.
Blair
PA
,
Noreña
LY
,
Flores-Borja
F
, et al.
CD19(+)CD24(hi)CD38(hi) B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic lupus erythematosus patients . Immunity.
2010; ; 32 : :129.–140. 18.
Iwata
Y
,
Matsushita
T
,
Horikawa
M
, et al.
Characterization of a rare IL-10-competent B-cell subset in humans that parallels mouse regulatory B10 cells . Blood.
2011; ; 117 : :530.–541. 19.
Bouaziz
J-D
,
Calbo
S
,
Maho-Vaillant
M
, et al.
IL-10 produced by activated human B cells regulates CD4(+) T-cell activation in vitro
. Eur J Immunol.
2010; ; 40 : :2686.–2691. 20.
Lemoine
S
,
Morva
A
,
Youinou
P
,
Jamin
C
. Human T cells induce their own regulation through activation of B cells . J Autoimmun.
2011; ; 36 : :228.–238. 21.
Flores-Borja
F
,
Bosma
A
,
Ng
D
, et al.
CD19+CD24hiCD38hi B cells maintain regulatory T cells while limiting TH1 and TH17 differentiation . Sci Transl Med.
2013; ; 5 : :173.ra123. 22.
Li
X
,
Zhong
H
,
Bao
W
,
Boulad
N
, et al.
Defective regulatory B-cell compartment in patients with immune thrombocytopenia . Blood.
2012; ; 120 : :3318.–3325. 23.
Wilde
B
,
Thewissen
M
,
Damoiseaux
J
, et al.
Regulatory B cells in ANCA-associated vasculitis . Ann Rheum Dis.
2013; ; 72 : :1416.–1419. 24.
Colliou
N
,
Picard
D
,
Caillot
F
, et al.
Long-term remissions of severe pemphigus after rituximab therapy are associated with prolonged failure of desmoglein B cell response . Sci Transl Med.
2013; ; 5 : :175.ra130. 25.
Anolik
JH
,
Barnard
J
,
Owen
T
, et al.
Delayed memory B cell recovery in peripheral blood and lymphoid tissue in systemic lupus erythematosus after B cell depletion therapy . Arthritis Rheum.
2007; ; 56 : :3044.–3056. |