| |
| Med Sci (Paris). 2014 August; 30(8-9): 727–729. Published online 2014 September 1. doi: 10.1051/medsci/20143008004.La résistance de P. falciparum à l’artémisinine Vers une meilleure compréhension des mécanismes moléculaires parasitaires Nimol Khim,1 Benoit Witkowski,1 Valentine Duru,1 Frédéric Ariey,1 Odile Mercereau-Puijalon,1 and Didier Ménard1* 1Unité d’épidémiologie moléculaire du paludisme Institut Pasteur du Cambodge, 5, boulevard Monivong, BP 983, 101 Phnom Penh, Cambodge MeSH keywords: Antipaludiques, usage thérapeutique, Artémisinines, Résistance aux substances, génétique, Humains, Paludisme à Plasmodium falciparum, traitement médicamenteux, parasitologie, Plasmodium falciparum, effets des médicaments et des substances chimiques, Polymorphisme génétique, Transduction du signal, Transcriptome |
Le paludisme est une maladie parasitaire, potentiellement mortelle, causée par un protozoaire du genre Plasmodium. Le parasite est transmis à l’homme par piqûre de moustiques femelles infestées du genre Anophèle. Parmi les cinq espèces infectant l’homme, P. falciparum est l’espèce responsable de la plupart des cas graves et des décès dus au paludisme [
1]. |
Les progrès accomplis grâce aux stratégies de lutte mises en place Le paludisme demeure un problème majeur de santé publique malgré les immenses progrès accomplis depuis plus de 10 ans. L’intensification des efforts de lutte, associée à une augmentation sans précédent des moyens financiers publics ou privés, a permis de faire chuter la mortalité de 45 % au niveau mondial par rapport à 2000, et de 49 % en Afrique sub-saharienne [1]. La lutte antivectorielle (moustiquaires imprégnées d’insecticide à longue rémanence et aspersions intradomiciliaires) vise à réduire la transmission, l’incidence/prévalence des infections plasmodiales et du paludisme clinique. La prise en charge précoce et efficace des patients (diagnostic biologique de l’infection et traitement des cas positifs par des associations médicamenteuses à base d’artémisinine) permet de réduire la durée de la maladie, de prévenir les complications et la plupart des décès dus au paludisme. Il ne fait nul doute que l’efficacité de ces nouvelles combinaisons thérapeutiques (ACT, artemisinin-combined therapies), associant un dérivé de l’artémisinine à action rapide et une drogue partenaire à action plus lente, a contribué aux remarquables progrès de la lutte, particulièrement dans les zones de faible transmission [
2]. |
Les menaces : les résistances aux antipaludiques, la résistance aux dérivés de l’artémisinine La résistance aux antipaludiques est un problème récurrent. L’émergence, puis la diffusion, au cours des années 1970 et 1980, de la résistance de P. falciparum aux précédentes générations de médicaments comme la chloroquine et la sulfadoxine-pyrimethamine [
3], ont eu pour conséquence l’anéantissement des efforts de lutte, avec la disparition des progrès accomplis et une augmentation dramatique de la morbidité et de la mortalité palustres, essentiellement en Afrique sub-saharienne [
4]. Depuis 2008, l’efficacité des ACT dans le traitement du paludisme à P. falciparum a diminué en Asie du Sud-Est [
5,
6]. Ceci se traduit par une réduction importante de la vitesse d’élimination des parasites chez les patients traités (demi-vie de clairance parasitaire) par un dérivé de l’artémisinine seul ou en association avec une molécule partenaire (ACT) [
7]. Rapportés tout d’abord dans l’ouest du Cambodge [5, 6], des cas de résistance ont été ensuite observés au Cambodge, Thaïlande, Myanmar et Vietnam, lors d’études cliniques [1]. Bien que constituant un outil efficace pour détecter l’apparition des résistances à l’artémisinine, ces études cliniques sont logistiquement lourdes, onéreuses et donc impossibles à déployer à grande échelle. La résistance des parasites à l’artémisinine est apparue alors que nous ne disposions pas de test in vitro ni de marqueur moléculaire pour la détecter et la quantifier, entravant les efforts de lutte et les travaux visant à mieux comprendre les mécanismes cellulaires et moléculaires en jeu. |
Les avancées majeures en 2013 : caractérisation in vitro des souches résistantes et identification de signatures moléculaires associées à la résistance à l’artémisinine Pour obtenir des conditions in vitro permettant de détecter les souches résistantes, nous avons développé une approche originale, consistant à mimer les conditions physiologiques auxquelles les parasites étaient soumis au cours d’un traitement chez l’homme. En d’autres termes, au lieu d’exposer les parasites pendant 48 h à des doses sub-thérapeutiques (0,1 à 60 nM), nous avons exposé les parasites à une dose élevée pour une durée similaire à celle qui est observée chez l’homme au cours d’un traitement par les dérivés de l’artémisinine (700 nM pendant 6 h). Nous avons ainsi mis en évidence une nette différence de sensibilité in vitro selon que les souches de P. falciparum provenaient de zones où la résistance clinique à l’artémisinine était établie ou de zones indemnes de résistance clinique [
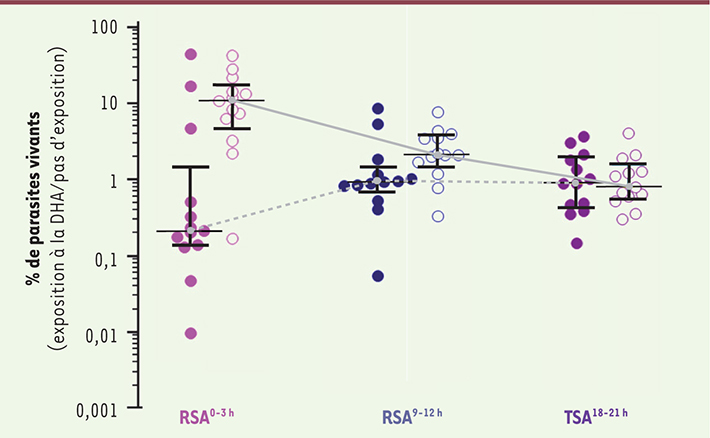
8]. Ce travail a permis non seulement de démontrer que cette approche était pertinente pour obtenir un phénotype in vitro informatif, mais également de montrer que la résistance ne concernait que le stade anneau, les formes mûres demeurant sensibles à l’artémisinine. Enfin, il montrait que la résistance des anneaux était provoquée par un arrêt de développement des parasites exposés (dormance) [8]. L’amélioration de ce test (appelé RSA pour ring-stage survival assay) a permis de définir précisément l’âge des parasites résistants au pulse d’artémisinine (stades âgés de 0 à 3 h) et d’associer les données cliniques (demi-vie de clairance parasitaire) à ce phénotype in vitro [
9] (Figure 1).
 | Figure 1.
Survie in vitro des parasites après exposition à la dihydroartémisinine. Les résultats sont exprimés comme la proportion de parasites survivants après une exposition de 6 heures de parasites âgés de 0 à 3 heures (très jeunes anneaux), âgés de 9 à 12 heures (anneaux âgés) ou de parasites âgés de 18 à 21 heures (trophozoïtes), à 700 nM de dihydroartémisinine (DHA) ou de diméthylsulfoxide (pour les contrôles). Ces tests in vitro ont été effectués sur des parasites adaptés en culture continue isolés chez 13 patients et présentant une demi-vie d’élimination rapide (< 4,8 h, cercles colorés) et chez 13 patients présentant une demi-vie d’élimination retardée (> 7,8 h, cercles non colorés) au cours d’une étude clinique conduite à Pursat en 2010. La ligne horizontale représente les médianes et les barres les interquartiles 25 % et 75 %. La ligne pleine en gris montre le profil de survie des parasites isolés de patients avec une demi-vie d’élimination retardée et la ligne hachurée en gris, le profil de survie des parasites isolés de patients avec une demi-vie d’élimination rapide. RSA : ring-stage survival assay ; TSA : trophozoite-stage survival assay (adapté de [ 9]). |
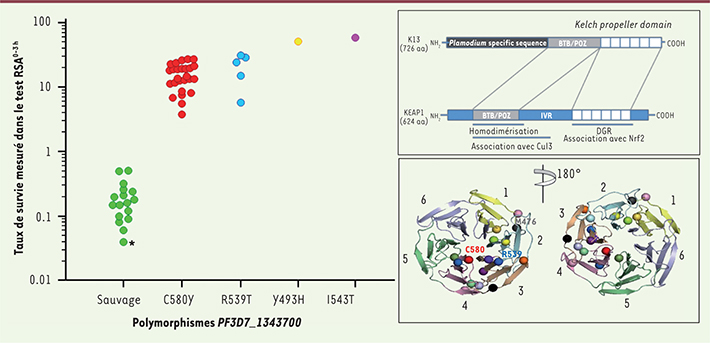
Le test RSA a ouvert la voie à la recherche des signatures moléculaires parasitaires associées à la résistance à l’artémisinine. Nous avons tout d’abord recherché les mutations acquises par F32-ART5, une souche d’origine africaine que le groupe de Françoise Benoit-Vical (CNRS Toulouse) a rendue résistante par des expositions répétées à des doses croissantes d’artémisinine pendant cinq ans. En comparant l’exome de F32-ART5 avec celui de sa souche jumelle (F32-TEM), cultivée dans les mêmes conditions mais sans exposition à la drogue, et celui de la souche parentale, huit mutations dans sept gènes ont été identifiées. L’analyse du génome de trois intermédiaires de la lignée F32-ART (après 22, 40 et 56 cycles d’exposition), a précisé la chronologie d’apparition des mutations. Nous avons ensuite étudié le polymorphisme de ces sept gènes candidats de 49 souches du Cambodge pour lesquelles nous avions déterminé le phénotype grâce au test RSA. Nous avons observé une association forte entre la présence d’un gène PF3D7_1343700 muté (mutation au sein du domaine en hélice de la protéine K13) et la susceptibilité in vitro caractérisée par le RSA (Figure 2). Une étude spatio-temporelle (2001-2012) a montré un envahissement progressif des zones classées comme résistantes (ouest du Cambodge) par des parasites mutants (18 allèles différents), le gène demeurant sauvage dans les zones indemnes de résistance (est du Cambodge). Enfin, la mise en évidence de l’association entre la présence de parasites mutés et une demi-vie d’élimination parasitaire augmentée dans les isolats de patients étudiés par le groupe de Rick Fairhurst (NIAID/NIH, États-Unis), a confirmé que ce marqueur moléculaire était bien un déterminant majeur de la résistance à l’artémisinine [
10].
 | Figure 2.
Taux de survie de Plasmodium falciparum en fonction de la présence de mutations du gène K13. Le taux de survie de P. falciparum provenant du Cambodge est mesuré dans le test RSA après exposition des stades anneaux âgés de 0-3 h pendant 6 h à 700 nM de dihydroartémisinine (test RSA 0-3 h) en fonction de leur mutation au sein du gène K13 et représentation schématique du gène K13 et du domaine en hélice de la protéine K13. Dans la partie gauche de la figure, les génotypes K13 ont été obtenus par le séquençage du génome de 21 parasites et par le séquençage de produits PCR ciblant le domaine en hélice du gène K13 (28 parasites). Les parasites mutants avaient un taux de survie significativement plus élevé que les parasites sauvages : allèle sauvage (n = 17, médiane : 0,16 %, interquartiles 25 et 75 % : 0,09-0,24 %, extrêmes : 0,04-0,51 %) ; allèle C580Y (n = 26, médiane : 14,1 %, interquartiles 25 et 75 % : 11,3-19,6 %, extrêmes : 3,8-27,3 %, P < 10 -6, sauvage versus C580Y, test de Mann-Whitney) ; allèle R539T (n = 5, médiane : 24,2 %, interquartiles 25 et 75 % : 12,6-29,5 %, extrêmes : 5,8-31,3 %, P < 10 -3, sauvage versus R539T) ; allèle Y493H (51,4 %) ; et allèle I543T (58,0 %). Le taux de survie de la souche de référence 3D7 (0,04 %) est indiqué sur la figure par un astérisque (adapté de [ 10]). Dans la partie droite de la figure est présentée la représentation schématique de l’homologie existant entre le gène K13 de P. falciparum et le gène codant pour la protéine humaine KEAP1 ( Kelch like ECH-associated protein 1) et modélisation en 3D du domaine en hélice de la protéine K13 (adapté de [
11]). |
|
Conclusion et perspectives L’apport de ces deux nouveaux outils constitue une étape importante dans la lutte contre le paludisme. En effet, le phénotypage in vitro permettra, d’une part, de rechercher d’autres signatures moléculaires associées à la résistance à l’artémisinine et, d’autre part, d’évaluer l’efficacité de nouvelles drogues actives sur les parasites résistants. Enfin, la mise en place à large échelle d’une surveillance moléculaire basée sur la détection de mutations, au sein du gène K13, par des techniques moléculaires simples et peu onéreuses à partir d’une goutte de sang prélevée au bout du doigt, permettra d’apprécier en « temps réel » l’aire de distribution des parasites résistants, et de proposer des thérapeutiques adaptées à la situation épidémiologique. Ce contexte, sans précédent, doit nous permettre d’éviter une nouvelle catastrophe sanitaire, telle que nous l’avons connue dans les années 1980, lors de la diffusion de parasites chloroquino-résistants en Afrique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
World Health Organization . World malaria report 2013 . Geneva: : WHO; , 2014. 2.
White
NJ
,
Pukrittayakamee
S
,
Hien
TT
, et al.
Malaria . Lancet.
2014; ; 383 : :723.–735. 3.
Mita
T
,
Tanabe
K
,
Kita
K
. Spread and evolution of Plasmodium falciparum drug resistance . Parasitol Int.
2009; ; 58 : :201.–209. 4.
Trape
JF
,
Pison
G
,
Spiegel
A
, et al.
Combating malaria in Africa . Trends Parasitol.
2002; ; 18 : :224.–230. 5.
Dondorp
AM
,
Nosten
F
,
Yi
P
, et al.
Artemisinin resistance in Plasmodium falciparum malaria . N Engl J Med.
2009; ; 361 : :455.–467. 6.
Noedl
H
,
Se
Y
,
Schaecher
K
, et al.
Evidence of artemisinin-resistant malaria in western Cambodia . N Engl J Med.
2008; ; 359 : :2619.–2620. 7.
Flegg
JA
,
Guerin
PJ
,
White
NJ
,
Stepniewska
K.
Standardizing the measurement of parasite clearance in falciparum malaria: the parasite clearance estimator . Malar J.
2011; ; 10 : :339.. 8.
Witkowski
B
,
Khim
N
,
Chim
P
, et al.
Reduced artemisinin susceptibility of Plasmodium falciparum ring stages in western Cambodia . Antimicrob Agents Chemother.
2013; ; 57 : :914.–923. 9.
Witkowski
B
,
Amaratunga
C
,
Khim
N
, et al.
Novel phenotypic assays for the detection of artemisinin-resistant Plasmodium falciparum malaria in Cambodia: in-vitro and ex-vivo drug-response studies . Lancet Infect Dis.
2013; ; 13 : :1043.–1049. 10.
Ariey
F
,
Witkowski
B
,
Amaratunga
C
, et al.
A molecular marker of artemisinin-resistant Plasmodium falciparum malaria . Nature.
2014; ; 505 : :50.–55. 11.
Mitsuishi
Y
,
Motohashi
H
,
Yamamoto
M.
The Keap1-Nrf2 system in cancers: stress response, anabolic metabolism . Front Oncol.
2012; ; 2 : :200.. |