| |
| Med Sci (Paris). 2014 August; 30(8-9): 765–771. Published online 2014 September 1. doi: 10.1051/medsci/20143008014.Implication des corps nucléaires PML dans l’immunité intrinsèque et innée Mohamed Ali Maroui,1 Faten El Asmi,1 Jacques Dutrieux,1 Mounira K. Chelbi-Alix,1 and Sébastien Nisole1* 1Inserm UMR-S 1124, université Paris Descartes, 45, rue des Saints-Pères, 75006Paris, France |

La première ligne de défense contre les agents pathogènes est constituée, outre les barrières physiologiques, par l’immunité innée [
38]. L’immunité innée consiste en la détection de composants de ces pathogènes, signatures moléculaires désignées pathogen-associated molecular patterns (PAMP), par des détecteurs cellulaires connus sous le nom de pattern-recognition receptors (PRR) [
39]. En réponse à la détection d’un PAMP, ces PRR déclenchent des signaux de transduction qui, à leur tour, sont responsables d’une réponse adaptée à l’élimination du pathogène. Dans le cas des virus, il s’agit de la réponse interféron (IFN). Par ailleurs, l’existence d’autres mécanismes de défense aux infections virales, impliquant des facteurs antiviraux cellulaires désignés sous le terme de facteurs de restriction, a été recemment identifiée ; cette protection cellulaire a été qualifiée d’immunité intrinsèque [
1]. Cependant, comme l’expression de ces facteurs est aussi induite par l’IFN, la frontière entre ces deux types d’immunité est relativement floue. La famille des protéines TRIM (tripartite motif) comprend plus de 70 protéines chez l’homme. Ces protéines se caractérisent par une organisation en trois domaines : un domaine RING, une ou deux B-Box et un domaine coiled-coil ; ce motif tripartite est ainsi désigné RBCC. Ces protéines TRIM ont récemment été identifiées comme des acteurs clés de la défense antivirale. Ainsi, certaines d’entre elles possèdent une activité antivirale intrinsèque, TRIM5a, TRIM19 ou TRIM22, tandis que de nombreuses autres régulent de façon importante les voies de signalisation qui déclenchent la synthèse d’IFN et/ou de cytokines pro-inflammatoires [
2–
4]. La protéine TRIM19, mieux connue sous le nom de PML (promyelocytic leukemia), a tout d’abord été identifiée sous forme d’une protéine de fusion PML-RARα entre PML et le récepteur de l’acide rétinoïque (RAR-α), conséquence d’une translocation chromosomique t(15;17) intervenant chez des patients atteints de leucémie aiguë promyélocytaire [
5]. Du fait d’un épissage alternatif à partir d’un gène unique, il existe sept isoformes de PML (PMLI à VIIb) ayant toutes le motif RBCC/TRIM, mais une extrémité carboxy-terminale spécifique (Figure 1) [
6,
7]. La variabilité de la région carboxy-terminale des isoformes de PML leur permet d’interagir avec différents partenaires et leur confère donc des fonctions spécifiques [6]. PML a une distribution intranucléaire, avec une forme diffuse majoritaire dans le nucléoplasme et une forme associée à la matrice nucléaire appelée en français corps nucléaire PML (CN PML) et en anglais PML nuclear body (PML NB) (Figure 2). Les CN PML sont des structures nucléaires multiprotéiques dont PML est « l’organisatrice » [
8]. Ces structures contiennent des protéines résidentes de façon permanente, comme PML, Sp100 et SUMO (small ubiquitin modifier), et une multitude de protéines y sont recrutées de façon transitoire et en réponse à divers stimulus (Figure 2). PML se lie à SUMO de façon covalente (processus appelé SUMOylation), modification qui régule sa localisation subcellulaire, sa stabilité, sa capacité à former les CN PML et à recruter différents partenaires au sein de ces structures. SUMO peut également se fixer à PML de façon non covalente, via le domaine SIM (SUMO interacting motif) de certaines isoformes de PML, domaine situé au niveau de leur extrémité carboxy-terminale (Figure 2). PML et les CN PML sont impliqués dans plusieurs processus cellulaires tels que l’apoptose, la sénescence, la différenciation cellulaire, ainsi que la stabilité du génome [
9–
12]; notre groupe a contribué à montrer leur implication dans la réponse à l’IFN et la défense antivirale [6,
13–
21] (Figure 2).
 | Figure 1.
Génération des sept principales isoformes de PML. Le gène PML est constitué de neuf exons (notés de 1 à 9), les exons 7 et 8 étant subdivisés en exons 7a, 7b, 8a et 8b. L’épissage alternatif du transcrit PML conduit à la traduction de sept isoformes, désignées PMLI à PMLVIIb. Toutes les isoformes possédent le motif RBCC/TRIM en amino-terminal et une région carboxy-terminale spécifique. La composition en exons de la portion carboxy-terminale de chaque isoforme est représentée. L’exon 7b* présent dans l’isoforme PMLIII est hors cadre de lecture, ce qui génère un codon STOP précoce. Les isoformes PMLI à PMLVI, toutes pourvues du signal de localisation nucléaire (nls), sont nucléaires, tandis que l’isoforme PMLVIIb, qui en est dénuée, est strictement cytoplasmique. |
 | Figure 2.
PML est l’organisatrice des CN. PML peut être conjuguée à SUMO (représenté par un « S ») au niveau de trois résidus lysine situés dans le domaine RING (R), dans le domaine B-Box 1 (B1) et au niveau du nls. La conjugaison de PML à SUMO est requise pour la formation de CN PML fonctionnels. Les isoformes PMLI à V possèdent également un domaine SIM (SUMO interacting motif), qui permet la fixation non covalente de SUMO. Outre SUMO et PML, Sp100 est également une protéine résidente des CN PML. PML et les CN PML sont impliqués dans plusieurs processus cellulaires tels que l’apoptose, la sénescence, la différenciation cellulaire, la réponse à l’IFN et la défense antivirale. PML a une distribution intranucléaire avec une forme diffuse majoritaire dans le nucléoplasme et une forme associée aux CN PML détectée sous forme de spots nucléaires par immunofluorescence. L’IFN induit directement l’expression du gène de PML, et augmente le nombre et la taille des CN PML. |
Dans cette revue, nous résumons les différentes études qui ont permis d’identifier PML comme un important acteur des immunités antivirales intrinsèque et innée. Les virus dont il sera question ici appartiennent à différentes familles virales, à ADN ou à ARN. Parmi les virus à ARN, nous citerons des membres de la famille des Picornaviridae (virus de l’encéphalomyocardite, EMCV), des Rhabdoviridae (virus de la rage et virus de la stomatite vésiculaire, VSV), des Retroviridae (virus T-lymphotrope humain de type I, HTLV-1), des Orthomyxoviridae (virus de la grippe), des Paramyxoviridae (virus Sendaï, SeV) ; les virus à ADN mentionnés comprennent les Herpesviridae (virus varicelle-zona, VZV) et les Poxviridae (virus de la vaccine). |
L’expression de PML/TRIM19 est directement induite par l’interféron Les interférons (IFN) ont été découverts en 1957 pour leur propriété antivirale. Depuis cette date, d’autres activités leur ont été attribuées, telles que l’inhibition de la multiplication cellulaire et l’induction de l’apoptose, mais c’est toujours l’activité antivirale qui permet de les définir. Ils sont utilisés dans le traitement de maladies virales et en cancérologie. Les IFN sont classés en trois types : I (α, β et ω), II (γ) et III (λ) [
22]. Après fixation des IFN de type I sur leurs récepteurs (IFNAR1/IFNAR2), les protéine kinases JAK1 (Janus kinase 1) et TYK2 (tyrosine kinase 2) sont phosphorylées, et phosphorylent à leur tour les protéines STAT (signal transducer and activator of transcription, STAT1 et -2), qui se lient alors à IRF-9 (interferon regulatory factor-9). Ce complexe migre vers le noyau, se fixe sur une séquence d’ADN dite ISRE (interferon-stimulated response element) et active la transcription des gènes répondant aux IFN de type I. Sous l’effet de l’IFN de type II (IFN γ), les kinases JAK1 et -2 sont activées, et elles phosphorylent ainsi STAT1, ce qui aboutit à la formation d’homodimères. Ceux-ci migrent vers le noyau, se fixent sur une séquence GAS (gamma activation site) et activent la transcription des gènes répondant à l’IFN de type II. Les IFN de type III, bien qu’ils se fixent à des récepteurs spécifiques, activent la même voie de signalisation que l’IFN de type I et régulent donc l’expression des mêmes gènes. PML/TRIM19 est la première des protéines TRIM identifiées dont l’expression est augmentée dans les cellules traitées par l’IFN [
23]. En effet, l’expression du gène PML est directement induite par tous les types d’IFN, via les séquences ISRE (-GAGAATCGAAACT-) et GAS (-TTTACCGTAAG-) présents dans son promoteur [
24] ; cet effet aboutit à l’augmentation de l’expression des différentes isoformes de PML et à l’augmentation des CN PML, en nombre et en taille [23]. Les IFN induisent l’expression des gènes codant pour des protéines relayant leurs effets biologiques. PML, l’organisatrice des CN PML, est l’une de ces protéines, et elle joue un rôle clé dans la réponse à l’IFN. De plus, PML régule positivement le signal de transduction de l’IFN de type II en prolongeant l’activation de STAT1 et sa liaison à la séquence GAS, augmentant ainsi la réponse biologique à cet IFN [
25]. |
Implication de PML/TRIM19 dans l’activité antivirale intrinsèque PML/TRIM19 exerce une activité antivirale intrinsèque vis-à-vis de virus appartenant à des familles différentes [6, 13,
14,
19–21]. Le rôle de PML dans la défense antivirale est aussi attesté par le fait que les souris invalidées pour le gène pml sont plus sensibles aux infections virales que les souris parentales [
26]. Certaines isoformes de PML ont été identifiées comme capables de conférer une résistance à des virus à ARN ou à ADN [6,
15–21,
27–
30]. PMLIV, notamment, possède une activité antivirale intrinsèque vis-à-vis de l’EMCV [
17], du virus de la rage [
16], du VZV [
28] et du VSV [13,
18, 26]. Nous ne développerons ici que les effets de PMLIV sur l’infection par l’EMCV et le VZV, virus qui se répliquent respectivement dans le cytoplasme et dans le noyau. Dans les deux cas, PMLIV interagit avec une protéine virale, la séquestre au sein des CN PML, inhibant ainsi ses fonctions et, par conséquent, la multiplication virale (Figure 3).
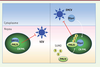 | Figure 3.
PMLIV confère une résistance au VZV et à l’EMCV. Comme celle de tous les virus de la famille des Herpesviridae, la réplication du VZV se déroule dans le noyau des cellules infectées. L’EMCV appartient quant à lui à la famille des Picornaviridae et se réplique exclusivement dans le cytoplasme. Seules les protéines virales 3Dpol et 3Cpro se retrouvent dans le noyau au début de l’infection. Parmi toutes les isoformes de PML, seule PMLIV est capable de séquestrer au sein des CN PML la capside ORF23 du VZV et la 3Dpol de l’EMCV, inhibant ainsi la multiplication de ces virus. |
L’EMCV appartient à la famille des Picornaviridae et au genre Cardiovirus. Son génome est un ARN simple brin de polarité positive. Bien que l’EMCV se réplique entièrement dans le cytoplasme, la protéine virale 3D polymérase (3Dpol) et la protéase virale 3Cpro se retrouvent dans le noyau au début de l’infection, formant des structures ponctuées [17,
31]. Les fibroblastes embryonnaires qui dérivent des souris invalidées pour le gène pml (MEF PML
-/-
) sont plus sensibles à l’infection par l’EMCV que les MEF parentaux [
32], suggérant l’implication de PML dans la défense contre ce virus. Une étude surexprimant chacune des isoformes de PML (PMLI à PMLVIIb) d’une manière stable dans des cellules humaines a montré que seule PMLIV protège les cellules de l’infection par L’EMCV. PMLIV, via sa région spécifique carboxy-terminale, interagit avec la polymérase virale 3Dpol et la séquestre dans les CN PML, ce qui affecte la réplication de l’ARN viral [17]. La SUMOylation de PMLIV est requise pour cet effet antiviral puisque le mutant PMLIV3KR non SUMOylable n’est plus capable de recruter la 3Dpol au niveau des CN PML et, par conséquent, n’inhibe plus la réplication virale [17] (Figure 3). Fait remarquable, la diminution spécifique de l’expression de PMLIV par ARN interférence réduit considérablement l’effet protecteur de l’IFN dans les cellules infectées par l’EMCV, démontrant que PMLIV est un médiateur de l’effet anti-EMCV de l’IFN. Le virus varicelle-zona (VZV) appartient à la famille des Herpesviridae et possède un génome à ADN double-brin linéaire ; sa réplication se déroule dans le noyau. La diminution de l’expression de PML par ARN interférence rend les cellules plus sensibles à l’infection [
33] suggèrant le rôle de PML/TRIM19 dans la défense antivirale vis-à-vis du VZV. Comme pour les cellules infectées par l’EMCV, seule la surexpression de PMLIV confère une résistance au VZV en séquestrant la protéine de capside ORF23 (open reading frame 23) dans les CN PML [28] (Figure 3). Le domaine carboxy-terminal de PMLIV est requis pour l’interaction avec ORF23 et sa séquestration dans les CN PML, et, par conséquent, pour l’effet antiviral. En effet, le mutant de PMLIV, PMLIVΔ8ab, dépourvu de la région carboxy-terminale spécifique de cette isoforme, ne se lie plus à ORF23 et est dénué d’activité antivirale [28]. Ces travaux décryptent les mécanismes par lesquels une isoforme de PML, PMLIV, inhibe de façon intrinsèque un virus à ARN qui se réplique dans le cytoplasme et un virus à ADN qui se réplique dans le noyau, en séquestrant des protéines virales au sein des CN PML. |
PML/TRIM19 intervient dans l’immunité innée en ciblant Pin1 Notre équipe a montré qu’en plus de son activité antivirale intrinsèque vis-à-vis de virus de familles différentes, PMLIV a aussi une activité plus tardive, régulant positivement la production d’IFN-β via la séquestration de Pin1 dans les CN PML [18]. Pin1 est une peptidyl-prolyl cis/trans isomerase (PPIase) qui a tout d’abord été identifiée au cours du criblage de molécules régulant la mitose [
34,
40] (→).
(→) Voir la Synthèse de J. Marsolier et J.B. Weitzman, page 772 de ce numéro
Pin1 est constituée de 163 acides aminés et contient deux domaines fonctionnels : le domaine amino-terminal de liaison WW et le domaine carboxy-terminal peptidyl-prolyl isomérase. Le domaine de liaison WW est responsable de la reconnaissance spécifique de protéines phosphorylées au niveau de motifs sérine-proline, tandis que le domaine isomérase carboxy-terminal catalyse l’isomérisation cis/trans du pont peptidique. Ce changement de conformation a des effets importants sur la phosphorylation, la conformation, la localisation subcellulaire, la stabilité et la fonction de nombreux substrats de Pin1 [
35]. Pin1 participe ainsi à la régulation de très nombreux processus cellulaires comme le contrôle du cycle cellulaire, la production de cytokines, la régulation transcriptionnelle, la tumorigenèse ou la neurodégénérescence. Parmi les nombreuses protéines identifiées comme étant la cible de Pin1 figure le facteur de transcription IRF3 (interferon regulatory factor 3) [
36]. Comme résumé dans l’introduction, la reconnaissance d’un PAMP viral par l’un des PRR cellulaires induit une cascade de transduction spécifique. Cependant, quel que soit le PRR activé, toutes les voies de signalisation aboutissent à la phosphorylation d’IRF3, suivie de sa dimérisation et de sa translocation dans le noyau. À ce niveau, les dimères d’IRF3 phosphorylé (IRF3-P) induisent la transcription du gène codant pour l’IFN-β en se liant aux éléments de réponse situés dans son promoteur. Une fois la réponse IFN enclenchée, le retour à l’état basal est assuré par la reconnaissance du facteur de transcription IRF3-P par Pin1, qui provoque son isomérisation ; celle-ci conduit à la dégradation d’IRF3-P par le protéasome [36] (Figure 4).
 | Figure 4.
PMLIV stimule la synthèse d’IFN-β en séquestrant Pin1. Lorsqu’un virus infecte une cellule, ses composants protéiques ou nucléiques sont reconnus par des détecteurs cellulaires, les PRR (pathogen recognition receptor). Cette détection déclenche une cascade de transduction qui aboutit, quel que soit le virus, à la phosphorylation du facteur de transcription IRF3, à sa dimérisation et à sa translocation dans le noyau, où il induit l’expression d’IFN-β. Cette activation transcriptionnelle est ensuite arrêtée par l’interaction de Pin1 avec IRF3 phosphorylé, qui l’isomérise et entraîne sa dégradation par le système ubiquitine/protéasome. La surexpression de PMLIV entraîne un recrutement de Pin1 au sein des CN PML, empêchant ainsi la dégradation d’IRF3 phosphorylé induite par Pin1. Il en résulte une forte augmentation de la synthèse d’IFN-β. IKK : IkB kinase ; TANK : TRAF (TNF receptor associated factor) family member-associated NFkB activator ; TBK1 : TANK-binding kinase 1. |
Nous avons montré pour la première fois que parmi toutes les isoformes de PML, seule PMLIV est un régulateur positif de la production d’IFN en réponse à une infection virale. Plus particulièrement, la surexpression de PMLIV induit une forte augmentation de la transcription d’IFN-β lors de l’infection par des virus de différentes familles, à ADN et à ARN ; citons le VSV, le virus Sendaï (SeV), le virus de la grippe, l’EMCV, le virus de la vaccine ou le HTLV-I. Un tel effet est également observé dans les cellules transfectées avec un analogue synthétique de l’ARN double brin, le poly(I:C). L’augmentation de la synthèse d’IFN-β par PMLIV, qui varie de 10 à 100 fois selon le virus, dépend d’IRF3. En effet, nous avons observé que la surexpression de PMLIV conduit à une plus grande stabilité d’IRF3-P dans les cellules infectées. L’IFN-β synthétisé produit est capable de protéger d’autres cellules d’une infection ultérieure. À l’inverse, la diminution spécifique de l’expression de PMLIV endogène par ARN interférence dans différentes lignées cellulaires humaines engendre une forte diminution du niveau d’IRF3-P et de la synthèse d’IFN-β suite à une infection virale. Le mécanisme d’action implique une interaction de PMLIV avec Pin1 ; celle-ci induit le transfert de Pin1 à la matrice nucléaire et son recrutement dans les CN PML. Le recrutement de Pin1 dans les CN PML empêche l’isomérisation d’IRF3-P et sa dégradation. La stabilisation d’IRF3-P prolonge la transcription du gène codant l’IFN-β et donc la synthèse de ce dernier lors d’une infection virale (Figure 4). Il est intéressant de constater qu’une autre protéine de la famille TRIM, TRIM21, a également été décrite comme augmentant la réponse IFN via Pin1. Contrairement à PMLIV, TRIM21 ne séquestre pas Pin1, mais empêche son interaction avec IRF3-P [
37]. Ces résultats démontrent donc, qu’en plus de ses activités antivirales intrinsèques, PMLIV est également capable de réguler la réponse innée au cours d’une infection virale. Ces travaux suggèrent aussi qu’en recrutant Pin1 au sein des CN PML, PMLIV pourrait inhiber d’autres fonctions de Pin1. D’autres études seront nécessaires pour approfondir ces résultats. |
Les CN PML sont, comme les corps de Cajal ou les nucléoles, des structures nucléaires dynamiques, impliquées dans de nombreuses activités biologiques. Bien que leur fonction exacte ne soit pas encore totalement élucidée, les CN PML semblent représenter des plates-formes de rétention, de modification et de dégradation protéique. PML, qui est l’organisatrice de ces corps, est le produit d’un gène dont l’expression est directement induite par l’IFN, et cette induction provoque une augmentation du nombre et de la taille des CN PML. PML exerce une activité antivirale intrinsèque en recrutant des protéines virales au sein des CN PML, inhibant ainsi leur fonction. De nouvelles données montrent que PML régule positivement la production d’IFN de type I dans les cellules infectées par des virus à ARN et à ADN de différentes familles, et que la sumoylation de PML est requise pour ce processus. Ces différentes observations renforcent l’idée selon laquelle les CN PML sont également des centres importants de la défense antivirale et de la réponse IFN. De nombreux virus ont développé diverses stratégies pour contrecarrer la réponse antivirale et utiliser la machinerie cellulaire à leur profit. Ainsi, plusieurs virus induisent la dégradation de PML et/ou sa délocalisation des CN PML. L’altération des CN consécutive à une infection virale bloque l’activité antivirale intrinsèque de PML ainsi que sa capacité à accroître la production d’IFN. À l’instar de PML/TRIM19, un nombre croissant de protéines de la famille TRIM ont été identifiées comme étant dotées d’une activité antivirale intrinsèque et/ou impliquées dans la régulation de la réponse IFN [2–4]. Le terme de « TRIMmunité », récemment introduit [2], illustre les nouvelles perspectives de recherche concernant cette vaste famille de protéines, très conservée au cours de l’évolution. Des perspectives thérapeutiques peuvent notamment être envisagées, étant donné le positionnement central de ces protéines à l’interface des immunités intrinsèque et innée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Bieniasz
PD
. Intrinsic immunity: a front-line defense against viral attack . Nat Immunol.
2004; ; 5 : :1109.–1115. 2.
Rajsbaum
R
,
Garcia-Sastre
A
,
Versteeg
GA
. TRIMmunity: the roles of the TRIM E3-ubiquitin ligase family in innate antiviral immunity . J Mol Biol.
2013; ; 426 : :1265.–1284. 3.
Nisole
S
,
Stoye
JP
,
Saib
A
. TRIM family proteins: retroviral restriction and antiviral defence . Nat Rev Microbiol.
2005; ; 3 : :799.–808. 4.
McNab
FW
,
Rajsbaum
R
,
Stoye
JP
,
O’Garra
A
. Tripartite-motif proteins and innate immune regulation . Curr Opin Immunol.
2011; ; 23 : :46.–56. 5.
De Thé
H
,
Lavau
C
,
Marchio
A
, et al.
The PML-RAR alpha fusion mRNA generated by the t(15;17) translocation in acute promyelocytic leukemia encodes a functionally altered RAR . Cell.
1991; ; 66 : :675.–684. 6.
Nisole
S
,
Maroui
MA
,
Mascle
XH
, et al.
Differential roles of PML isoforms . Front Oncol.
2013; ; 3 : :125.. 7.
Jensen
K
,
Shiels
C
,
Freemont
PS
. PML protein isoforms and the RBCC/TRIM motif . Oncogene.
2001; ; 20 : :7223.–7233. 8.
Ishov
AM
,
Sotnikov
AG
,
Negorev
D
, et al.
PML is critical for ND10 formation and recruits the PML-interacting protein daxx to this nuclear structure when modified by SUMO-1 . J Cell Biol.
1999; ; 147 : :221.–234. 9.
Bernardi
R
,
Papa
A
,
Pandolfi
PP
. Regulation of apoptosis by PML and the PML-NBs . Oncogene.
2008; ; 27 : :6299.–6312. 10.
Krieghoff-Henning
E
,
Hofmann
TG
. Role of nuclear bodies in apoptosis signalling . Biochim Biophys Acta.
2008; ; 1783 : :2185.–2194. 11.
Jin
G
,
Wang
YJ
,
Lin
HK.
Emerging cellular functions of cytoplasmic PML . Front Oncol.
2013; ; 3 : :147.. 12.
Martin
N
,
Dejean
A
,
Bischof
O
. TBX2, un nouvel acteur dans la sénescence cellulaire induite par PML . Med Sci (Paris).
2012; ; 28 : :248.–250. 13.
Chelbi-Alix
MK
,
Quignon
F
,
Pelicano
L
, et al.
Resistance to virus infection conferred by the interferon-induced promyelocytic leukemia protein . J Virol.
1998; ; 72 : :1043.–1051. 14.
Regad
T
,
Saib
A
,
Lallemand-Breitenbach
V
, et al.
PML mediates the interferon-induced antiviral state against a complex retrovirus via its association with the viral transactivator . EMBO J.
2001; ; 20 : :3495.–3505. 15.
Pampin
M
,
Simonin
Y
,
Blondel
B
, et al.
Cross talk between PML and p53 during poliovirus infection: implications for antiviral defense . J Virol.
2006; ; 80 : :8582.–8592. 16.
Blondel
D
,
Kheddache
S
,
Lahaye
X
, et al.
Resistance to rabies virus infection conferred by the PMLIV isoform . J Virol.
2010; ; 84 : :10719.–10726. 17.
Maroui
MA
,
Pampin
M
,
Chelbi-Alix
MK
. Promyelocytic leukemia isoform IV confers resistance to encephalomyocarditis virus via the sequestration of 3D polymerase in nuclear bodies . J Virol.
2011; ; 85 : :13164.–13173. 18.
El Asmi
F
,
Maroui
MA
,
Dutrieux
J
, et al.
Implication of PMLIV in both intrinsic and innate immunity . PLoS Pathog.
2014; ; 10 : :e1003975.. 19.
Regad
T
,
Chelbi-Alix
MK
. Role and fate of PML nuclear bodies in response to interferon and viral infections . Oncogene.
2001; ; 20 : :7274.–7286. 20.
Everett
RD
,
Chelbi-Alix
MK
. PML and PML nuclear bodies: implications in antiviral defence . Biochimie.
2007; ; 89 : :819.–830. 21.
Geoffroy
MC
,
Chelbi-Alix
MK
. Role of promyelocytic leukemia protein in host antiviral defense . J Interferon Cytokine Res.
2011; ; 31 : :145.–158. 22.
Chelbi-Alix
MK
,
Wietzerbin
J
. Interferon, a growing cytokine family: 50 years of interferon research . Biochimie.
2007; ; 89 : :713.–718. 23.
Chelbi-Alix
MK
,
Pelicano
L
,
Quignon
F
, et al.
Induction of the PML protein by interferons in normal and APL cells . Leukemia.
1995; ; 9 : :2027.–2033. 24.
Stadler
M
,
Chelbi-Alix
MK
,
Koken
MH
, et al.
Transcriptional induction of the PML growth suppressor gene by interferons is mediated through an ISRE and a GAS element . Oncogene.
1995; ; 11 : :2565.–2573. 25.
El Bougrini
J
,
Dianoux
L
,
Chelbi-Alix
MK
. PML positively regulates interferon gamma signaling . Biochimie.
2011; ; 93 : :389.–398. 26.
Bonilla
WV
,
Pinschewer
DD
,
Klenerman
P
, et al.
Effects of promyelocytic leukemia protein on virus-host balance . J Virol.
2002; ; 76 : :3810.–3818. 27.
McNally
BA
,
Trgovcich
J
,
Maul GG
A
, et al.
role for cytoplasmic PML in cellular resistance to viral infection . PloS one.
2008; ; 3 : :e2277.. 28.
Reichelt
M
,
Wang
L
,
Sommer
M
, et al.
Entrapment of viral capsids in nuclear PML cages is an intrinsic antiviral host defense against varicella-zoster virus . PLoS Pathog.
2011; ; 7 : :e1001266.. 29.
Cuchet
D
,
Sykes
A
,
Nicolas
A
, et al.
PML isoforms I and II participate in PML-dependent restriction of HSV-1 replication . J Cell Sci.
2011; ; 124 : :280.–291. 30.
Mitchell
AM
,
Hirsch
ML
,
Li
C
,
Samulski
RJ
. Promyelocytic leukemia protein is a cell-intrinsic factor inhibiting parvovirus DNA replication . J Virol.
2014; ; 88 : :925.–936. 31.
Aminev
AG
,
Amineva
SP
,
Palmenberg
AC
. Encephalomyocarditis virus (EMCV) proteins 2A and 3BCD localize to nuclei and inhibit cellular mRNA transcription but not rRNA transcription . Virus Res.
2003; ; 95 : :59.–73. 32.
El Mchichi
B
,
Regad
T
,
Maroui
MA
, et al.
SUMOylation promotes PML degradation during encephalomyocarditis virus infection . J Virol.
2010; ; 84 : :11634.–11645. 33.
Kyratsous
CA
,
Silverstein
SJ
. Components of nuclear domain 10 bodies regulate varicella-zoster virus replication . J Virol.
2009; ; 83 : :4262.–4274. 34.
Yaffe
MB
,
Schutkowski
M
,
Shen
M
, et al.
Sequence-specific and phosphorylation-dependent proline isomerization: a potential mitotic regulatory mechanism . Science.
1997; ; 278 : :1957.–1960. 35.
Liou
YC
,
Zhou
XZ
,
Lu
KP
. Prolyl isomerase Pin1 as a molecular switch to determine the fate of phosphoproteins . Trends Biochem Sci.
2011; ; 36 : :501.–514. 36.
Saitoh
T
,
Tun-Kyi
A
,
Ryo
A
, et al.
Negative regulation of interferon-regulatory factor 3-dependent innate antiviral response by the prolyl isomerase Pin1 . Nat Immunol.
2006; ; 7 : :598.–605. 37.
Yang
K
,
Shi
HX
,
Liu
XY
, et al.
TRIM21 is essential to sustain IFN regulatory factor 3 activation during antiviral response . J Immunol.
2009; ; 182 : :3782.–3792. 38.
Imler
JL
,
Ferrandon
D
. Le printemps de l’immunité innée couronné à Stockholm . Med Sci (Paris).
2001; ; 27 : :1019.–1024. 39.
Jemilloux
Y
,
Henry
T
. Les inflammasomes. Plates-formes de l’immunité innée . Med Sci (Paris).
2013; ; 29 : :975.–984. 40.
Marsolier
J
,
Weitzman
JB
. Pin1 : une peptidyl prolyl cis-trans isomérase multifonctionnelle et une cible anticancéreuse prometteuse . Med Sci (Paris).
2014; ; 30 : :772.–778. |






