| |
| Med Sci (Paris). 2014 October; 30(10): 845–848. Published online 2014 October 14. doi: 10.1051/medsci/20143010009.Production de rétines in vitro à partir de cellules pluripotentes humaines Un nouvel outil thérapeutique Sacha Reichman,1* José-Alain Sahel,1** and Olivier Goureau1*** 1Institut de la vision, Inserm U968 ; Sorbonne Universités, UPMC-Paris6, UMR_S968 ; CNRS, UMR7210, 75012Paris, France MeSH keywords: Techniques de culture cellulaire, méthodes, Thérapie cellulaire et tissulaire, tendances, Cellules cultivées, Humains, Cellules souches pluripotentes, cytologie, physiologie, Rétine, transplantation , Ingénierie tissulaire |
La rétine, tissu sensoriel qui tapisse le fond de l’œil, est composée d’une monocouche de cellules épithéliales (épithélium pigmentaire rétinien, EPR) et de la neurorétine, qui comprend six types majeurs de neurones organisés de façon stratifiée. Cette dernière permet la conversion du signal lumineux en signal électrique par les photorécepteurs, et le message est transmis jusqu’aux cellules ganglionnaires dont les axones se regroupent pour former le nerf optique qui achemine l’information vers le cerveau. La cécité consécutive aux maladies dégénératives de la rétine, telles que les rétinopathies diabétiques ou héréditaires, la dégénérescence maculaire liée à l’âge (DMLA) et le glaucome, se caractérise principalement par une perte progressive des photorécepteurs, de l’EPR ou des cellules ganglionnaires. Si les techniques de diagnostic ont permis d’améliorer considérablement la classification de ces maladies, l’arsenal thérapeutique est toujours très insuffisant. Des approches alternatives aux traitements pharmacologiques classiques voient le jour telles que les thérapies génique, cellulaire ou prothétique, et restaurer une fonction visuelle perdue apparaît comme un des défis majeurs de la médecine actuelle. Dans ce contexte, la thérapie cellulaire constitue une des approches les plus prometteuses [
1]. Les cellules souches pluripotentes humaines, telles que les cellules souches embryonnaires ou les cellules pluripotentes induites (cellules iPS, induced pluripotent stem cells), capables de proliférer indéfiniment en culture tout en gardant leur capacité de différenciation, représentent une ressource potentiellement illimitée de cellules rétiniennes pour la transplantation [
8]. Un ensemble de travaux récents rapportent la production de photorécepteurs et des cellules de l’EPR à partir de cellules iPS humaines [
2,
3]. Cependant, ces méthodes apparaissent peu compatibles avec une large production de cellules d’intérêt thérapeutique. Leur faible efficacité, leur complexité, l’utilisation de composés exogènes et un temps de culture très long en sont les principales limites. |
Construction de rétines in vitro à partir de cellules souches pluripotentes Dans ce contexte, notre équipe à l’Institut de la vision, en collaboration avec une équipe d’ISTEM (Évry, France), vient de publier un protocole de différenciation en neurorétine simple, efficace et évolutif, adaptable aux normes requises pour une application de thérapie cellulaire [
4]. Nous avons démontré que la culture de cellules iPS humaines à confluence dans un milieu pro-neural sans sérum est suffisante pour générer des structures de neurorétine et des cellules de l’EPR en moins de trois semaines (Figure 1A-B). Ce procédé évite les étapes de formation et de sélection de corps embryonnaires (agrégats de cellules souches et de progéniteurs des trois feuillets germinaux se formant lors de l’induction de la phase initiale de la différenciation de cellules souches pluripotentes), l’addition de molécules d’induction et/ou de substrat tel que le Matrigel (un substrat de type matrice extracellulaire). Cette efficacité est due en partie à l’augmentation de la production endogène par les cellules iPS confluentes de DKK1 (Dickkopf-1) et NOGGIN, deux inhibiteurs des voies de signalisation WNT et BMP (bone morphogenetic protein)/TGFβ (transforming growth factor). Or, l’inhibition de ces deux voies est primordiale chez l’embryon pour la différenciation du neuroectoderme et la spécification de la rétine [
5]. Ces rétines in vitro obtenues au bout de 14 jours présentent un phénotype de vésicule optique similaire à ce qui est observé au cours du développement embryonnaire, ce que confirme le profil d’expression de facteurs de transcription spécifiques tels que PAX6, RAX, VSX2 (visual system homeobox 2) et MITF (microphthalmia-associated transcription factor). À partir de ce stade, la mise en culture en suspension de ces rétines in vitro permet la différenciation des progéniteurs rétiniens qu’elles contiennent en tous les types cellulaires de la rétine, d’une manière séquentielle conforme à la rétinogenèse naturelle. En termes de cinétique, les cellules ganglionnaires, amacrines (cellules assurant des liaisons horizontales, dont les dendrites sont connectés aux cellules bipolaires et ganglionnaires) et horizontales sont détectées entre 20 et 35 jours et les précurseurs des photorécepteurs autour de 30 à 40 jours. Les photorécepteurs plus matures, exprimant les pigments visuels opsine (cônes) ou rhodopsine (bâtonnets), sont identifiés après 75 à 80 jours de culture, en même temps que les cellules gliales de Müller et les cellules bipolaires [4].
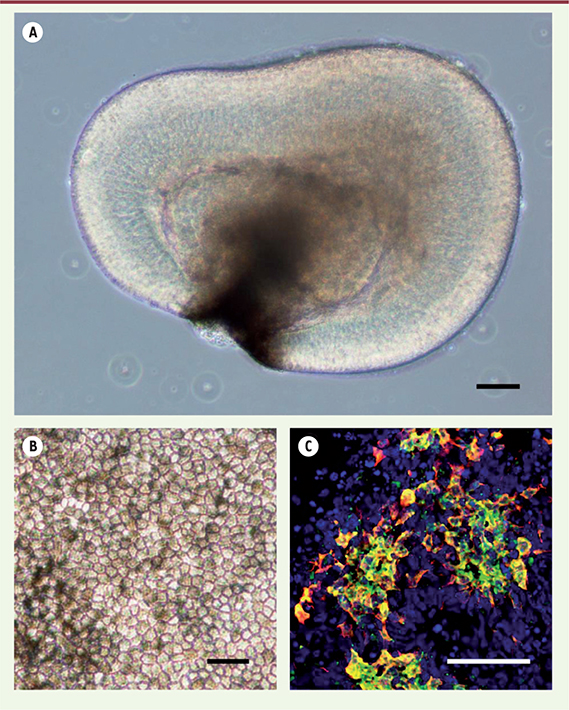
 | Figure 1.
Génération de cellules rétiniennes à partir de cellules iPS humaines. A. Rétine in vitro en suspension après 16 jours de culture. B. Cellules de l’épithélium pigmentaire rétinien et C. précurseurs de photorécepteurs exprimant la Recoverine (rouge) et l’antigène de surface CD73 (vert) après 42 jours de culture. Échelle = 50 μm |
Dans la perspective d’une application en thérapie cellulaire ciblant les photorécepteurs, le stade de maturation de ces cellules est un paramètre crucial puisqu’il est établi que seuls les précurseurs des photorécepteurs sont capables de s’intégrer et de se différencier en neurones fonctionnels [1]. Dans ce contexte, nous avons mis en évidence que l’inhibition de la voie Notch, une fois les progéniteurs rétiniens engagés dans le lignage des photorécepteurs, augmente la proportion de précurseurs de photorécepteurs dans les rétines in vitro, en forçant les progéniteurs rétiniens à quitter précocement le cycle de division cellulaire [4]. Ces précurseurs produits à l’aide de notre protocole expriment spécifiquement l’antigène de surface CD73 (Figure 1C). La purification de cette population CD73+, la plus prometteuse dans une perspective de transplantation, permettra d’exclure le risque que représenterait la présence dans un mélange de cellules mal défini, de quelques cellules pluripotentes résiduelles capables de former des tératomes [
6]. La capacité des précurseurs des photorécepteurs purifiés à former de nouveaux photorécepteurs fonctionnels après leur transplantation sous rétinienne constitue désormais notre prochain défi. |
Rétines in vitro : source de multiples précurseurs pour une application en thérapie cellulaire Notre protocole permet également la production rapide de nombreuses cellules ganglionnaires au sein des rétines in vitro. Si ces cellules présentent un intérêt indéniable pour le traitement du glaucome, l’un des défis majeurs et spécifiques à ce type cellulaire sera le rétablissement de leurs connexions avec le cerveau. Outre les neurones rétiniens, le procédé que nous avons mis au point permet également la génération de cellules de l’EPR (Figure 1B). Ces cellules peuvent être facilement amplifiées tout en conservant leur phénotype correspondant à leur état in vivo. La création rapide de banques de cellules de l’EPR destinées au traitement futur de la DMLA et d’autres maladies liées à l’EPR est donc tout à fait envisageable. Notons qu’à ce jour, le seul essai clinique autorisé utilisant les cellules iPS concerne la transplantation de cellules de l’EPR chez des patients atteints de DMLA au Japon [
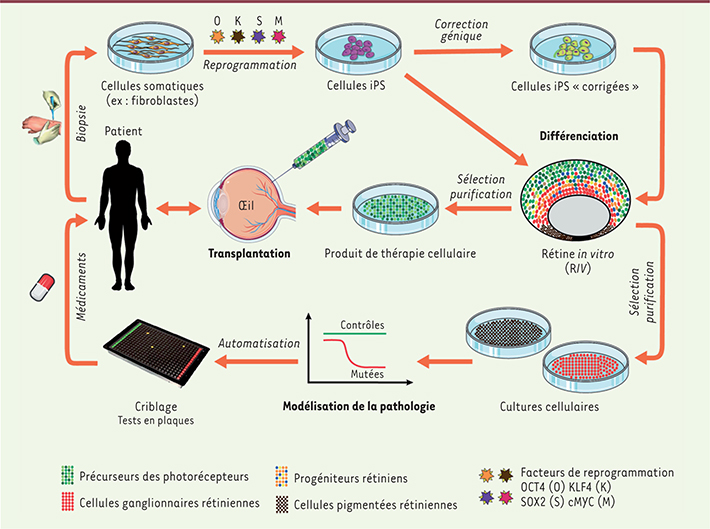
7]. Outre son potentiel prometteur en médecine régénérative, la génération de ces différents types cellulaires rétiniens offre également l’opportunité d’étudier les mécanismes moléculaires et cellulaires impliqués dans le développement de la rétine humaine (Figure 2). Elle offre aussi de nouvelles perspectives pour avancer dans la compréhension des processus physiopathologiques qui sous-tendent les maladies dégénératives de la rétine. Ceci via la modélisation des pathologies in vitro à partir de rétines in vitro et/ou de cellules de l’EPR issues de cellules iPS de patients porteurs de mutations (Figure 2). Ces modèles en cours de développement à l’Institut de la vision pourront être utilisés pour tester l’efficacité de nombreuses molécules à visée thérapeutique par criblage à haut débit et participer ainsi au développement de nouveaux traitements pharmacologiques.
 | Figure 2.
Schéma résumant les applications cliniques potentielles de cellules rétiniennes dérivées de cellules iPS humaines.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Pearson
RA
. Advances in repairing the degenerate retina by rod photoreceptor transplantation . Biotechnol Adv.
2014; ; 32 : :485.–491. 2.
Borooah
S
,
Phillips
MJ
,
Bilican
B
, et al.
Using human induced pluripotent stem cells to treat retinal disease . Prog Retin Eye Res.
2013; ; 37 : :163.–181. 3.
Rowland
TJ
Buchholz
DE
,
Clegg
DO
. Pluripotent human stem cells for the treatment of retinal disease . J Cell Physiol.
2012; ; 227 : :457.–466. 4.
Reichman
S
,
Terray
A
,
Slembrouck
A
, et al.
From confluent human iPS cells to self-forming neural retina and retinal pigmented epithelium . Proc Natl Acad Sci USA.
2014; ; 111 : :8518.–8523. 5.
Fuhrmann
S
. Eye morphogenesis and patterning of the optic vesicle . Curr Top Dev Biol.
2010; ; 93 : :61.–84. 6.
Cui
L
,
Guan
Y
,
Qu
Z
et al.
WNT signaling determines tumorigenicity and function of ESC-derived retinal progenitors . J Clin Invest.
2013; ; 4 : :1647.–1661. 7.
Bharti
K
,
Rao
M
,
Hull
SC
, et al.
Developing cellular therapies for retinal degenerative diseases . Invest Ophthalmol Vis Sci.
2014; ; 2 : :1191.–1202. 8.
Peron
M
. La révolution 3D des cellules souches : fabrication d’une rétine in vitro
. Med Sci (Paris).
2011; ; 27 : :709.–712. |