| |
| Med Sci (Paris). 2014 October; 30(10): 848–850. Published online 2014 October 14. doi: 10.1051/medsci/20143010010.Cartographier la concentration intracellulaire d’espèces oxygénées réactives Cédric Bouzigues1* and Antigoni Alexandrou1 1Laboratoire optique et biosciences, CNRS UMR7645, Inserm U696, École polytechnique, route de Saclay, 91128Palaiseau, France MeSH keywords: Diagnostic par imagerie, méthodes, Humains, Peroxyde d'hydrogène, analyse, métabolisme, Espace intracellulaire, Voies et réseaux métaboliques, Nanoparticules, Espèces réactives de l'oxygène, Répartition dans les tissus |
L’organisation dans le temps et l’espace des voies de signalisation est un élément essentiel dans le façonnage de la réponse cellulaire [
1]. Ceci est vrai notamment dans les processus chimiotactiques, où l’apparition d’une organisation intracellulaire asymétrique est physiologiquement indispensable. Dans ce contexte, la signalisation par les espèces oxygénées réactives, ou ROS, est singulière. En effet, ces molécules, comme le peroxyde d’hydrogène H2O2, sont connues principalement pour leur activité bactéricide et les dommages induits par le stress oxydant. Elles jouent cependant en parallèle un rôle essentiel dans plusieurs voies de signalisation physiologiques [
2,
3] contrôlant des réponses variées – contraction, prolifération, migration – dans de nombreux tissus (systèmes nerveux, hépatique, vasculaire, etc.). L’homéostasie locale des ROS est donc un processus vital dans la vie cellulaire pour préserver l’action physiologique sans effet nuisible [
4]. |
Comment détecter les ROS ? L’étude de ces questions dépend de la capacité à détecter des ROS dans des cellules vivantes de façon quantitative, dynamique et localisée. Cependant, les méthodes usuelles ne répondent pas à ces besoins. En effet, l’imagerie de ROS se fait le plus couramment par l’utilisation de la dichlorohydrofluorescéine (DCF), dont l’oxydation irréversible induit une émission de fluorescence. L’irréversibilité de ce processus et la diffusion rapide empêchent toute détection quantitative et résolue dans le temps et l’espace. La DCF permet ainsi uniquement d’identifier des voies de signalisation impliquant la production de ROS, mais pas de suivre une réponse cellulaire. Plus récemment, des protéines sensibles au peroxyde d’hydrogène, dont l’oxydation est réversible, ont été exploitées [
5]. Cependant, leur gamme de détection de H2O2 limitée (< 500 nM) et leur diffusion dans le cytosol rendent difficile une mesure locale et/ou quantitative. En ce cas, comment comparer des voies de signalisation ? Comment observer un profil intracellulaire de concentration de ROS ? Nous avons proposé l’utilisation de nanoparticules luminescentes à base de terres rares YVO4:Eu pour la détection de ROS dans des cellules vivantes [
6] et, dans un travail récemment publié dans Chemistry and Biology, nous avons démontré son efficacité pour suivre localement le H2O2 intracellulaire [
7]. Nous avons appliqué cette méthode aux voies de signalisation du facteur de croissance dérivé des plaquettes (PDGF), qui est impliqué dans le contrôle de la migration de cellules vasculaires [
8] ou de certaines cellules tumorales [
9]. |
Utilisation de nanoparticules à base de terres rares pour la détection de H 2O 2
Les nanoparticules de vanadate d’Yttrium YVO4 peuvent être rendues luminescentes par le dopage par des ions Europium (III) qui absorbent à 466 nm et émettent à 617 nm [
10]. Sous un microscope à épifluorescence équipé d’un système de détection sensible, ces particules peuvent être observées individuellement. Au contraire des fluorophores organiques ordinaires, elles ne sont pas dégradées après leur excitation. Leur illumination par une forte intensité lumineuse induit un déclin de leur luminescence, provoqué par la réduction des ions Eu3+ en Eu2+. Nous avons alors montré que la luminescence était restaurée par un oxydant fort, comme H2O2
(Figure 1).
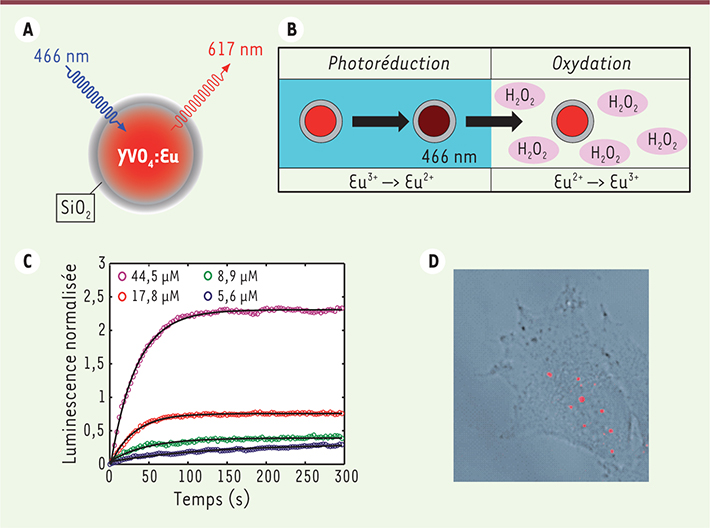
 | Figure 1.
Principe de la détection d’oxydants par des nanoparticules de vanadate d’yttrium. A. Nanoparticule de YVO4:Eu recouverte par une enveloppe de silice, luminescente à 617 nm sous excitation à 466 nm. B. Principe de la détection d’oxydants : (1) photoréduction sous illumination avec perte de luminescence ; (2) réoxydation induisant le retour de luminescence. C. Retour de luminescence suite à une photoréduction préalable, pour différentes concentration en H2O2.
D. Nanoparticules individuelles internalisées dans une cellule HeLa. |
Le niveau de luminescence obtenu dépend quantitativement de la concentration d’oxydants dans le milieu, et cet effet est réversible. L’analyse précise de la cinétique de réoxydation de nanoparticules individuelles permet d’établir une correspondance univoque entre le signal de luminescence et la concentration en oxydants. Nous avons ainsi démontré la possibilité de mesurer des concentrations d’H2O2 comprises entre 1 et 50 µM avec une précision typique de 0,1 µM et une résolution temporelle de l’ordre de 30 s (Figure 1). Le caractère local de la mesure est lié à la précision de pointé d’une nanoparticule individuelle, de l’ordre de ~30 nm pour nos conditions d’imagerie. Ces nanoparticules peuvent alors être internalisées par pinocytose dans le cytosol de cellules vivantes et photoréduites in situ pour suivre la réponse cellulaire (Figure 1). |
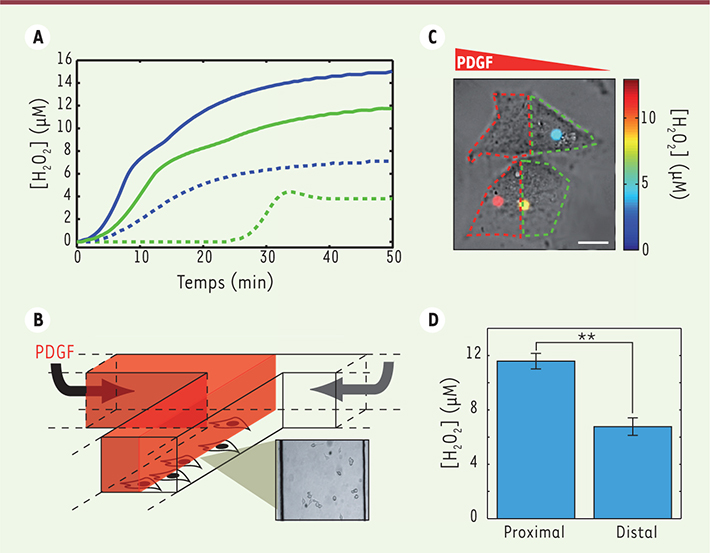
Dynamique de production des ROS Nous avons tout d’abord utilisé ces nanoparticules dans des cellules musculaires lisses vasculaires (CMLV) soumises à une concentration saturante de PDGF, et dans lesquelles nous avons suivi l’évolution de la luminescence de nanoparticules individuelles. Celle-ci indique la concentration cytosolique de H2O2 et est, dans ce cas, identique pour les nanoparticules d’une même cellule. Outre la première mesure quantitative d’une concentration intracellulaire de ROS, nous avons révélé que la production de ROS ne se déclenche qu’après un délai de plusieurs minutes, probablement dû à la dimérisation, limitée par la diffusion dans la membrane, des récepteurs du PDGF, préalable à leur activation (Figure 2). Nous avons alors mis en évidence le rôle de la transactivation des récepteurs EGFR (epidermal growth factor receptor) (Figure 2) dans le contrôle de cette cinétique, l’inhibition de leur activité ralentissant la production de ROS de façon importante. Le caractère quantitatif de nos mesures permet de comparer ce système à des cellules tumorales (HeLa). La réponse oxydante de ces dernières présente les mêmes motifs que celle des CMLV, mais implique des concentrations plus élevées avec une dynamique sensiblement plus rapide (Figure 2). Cette propriété peut être une indication de la moins grande robustesse des cellules tumorales dans le contrôle de leur migration, ce qui pourrait avoir un impact thérapeutique majeur.
 | Figure 2.
Mesure de la production des ROS. A. Evolution de la concentration d’H2O2 en présence d’une stimulation par le PDGF avec (vert) ou sans (bleu) inhibition des récepteurs EGFR (epidermal growth factor) dans des CMLV (trait pointillé) et dans des cellules HeLa (trait plein). B. Dispositif microfluidique permettant la création d’un gradient de PDGF. C. Nanoparticules internalisées dans des cellules HeLa soumises à un gradient de PDGF orienté de la droite vers la gauche. La couleur indique la concentration d’H2O2 détectée à la position de la nanoparticule. D. Concentration moyenne d’H2O2 dans la partie proximale et la partie distale (moitié de la cellule soumise respectivement aux plus fortes et aux plus faibles concentrations de PDGF) de cellules HeLa. |
L’ensemble de ces mesures démontrent l’intérêt de notre méthode, d’une part, pour disséquer quantitativement des voies de signalisation complexes, et, d’autre part, pour révéler la dynamique de processus cellulaires susceptibles d’avoir un impact physiologique. |
Organisation intracellulaire spatiale Le chimiotactisme en réponse au PDGF est encore peu documenté au niveau mécanistique. L’existence même de gradients intracellulaires de ROS n’avait jamais été démontrée. En visualisant des nanoparticules individuelles dans le cytosol, nous mesurons la concentration locale de H2O2 afin de détecter d’éventuelles inhomogénéités. Nous avons alors eu recours à des dispositifs microfluidiques afin de contrôler spatialement la stimulation appliquée. En plaçant une cellule sur l’axe d’un microsystème en T à deux entrées – respectivement PGDF et milieu de culture — il est possible de lui appliquer un gradient de PDGF avec une stimulation maximale à une de ses extrémités et presque nulle à l’autre (Figure 2). Nous avons alors révélé l’existence d’un profil de concentration asymétrique persistant de H2O2 induit par une stimulation par un gradient de PDGF (Figure 2), en dépit de la faible taille des molécules de peroxyde d’hydrogène, qui laisserait supposer une homogénéisation rapide par diffusion dans le cytosol. Notre méthode permet ainsi de révéler l’existence de mécanismes encore inconnus, reposant soit sur une régulation positive de l’activité de dégradation des ROS, soit sur une diffusion effective ralentie par des interactions des ROS dans le cytosol, permettant le maintien d’un profil asymétrique de messagers secondaires et d’une migration dirigée. |
La technique que nous avons introduite et utilisée pour l’étude la signalisation par le PDGF est applicable à de nombreux systèmes. Sa capacité à mesurer avec précision la production de ROS en fait un outil de choix pour sonder des voies de signalisation complexes où des signaux extérieurs multiples façonnent la réponse cellulaire. L’identification de mécanismes critiques déclencheurs de pathologies peut ainsi être à terme une de ses principales applications. L’imagerie de nanoparticules pourra également se concevoir in vivo, au prix d’un effort instrumental substantiel mais accessible, afin d’observer la dynamique de processus pathologiques impliquant des espèces oxydantes, que ce soit des réactions inflammatoires ou la progression de certaines tumeurs. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Kinkhabwala
A
,
Bastiaens
PI
. Spatial aspects of intracellular information processing . Curr Opin Genet Dev.
2010; ; 20 : :31.–40. 2.
D’Autréaux
B
,
Toledano
MB
. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis . Nat Rev Mol Cell Biol.
2007; ; 8 : :813.–824. 3.
Bedard
K
,
Krause
KH
. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology . Physiol Rev.
2007; ; 87 : :245.–313. 4.
Rhee
SG
. H2O2, a necessary evil for cell signaling . Science.
2006; ; 312 : :1882.–1883. 5.
Belousov
VV
,
Fradkov
AF
,
Lukyanov
KA
, et al.
Genetically encoded fluorescent indicator for intracellular hydrogen peroxide . Nat Methods.
2008; ; 3 : :281.–286. 6.
Casanova
D
,
Bouzigues
C
,
Nguyên
TL
, et al.
Single europium-doped nanoparticles measure temporal pattern of reactive oxygen species production inside cells . Nat Nanotech.
2009; ; 4 : :581.–585. 7.
Bouzigues
C
,
Nguyên
TL
,
Ramodiharilafy
R
, et al.
Regulation of the ROS response dynamics and organization to PDGF motile stimuli revealed by single nanoparticle imaging . Chem Biol.
2014; ; 21 : :647.–656. 8.
Grotendorst
GR
,
Chang
T
,
Seppä
HE
, et al.
Platelet-derived growth factor is a chemoattractant for vascular smooth muscle cells . J Cell Physiol.
1982; ; 113 : :261.–266. 9.
Andrae
J
,
Gallini
R
,
Betsholtz
C
. Role of platelet-derived growth factors in physiology and medicine . Genes Dev.
2008; ; 22 : :1276.–1312. 10.
Huignard
A
,
Gacoin
T
,
Boilot
JP
. Synthesis and luminescence properties of colloidal YVO4:Eu phosphors . Chem Mat.
2000; ; 12 : :1090.–1094. |