| |
| Med Sci (Paris). 2014 November; 30(11): 1011–1023. Published online 2014 November 10. doi: 10.1051/medsci/20143011016.Complexité génétique des ciliopathies et identification de nouveaux gènes Ruxandra Bachmann-Gagescu1* 1Institut moléculaire des sciences de la vie, Institut de médecine génétique, université de Zurich, Winterthurerstrasse 190, 8057Zurich, Suisse |
Les ciliopathies regroupent des maladies causées par le dysfonctionnement des cils primaires, petits organites impliqués dans la transmission de signaux à la surface de quasiment toute cellule différenciée, ou des cils mobiles, dont le rôle est de générer un mouvement de fluide [32, 33] (→).
(→) Voir les Synthèses de C. Fort et P. Bastin ; et de C. Laclef, pages 955 et 980 de ce numéro
Par définition, ce regroupement récent en « ciliopathies », né il y une décennie [1], se fonde sur la physiopathologie sous-jacente. Depuis, un nombre croissant de pathologies, qui étaient reconnues cliniquement depuis longtemps, s’intègrent progressivement dans ce groupe des ciliopathies au fur et à mesure de la découverte de leurs causes génétiques, dès lors que le gène en cause code pour une protéine impliquée dans la fonction ou la structure ciliaires. Alors que l’incidence de chacun de ces syndromes est faible, prises dans leur ensemble, les ciliopathies représentent des maladies génétiques relativement fréquentes. Des exemples classiques de ciliopathies sont les syndromes de Bardet-Biedl (BBS) (OMIM 209900), de Joubert (OMIM 213300), de Meckel-Gruber (OMIM 249000), de Jeune (OMIM 208500), d’Alstrøm (OMIM 203800), l’amaurose congénitale de Leber (OMIM 204000), la néphronophtise (OMIM 256100), la maladie polykystique rénale autosomique dominante (OMIM 173900) ou le syndrome de Kartagener (OMIM 244400). Toutefois, au-delà de cette définition physiopathologique, l’important chevauchement phénotypique et génétique entre les divers syndromes explique que leurs frontières soient floues, et justifie leur regroupement en une entité commune [1]. Dans cet article, nous proposons une revue des principales ciliopathies et de leurs aspects caractéristiques, et discutons les méthodes couramment employées pour parvenir à l’identification des gènes impliqués, condition nécessaire pour offrir aux patients un diagnostic et un pronostic fiables, diriger la prise en charge clinique et développer des thérapies spécifiques. |
Les cils primaires ont de nombreuses fonctions spécifiques dépendant du type de cellule sur laquelle ils se trouvent, mais leur rôle général est de concentrer et réguler les récepteurs, canaux transmembranaires et autres molécules essentielles à la transmission de signaux vers l’intérieur de la cellule. Ces signaux peuvent être sensoriels (signal lumineux dans la rétine) [2], mécanochimiques (comme dans les tubules rénaux) [3], ou encore des signaux biologiques des voies de signalisation (signalisation de la voie Sonic hedgehog [Shh]) [4]. Malgré cette importante diversité fonctionnelle, la structure de base des cils primaires, illustrée dans la
Figure 1
, est étonnamment homogène : l’axonème, formé de neuf paires de microtubules, en constitue l’axe, qui est ancré dans la cellule par le corps basal, un centriole modifié. Juste au-dessus du corps basal se trouve la zone de transition (ZT), qui est ancrée à la membrane plasmique par les fibres de transition, et qui joue un rôle important dans le tri des constituants admis ou non dans le compartiment ciliaire [5, 32] (→).
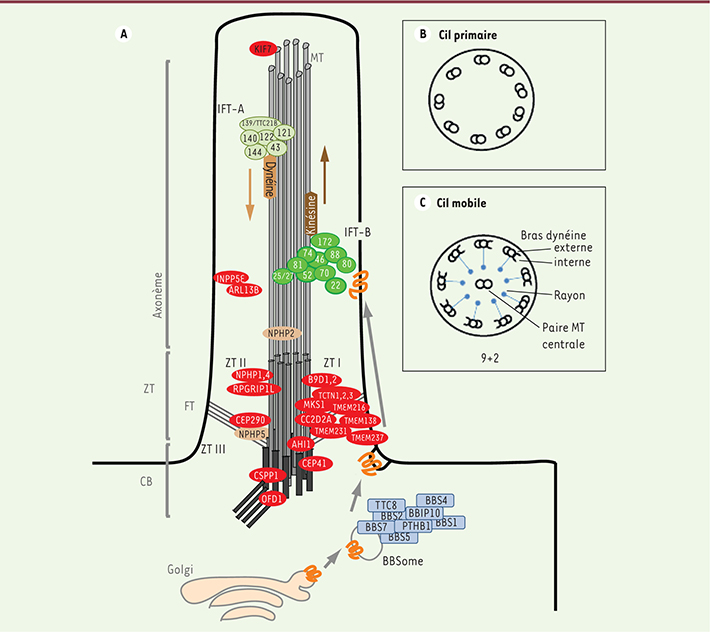
 | Figure 1.
Représentation schématique du cil primaire. A. Les protéines ciliaires membranaires (récepteurs, canaux, etc.) sont transportées dans des vésicules vers la base du cil où celles-ci fusionnent et délivrent leur cargo dans la membrane ciliaire. Ce trafic est partiellement contrôlé par un complexe multiprotéique (BBSome en bleu) composé de huit protéines dont le dysfonctionnement cause le syndrome de Bardet-Biedl (BBS). Les protéines ciliaires sont ensuite triées dans la zone de transition, région où sont localisées et associées en complexes multiprotéiques (en rouge) la plupart des protéines associées aux syndromes de Joubert et de Meckel. À l’intérieur du cil, des trains composés d’autres complexes multiprotéiques effectuent le transport intraflagellaire dans le sens antérograde (IFT-B, en vert foncé) et dans le sens rétrograde (IFT-A, en vert clair). B. Coupe transversale d’un cil primaire montrant la structure de base de l’axonème en neuf doublets de microtubules (configuration 9+0). C. Coupe transversale d’un cil mobile. Noter la paire de microtubules centrale additionnelle (configuration 9+2), ainsi que les bras de dynéine externe et interne et les rayons. CB : corps basal ; FT : fibres de transition ; IFT : transport intraflagellaire ; MT : microtubules ; ZT : zone de transition ; ZT I : complexe I de la zone de transition ; ZT II : complexe II de la zone de transition ; ZT III : complexe III de la zone de transition. |
(→) Voir la Synthèse de C. Fort et P. Bastin, page 955 de ce numéro
Le mouvement des composants à l’intérieur du cil se fait sous la forme de « trains » composés de complexes multiprotéiques se déplaçant le long de l’axonème. Ce transport appelé intraflagellaire (IFT) est effectué dans le sens antérograde (vers la pointe du cil) grâce à un premier complexe (IFT B ; moteur kinésine), et dans le sens rétrograde (de la pointe vers la base du cil) grâce à un second complexe (IFT A ; moteur dynéine) [6, 32]. L’axonème est couvert par une membrane qui est en continuité avec la membrane plasmique, mais dont le contenu autant phospholipidique que protéique est différent du contenu de celle-ci, en accord avec la fonction de régulation des signaux de cet organite. Les cils primaires sont généralement situés sur la membrane apicale des cellules polarisées, et ils sont pour la plupart immobiles1 et uniques sur une cellule donnée. À cela s’opposent les cils mobiles, qui ont une structure très similaire à celle des cils primaires (corps basal, axonème composé de neuf paires de microtubules auxquels s’ajoute dans ce cas une paire centrale), mais qui sont souvent multiples sur une cellule donnée et dont le rôle principal est de générer un mouvement de fluide dans la lumière de la cavité que bordent les cellules [34] (→). Ils accomplissent ces mouvements grâce à des éléments supplémentaires, comme les bras de dynéine, présents entre les doublets de microtubules de l’axonème (Figure 1C) [7, 32].
(→) Voir la Synthèse de N. Diguet et S.M. Meilhac, page 996 de ce numéro
|
Phénotypes des ciliopathies Étant donné l’omniprésence des cils primaires et la variété des fonctions spécifiques remplies par ces organites, il n’est pas surprenant que leur dysfonctionnement entraîne des atteintes multisystémiques avec une pléthore de phénotypes différents [8]. Dans les ciliopathies par atteinte des cils mobiles, on peut observer un défaut de latéralité gauche/droite (situs inversus), ainsi que des infections récurrentes des voies respiratoires, témoignant de l’anomalie de battement des cils responsables de la clairance mucociliaire, et des troubles de la fertilité. L’ensemble de ces signes cliniques constituent le syndrome de la dyskinésie ciliaire primitive ou syndrome de Kartagener [9]. Dans les ciliopathies par atteinte du cil primaire, les signes les plus fréquents sont une maladie rénale tubulo-interstitielle ou kystique [36] (→), une dégénérescence rétinienne, une polydactylie, un retard mental avec ou sans malformations cérébrales et une dysplasie osseuse. Le diagnostic clinique d’une ciliopathie particulière reposera sur la présence d’une combinaison donnée de signes cliniques [8]. Ainsi, la présence d’une obésité, d’une rétinite pigmentaire, d’une polydactylie et d’un retard mental orientera vers le diagnostic de syndrome de Bardet-Biedl [10, 35] (→).
(→) Voir la Synthèse de M. Paces-Fessy, page 1024 de ce numéro
(→) Voir la Synthèse de K. Chennen et al., page 1034 de ce numéro
Les ciliopathies les plus étudiées sont énumérées dans le
Tableau I
avec leurs principales présentations cliniques. Notons qu’un important chevauchement phénotypique existe entre les différentes ciliopathies, rendant le diagnostic clinique parfois discutable, comme c’est le cas pour le syndrome de Joubert avec agénésie du corps calleux et polydactylie, et le syndrome acrocalleux [11]. Observons encore qu’une variabilité phénotypique inter- ou intrafamiliale est possible dans les ciliopathies, expliquant dans les cas extrêmes que deux diagnostics cliniques différents soient posés dans une même fratrie [12].
Table 1
| Maladies |
Principaux signes cliniques |
Gènes responsables |
Locus |
Localisation subcellulaire |
Fonction(s) principale(s) décrite(s) pour la protéine |
Ciliopathies impliquant les cils mobiles
|
| Dyskinésie ciliaire primitive |
Situs inversus, infections récurrentes des voies respiratoires, infertilité |
CCDC39 |
CILD14 |
Bras interne dynéine |
Motilité ciliaire |
| CCDC40 |
CILD15 |
Axonème/cytoplasme |
Motilité ciliaire |
| CCDC103 |
CILD17 |
Axonème |
Motilité ciliaire |
| DNAAF1 |
CILD13 |
Bras externe/interne dynéine |
Motilité ciliaire |
| DNAAF2 |
CILD10 |
Cytoplasme apical |
Motilité ciliaire |
| DNAAF3 |
CILD2 |
Bras externe/interne dynéine |
Motilité ciliaire |
| DNAH5 |
CILD3 |
Chaîne lourde dynéine |
Motilité ciliaire |
| DNAH11 |
CILD7 |
Chaîne lourde dynéine |
Motilité ciliaire |
| DNAI1 |
CILD1 |
Chaîne intermédiaire dynéine |
Motilité ciliaire |
| DNAI2 |
CILD9 |
Chaîne intermédiaire dynéine |
Motilité ciliaire |
| DNAL1 |
CILD16 |
Chaîne légère dynéine |
Motilité ciliaire |
| HEATR2 |
CILD18 |
Bras externe dynéine |
Motilité ciliaire |
| HYDIN |
CILD5 |
Paire MT centrale |
Motilité ciliaire |
| LRRC6 |
CILD19 |
Bras externe dynéine |
Motilité ciliaire |
| NME8 |
CILD6 |
Axonème |
Motilité ciliaire |
| RSPH9 |
CILD12 |
Rayon central |
Motilité ciliaire |
| RSPH4A |
CILD11 |
Rayon central |
Motilité ciliaire |
| RSPH1 |
CILD24 |
Rayon central |
Motilité ciliaire |
Ciliopathies impliquant les cils primaires
|
Groupe Joubert/Meckel et maladies associées (zone de transition : tri des protéines ciliaires)
|
| Joubert |
Agénésie vermis cérébelleux ou signe de la dent molaire à l’IRM (MTS), retard de développement psychomoteur, apraxie oculomotrice, trouble du rythme respiratoire, ataxie |
AHI1 |
JBTS3 |
CB/ZT |
Ciliogenèse/trafic vésiculaire |
| Dégénérescence rétinienne, polydactylie, néphronophtise, fibrose hépatique, autres anomalies du SNC |
ARL13B |
JBTS8 |
Compartiment ciliaire |
Complexe INPP5E/signal. SHH, GTPase |
|
B9D1 |
|
Complexe ZT |
Tri protéines ciliaires |
|
?C2CD3 |
|
CB/centrioles |
élongation centriole |
|
C5ORF42 |
JBTS17 |
? |
? |
|
CC2D2A |
JBTS9 |
Complexe ZT |
Tri protéines ciliaires |
|
CEP290 |
JBTS5 |
CB/ZT/péricentriolaire |
Régulation trafic vésiculaire |
|
CEP41 |
JBTS15 |
CB/compartiment ciliaire |
Polyglutamylation |
|
CSPP1 |
JBTS21 |
CB |
Ciliogenèse/localisation prot. ciliaire |
|
IFT172 |
|
Axonème |
IFT rétrograde (A) |
|
INPP5E |
JBTS1 |
Axonème |
Signalisation phosphatidyl inositol |
|
KIF7 |
JBTS12 |
CB/pointe du cil |
Signalisation SHH |
|
MKS1 |
|
Complexe ZT |
Tri protéines ciliaires |
|
NPHP1 |
JBTS4 |
Complexe ZT |
Tri protéines ciliaires |
|
OFD1 |
JBTS10 |
CB/centrioles |
Régulation centrioles/ciliogenèse |
|
? POC1B |
|
CB/centrioles |
? |
|
PDE6D |
JBTS22 |
?/compartiment ciliaire |
Complexe INPP5E/ARL13B |
|
RPGRIP1L |
JBTS7 |
Complexe ZT |
Tri protéines ciliaires/ciliogenèse |
|
TCTN1 |
JBTS13 |
Complexe ZT |
Tri protéines ciliaires |
|
TCTN2 |
|
Complexe ZT |
Tri protéines ciliaires |
|
TCTN3 |
JBTS18 |
Complexe ZT |
Tri protéines ciliaires |
|
TMEM138 |
JBTS16 |
CB/compartiment ciliaire |
Trafic vésiculaire |
|
TMEM216 |
JBTS2 |
CB/complexe ZT |
Tri protéines ciliaires/trafic vésiculaire |
|
TMEM231 |
JBTS20 |
Complexe ZT |
Tri protéines ciliaires |
|
TMEM237 |
JBTS14 |
Complexe ZT |
Tri protéines ciliaires |
|
TMEM67 |
JBTS6 |
Complexe ZT |
Tri protéines ciliaires |
|
? TTC21B |
JBTS11 |
ZT |
IFT rétrograde (A) = IFT139 |
|
? ZNF423 |
JBTS19 |
Noyau |
Réparation ADN endommagé |
|
| Meckel |
Encéphalocèle, polydactylie, polykystose rénale, malformations de la plaque ductale hépatique |
B9D1 |
MKS9 |
Complexe ZT |
Tri protéines ciliaires |
| B9D2 |
MKS10 |
Complexe ZT |
Tri protéines ciliaires |
| CC2D2A |
MKS6 MKS4 |
Complexe ZT |
Tri protéines ciliaires |
| CEP290 |
MKS1 |
CB/ZT/péricentriolaire |
Régulation trafic vésiculaire |
| MKS1 |
MKS7 |
Complexe ZT |
Tri protéines ciliaires |
| NPHP3 |
MKS5 |
Base du cil |
Module NPHP avec NEK8/INVS |
| RPGRIP1L |
MKS8 |
Complexe ZT |
Tri protéines ciliaires |
| TCTN2 |
MKS2 |
Complexe ZT |
Tri protéines ciliaires |
| TMEM216 |
MKS11 |
Complexe ZT |
Tri protéines ciliaires |
| TMEM231 |
MKS3 |
Complexe ZT |
Tri protéines ciliaires |
| TMEM67 |
|
Complexe ZT |
Tri protéines ciliaires |
|
| Néphronophtise |
Néphropathie |
ANKS6 |
NPHP16 |
Partie basale du cil |
Module NPHP avec NEK8/INVS |
| tubulo-interstitielle progressive |
CEP164 |
NPHP15 |
CB/noyau |
Ciliogenèse/réparation ADN |
|
CEP290 |
NPHP6 |
CB/ZT/péricentriolaire |
Régulation trafic vésiculaire |
|
GLIS2 |
NPHP7 |
Noyau/compartiment ciliaire |
Facteur de transcription anti-fibrose |
|
INVS |
NPHP2 |
Partie basale du cil |
Module NPHP avec NEK8/INVS |
|
IQCB1 |
NPHP5 |
ZT/axonème |
Lie RPGR, complexe calmoduline |
|
NEK8 |
NPHP9 |
Partie basale du cil |
Partie basale de l’axonème |
|
NPHP1 |
NPHP1 |
Complexe ZT |
Tri protéines ciliaires |
|
NPHP3 |
NPHP3 |
Partie basale du cil |
Module NPHP avec NEK8/INVS |
|
NPHP4 |
NPHP4 |
Complexe ZT |
Tri protéines ciliaires |
|
RPGRIP1L |
NPHP8 |
Complexe ZT |
Tri protéines ciliaires |
|
SDCCAG8 |
NPHP10 |
Centrosome |
Lie OFD1 |
|
TMEM67 |
NPHP11 |
Complexe ZT |
Tri protéines ciliaires |
|
TTCB21B |
NPHP12 |
Zone de transition |
IFT rétrograde (A) |
|
WDR19 |
NPHP13 |
Partie basale du cil |
IFT rétrograde (A) |
|
ZNF423 |
NPHP14 |
Noyau |
Réparation ADN endommagé |
|
| Amaurose congénitale |
Cécité ou trouble visuel sévère dès la petite enfance avec extinction de l’électrorétinogramme |
CEP290 |
LCA10 |
CB/ZT/péricentriolaire |
Régulation trafic vésiculaire |
| de Leber |
+ Nombreux autres gènes à fonction indépendante du cil primaire |
IQCB1 |
|
ZT/axonème |
Lie RPGR, complexe calmoduline |
|
|
LCA5 |
LCA5 |
ZT PR/CB/axonème |
Lien avec IFT, complexe multiprotéique |
|
|
RPGRIP1 |
LCA6 |
Complexe ZT |
Triage protéines ciliaires |
|
|
|
|
|
|
|
|
TULP1 |
LCA15 |
ZT/cytoplasme PR |
Trafic rhodopsine |
|
| Syndrome acrocalleux |
Polydactylie, agénésie du corps calleux, dysmorphie faciale
|
KIF7 |
ACLS |
CB/pointe du cil |
Signalisation Shh |
| Senior-Løken |
Trouble visuel (amaurose congénitale), néphronophtise |
CEP290 |
SLSN6 |
CB/ZT/péricentriolaire |
Régulation trafic vésiculaire |
|
IQCB1 |
SLSN5 |
ZT/compartiment ciliaire |
Lie RPGR, complexe calmoduline |
|
NPHP1 |
SLSN1 |
Complexe ZT |
Tri protéines ciliaires |
|
NPHP3 |
SLSN3 |
Partie basale du cil |
Module NPHP avec NEK8/INVS |
|
NPHP4 |
SLSN4 |
Complexe ZT |
Tri protéines ciliaires |
|
SDCCAG8 |
SLSN7 |
Centrosome |
Lie OFD1 |
|
WDR19/IFT144 |
|
Base ciliaire |
IFT rétrograde (A) |
|
| Oro-facio- |
Anomalies buccales/dentaires/fente palatine ou labiale, dysmorphie faciale |
OFD1 |
|
Centrosome/satellites péricentriolaires |
Régulation centrioles/ciliogenèse |
| digital I |
poly/brachydactylie, maladie kystique rénale, malformations SNC |
|
| Oro-facio-digital IV : Mohr-Majewski |
Polydactylie, dysplasie tibiale, dystrophie thoracique, maladie kystique rénale, malformations SNC |
TCTN3 |
|
Complexe ZT |
Tri protéines ciliaires |
Ciliopathies avec obésité/anomalies endocriniennes/génitales (trafic vésiculaire)
|
| Bardet-Biedl |
Dystrophie rétinienne, obésité, polydactylie, retard de développement psychomoteur, hypogonadisme hypogonadotrophique et malformations génitales, anomalies rénales |
ARL6 |
BBS3 |
Compartiment ciliaire |
Protéine G, trafic BBSome et prot. ciliaires |
| BBIP1 |
BBS18 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| BBS1 |
BBS1 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| BBS2 |
BBS2 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| BBS4 |
BBS4 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| BBS5 |
BBS5 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| BBS7 |
BBS7 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| BBS10 |
BBS10 |
CB |
Chaperonine, ciliogenèse |
| BBS12 |
BBS12 |
Centrosome |
Assemblage BBSome, chaperonine |
| WDPCP |
BBS15 |
Centrosome |
Polarité cellulaire planaire |
| CEP290 |
BBS14 |
CB/ZT/péricentriolaire |
Régulation trafic vésiculaire |
| IFT27 |
|
Axonème |
IFT rétrograde (B), protéine G |
| LZTFL1 |
BBS17 |
Cytoplasme/lié au BBsome |
Régule trafic du BBSome |
| MKKS |
BBS6 |
Centrosome |
Trafic intracellulaire, chaperonine |
| MKS1 |
BBS13 |
Complexe ZT |
Triage protéines ciliaires |
| PTHB1 |
BBS9 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| SDCCAG8 |
BBS16 |
Centrosome |
Lie OFD1 |
| TTC8 |
BBS8 |
BBSome |
Trafic vésiculaire des protéines ciliaires |
| TRIM32 |
BBS11 |
Noyau/cytoplasme |
E3 ubiquitine ligase, interaction-GLIS2 |
|
| MORM |
Retard mental, obésité, dystrophie rétinienne, micropénis |
INPP5E |
|
Compartiment ciliaire |
Signalisation phosphatidyl inositol |
|
| McKusick Kauffmann |
Malformations cardiaques, hydrométrocolpos/malformations uro-génitales, polydactylie |
MKKS |
|
Centrosome |
Trafic intracellulaire, chaperonine |
|
| Alström |
Dystrophie rétinienne, obésité, surdité progressive, cardiomyopathie dilatative, résistance à l’insuline, retard de développement psycho-moteur, atteintes rénale, hépatique, pulmonaire |
ALMS1 |
|
CB |
Polarité cellulaire planaire, |
| maintenance ciliaire |
Ciliopathies à composante osseuse prédominante (transport intra-flagellaire)
|
| Jeune |
Dystrophie des côtes avec petit thorax, raccourcissement des os longs, polydactylie, dystrophie rétinienne, atteintes rénale et hépatique progressives |
DYNC2H1 |
SRTD3 |
Axonème |
IFT rétrograde (A) |
| (dysplasie thoracique asphyxiante) |
IFT80 |
SRTD2 |
Axonème |
IFT antérograde (B) |
| |
IFT172 |
SRTD10 |
Axonème |
IFT antérograde (B) |
| |
IFT140 |
SRTD9 |
Axonème |
IFT rétrograde (A) |
| |
TTC21B/ IFT139 |
SRTD4 |
ZT |
IFT rétrograde (A) |
| |
WDR19/IFT144 |
SRTD5 |
Base ciliaire |
IFT rétrograde (A) |
| |
WDR34 |
SRTD11 |
CB |
Interaction dynéine/IFT |
| |
WDR60 |
SRTD8 |
CB |
Ciliogenèse |
|
| Syndromes short-rib-polydactyly |
Polydactylie, raccourcissement sévère des membres et des côtes |
DYNC2H1 |
SRTD3 |
Axonème |
IFT rétrograde (A) |
| SRP I-V |
IFT80 |
SRTD2 |
CB et axonème |
IFT antérograde (B) |
| |
NEK1 |
SRTD6 |
CB |
Ciliogenèse |
| |
WDR35/IFT121 WDR60 |
SRTD7 |
CB et axonème |
IFT rétrograde (A) |
| |
WDR19/IFT144 |
SRTD8 |
CB |
Ciliogenèse |
| |
|
SRTD5 |
Base ciliaire |
IFT rétrograde (A) |
|
| Sensenbrenner (dysplasie |
Raccourcissement rhizomélique des membres, dolichocéphalie, défauts ectodermiques affectant cheveux, dents et ongles, néphronophtise, malformation plaque ductale hépatique |
IFT122 |
CED1 |
Axonème |
IFT rétrograde (A) |
| cranio-ectodermique) |
IFT43 |
CED3 |
Axonème |
IFT rétrograde (A) |
| |
WDR19/IFT144 |
CED4 |
CB et axonème |
IFT rétrograde (A) |
| |
WDR35/ IFT121 |
CED2 |
CB et axonème |
IFT rétrograde (A) |
|
| Ellis-Van-Creveld |
Polydactylie, raccourcissement membres et côtes, malformations cardiaques, dysplasie ectodermique |
EVC |
|
CB |
Complexe EVC/EVC2 : |
| EVC2 |
CB |
signalisation Hedgehog |
Maladie polykystique rénale
|
| Polykystose |
Kystes rénaux et hépatiques |
PKD1 |
|
Compartiment ciliaire/mb plasmique/cytoplasme Compartiment ciliaire/mb plasmique/cytoplasme |
Complexe avec polycystine2 (PKD2), |
| rénale |
progressifs à l’âge adulte |
|
mécanosenseur |
| dominante |
|
PKD2 |
Complexe avec polycystine 1, canal TRP, |
|
|
|
mécanosenseur |
|
| Polykystose |
Kystes rénaux et hépatiques |
PKHD1 |
|
Centrosome/compartiment ciliaire/mb plasmique |
Interaction avec polycystine 2 (PKD2), mécanosenseur |
| rénale récessive |
sévères et précoces |
Levels of flare activity used in forecasting. The label and the wording occur in the daily bulletin. The flare class is the level defined to compare the forecasts to observations. |
|
Génétique des ciliopathies Les ciliopathies se caractérisent par une hétérogénéité génétique majeure : chaque syndrome clinique peut être causé par des mutations bi-alléliques dans différents gènes, et des mutations d’un gène donné peuvent entraîner différents tableaux cliniques de ciliopathies (Tableau I). En parallèle avec le chevauchement phénotypique entre différentes ciliopathies, on observe également un important chevauchement génétique avec un allélisme marqué entre diverses ciliopathies2
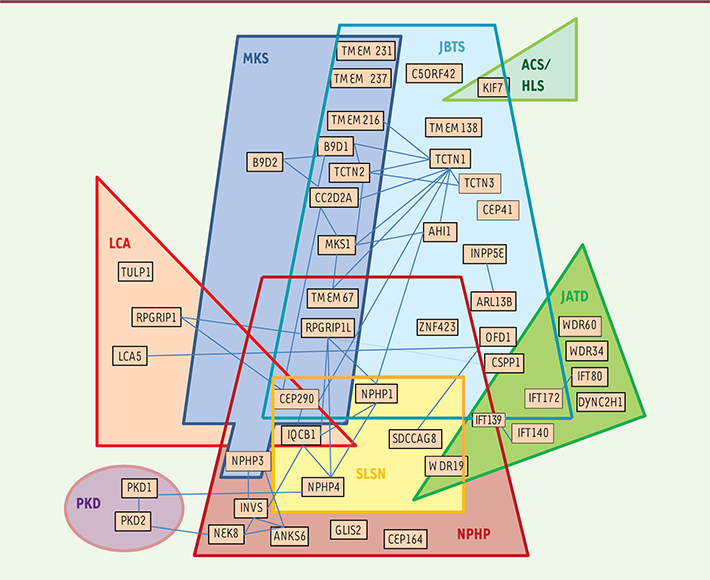
(Figure 2). Cela est particulièrement bien illustré par les syndromes de Joubert et de Meckel dont le chevauchement génétique est tel que ces deux syndromes peuvent, dans les faits, être considérés comme les deux extrêmes d’une même pathologie [13]. Malgré cette complexité génétique, on constate un certain regroupement en modules fonctionnels des produits de gènes associés à une ciliopathie donnée. Ainsi, une grande partie des gènes dont les mutations sont à l’origine des syndromes de Joubert et de Meckel codent pour des protéines s’associant en complexes multiprotéiques au niveau de la zone de transition [14], alors que plusieurs gènes en cause dans le syndrome de Bardet-Biedl codent pour des protéines formant un complexe multiprotéique distinct nommé le BBSome [15] (Figure 1, Tableau I). Mais, au-delà des multiples interactions physiques entre protéines associées à une même ciliopathie, il y a également des interactions physiques entre les composants de différents modules, et le réseau d’interactions protéiques sous-jacent aux ciliopathies est extrêmement complexe [16] (Figure 2).
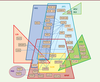 | Figure 2.
Chevauchement des modules génétiques corespondant à diverses ciliopathies. Chaque figure géométrique regroupe les gènes atteints dans une ciliopathie donnée et les intersections des différentes figures indiquent les chevauchements génétiques entre divers syndromes. Les fines lignes bleues indiquent les interactions entre protéines (dont la représentation ici n’est pas exhaustive, mais vise surtout à souligner les nœuds d’interaction entre protéines d’une même ciliopathie). Cette figure n’est pas exhaustive et plusieurs ciliopathies importantes ont été omises par souci de clarté. JSRD : syndrome de Joubert et maladies associées ; MKS : syndrome de Meckel ; JATD : dystrophie thoracique asphyxiante de Jeune ; NPHP : néphronophtise ; SLNS : syndrome de Senior-Løken ; PKD : maladie polykystique rénale dominante ; ACS : syndrome acrocalleux ; HLS : syndrome hydrolethalus fœtal ; LCA : amaurose congénitale de Leber. |
Les ciliopathies présentent, pour la plupart, une hérédité récessive. Toutefois, en raison de l’importante hétérogénéité génétique, de la variabilité phénotypique marquée et de l’identification de mutations hétérozygotes chez de nombreux patients, une hérédité plus complexe a été proposée dans laquelle les effets de mutations/variations dans deux gènes (ou plus) joueraient un rôle dans la pénétrance ou l’expressivité d’une ciliopathie donnée. Ainsi, le terme de « tri-allélisme » a été utilisé dans des cas où, en plus des mutations bi-alléliques dans un gène, une troisième mutation hétérozygote dans un second gène serait nécessaire pour causer la maladie [17]. Une hérédité digénique, où des mutations hétérozygotes dans deux gènes causeraient la maladie, a également été rapportée [18]. Toutefois, seuls quelques exemples dans le cas du syndrome de Bardet-Biedl soutiennent l’idée de tri-allélisme, et il reste à démontrer que ce mécanisme jouerait un rôle dans d’autres ciliopathies. De même, il n’y a pour l’instant que peu d’indications qu’une transmission digénique existe dans les ciliopathies. En revanche, plusieurs articles soutiennent l’existence de modificateurs génétiques du phénotype, sous forme de variations hétérozygotes additionnelles aux mutations bi-alléliques causales : la variation R830W dans le gène AHI1, par exemple, est statistiquement associée à une rétinopathie chez les patients atteints de néphronophtise [19]. En conclusion, les ciliopathies restent des maladies mendéliennes à hérédité récessive classique, causées par des mutations bi-alléliques dans un gène causal, dont le phénotype peut potentiellement être influencé par des variations dans des gènes additionnels. |
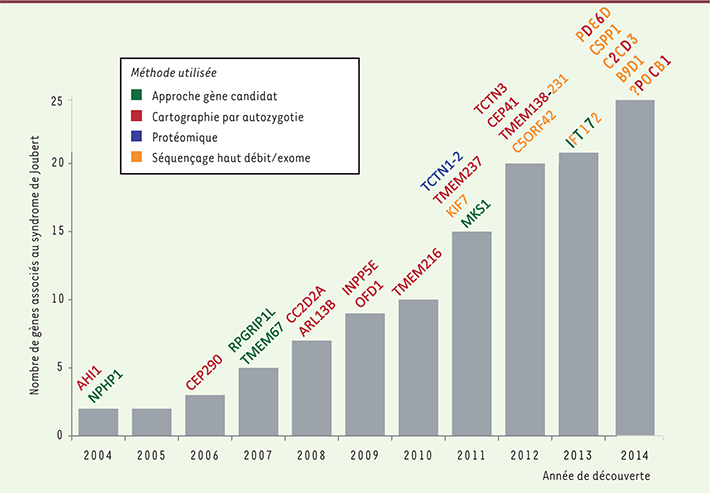
Découverte de nouveaux gènes : l’exemple du syndrome de Joubert L’identification de gènes responsables du syndrome de Joubert illustre très bien les succès de la génétique moderne et l’évolution des méthodes employées par les « chasseurs de gènes » ; ce syndrome nous servira d’exemple dans la suite de cet article. Le premier gène impliqué dans ce syndrome a été identifié il y a dix ans, et la
Figure 3
illustre la rapide accélération dans l’identification des gènes responsables, liée aux progrès de la génomique. Le syndrome de Joubert présente un avantage important pour l’identification des gènes impliqués : le diagnostic repose sur un signe pathognomonique, qui est la présence du « signe de la dent molaire » sur l’IRM (imagerie par résonance magnétique) cérébrale, image formée par une malformation spécifique du vermis cérébelleux et du tronc cérébral [20]. Ce signe permet l’uniformité diagnostique des cohortes, qui est un paramètre essentiel à la découverte des gènes responsables. Peuvent s’ajouter à cette malformation du système nerveux central de manière variable d’autres signes cliniques caractéristiques des ciliopathies : une dégénérescence rétinienne, une atteinte tubulo-interstitielle rénale, une fibrose hépatique et/ou une polydactylie, et un sous-groupe de patients présentent également une dysplasie osseuse de type « Jeune » [21]. Le syndrome de Joubert est donc parfaitement représentatif du groupe des ciliopathies, en raison du chevauchement phénotypique et génétique avec d’autres ciliopathies.
 | Figure 3.
Chronologie et méthodologies de l’identification des gènes associés au syndrome de Joubert. Nombre de gènes identifiés, dont le dysfonctionnement cause le syndrome de Joubert, en fonction de l’année. Le nom des gènes au-dessus de chaque colonne indique l’année de l’identification de leur association avec ce syndrome et la couleur indique la méthode utilisée selon la légende dans l’encadré. |
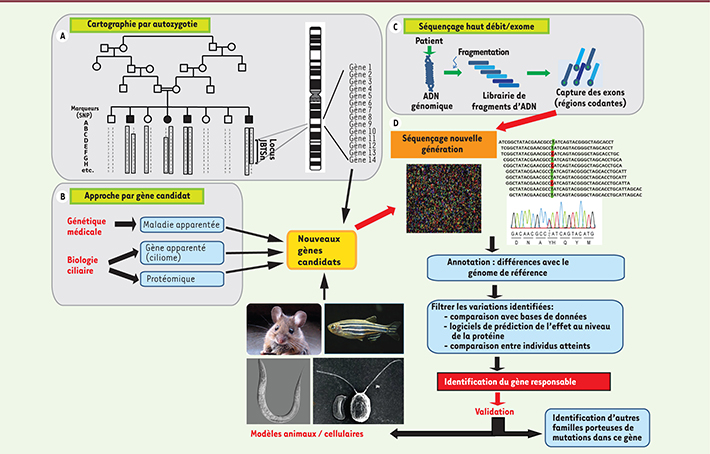
Méthodes d’identification de nouveaux gènes appliquées au syndrome de Joubert L’analyse comparative entre espèces, ainsi que les avancées de la génomique et de la protéomique, ont été déterminantes pour l’identification de gènes dans les ciliopathies ; en particulier via le concept de « ciliome », qui désigne l’ensemble des gènes/protéines impliqués dans le fonctionnement du cil primaire [ 22]. Le ciliome, dont la taille est impressionnante (environ 2 500 gènes/protéines, soit > 10 % de tous nos gènes !), offre une base de données essentielle pour l’identification des gènes candidats. Il guide le séquençage en ciblant des gènes contenus dans une région chromosomique identifiée par cartographie (voir plus loin) ; il aide également l’interprétation des mutations/variations identifiées par les nouvelles technologies de séquençage à haut débit. En effet, des variations observées dans un gène du ciliome auront la priorité sur des variations dans des gènes dont la fonction et la localisation sont inconnues. Cartographie par autozygotie Le mode de transmission récessif des ciliopathies a permis aux chercheurs d’utiliser la stratégie de cartographie par autozygotie, basée sur la ségrégation de marqueurs entre membres d’une famille consanguine [ 23]. En identifiant à l’aide de micropuces ( microarray) les polymorphismes nucléotidiques (SNP) qui sont homozygotes chez tous les individus atteints, on peut déterminer la région chromosomique (le locus) contenant le gène responsable, dont la taille sera d’autant plus petite que le nombre d’individus porteurs de mutations dans le même gène est grand (Figure 4A). Après détermination du locus, le séquençage des gènes contenus dans l’intervalle peut être effectué par la méthode de Sanger ou, depuis plus récemment, par les méthodes de séquençage à haut débit (Figure 4D).
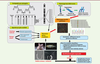 | Figure 4.
Méthodes d’identification de gènes responsables de ciliopathies. A. Cartographie par autozygotie. Grâce à une micropuce (array), l’ensemble des polymorphismes nucléotidiques (SNP) du génome de tous les membres d’une famille consanguine sont génotypés. En comparant ces marqueurs entre les différents membres de la famille, on identifie ceux qui sont homozygotes seulement chez les sujets atteints, ce qui permet de déterminer la région chromosomique (locus) contenant le gène responsable. B. Approche gène candidat qui peut provenir soit de connaissances de la génétique médicale, soit de connaissances de la biologie ciliaire et de la protéomique. D. Séquençage haut débit qui peut être utilisé soit en aval des deux premières méthodes pour séquencer ensemble un grand nombre de gènes candidats, soit dans une approche globale non sélective de toutes les régions codantes du génome, regroupées sous le terme exome (C).
|
Gènes candidats et modèles animaux Une alternative à la cartographie/analyse de liaison est le séquençage ciblé d’un gène candidat qu’on identifie, soit grâce à une maladie apparentée, soit grâce à une bonne connaissance de la biologie sous-jacente (Figure 4B). Dans le cas du syndrome de Joubert, le deuxième 3, gène causal identifié fut NPHP1 ( nephronophtisis 1), un gène préalablement connu comme responsable de néphronophtise 4. Comme certains individus atteints du syndrome de Joubert développent le même type d’atteinte rénale tubulo-interstitielle, les auteurs ont postulé que des mutations de NPHP1 pouvaient également causer le syndrome de Joubert, ce qui fut confirmé par un séquençage ciblé de ce gène [ 24]. De manière similaire, des mutations de TMEM67 ( transmembrane protein 67), gène dont les mutations sont également responsables du syndrome de Meckel, furent identifiées chez des individus atteints de syndrome de Joubert [ 25]. Tirant parti des connaissances acquises dans la biologie ciliaire, on rechercha également spécifiquement des mutations de RPGRIP1L ( retinitis pigmentosa GTPase regulator interacting protein 1L) chez des individus souffrant de syndrome de Joubert [ 26] en raison de l’association de RPGRIP1, une protéine apparentée, avec CEP290 ( centrosomal protein of 290-kDa) [ 27], déjà identifiée comme causant ce syndrome [ 28]. Protéomique et biologie des systèmes Les progrès importants de la protéomique ont également bénéficié à l’identification de nouveaux gènes dans les ciliopathies, en particulier dans le cas du syndrome de Joubert. En isolant des protéines connues, dont le rôle dans ce syndrome était déjà établi (NPHP1, CEP290, etc.), et en déterminant par spectrométrie de masse les protéines qui interagissent avec elles, il a été possible d’identifier le gène TCTN2 ( tectonic family member 2) comme gène associé au syndrome de Joubert [ 14]. Dans une expérience similaire, l’identification des protéines interagissant avec TCTN1, qui toutes étaient déjà impliquées dans le syndrome de Joubert, a permis la reconnaissance du rôle de TCTN1 dans ce syndrome [ 29]. Ces études de grande ampleur ont permis non seulement de découvrir de nouveaux gènes responsables, mais aussi d’identifier les complexes multiprotéiques formés par les produits de nombreux gènes impliqués dans le syndrome de Joubert, permettant ainsi d’expliquer partiellement comment le dysfonctionnement de différents gènes mène à un seul et même phénotype. L’envergure des projets protéomiques pousse les chercheurs à joindre leurs efforts et à créer des consortiums s’engageant dans une approche de « biologies des systèmes » pour étudier le groupe des ciliopathies dans son ensemble (par exemple projet européen SYSCILIA, http://syscilia.org/ ou le GDR3581 CIL en France, http://gdr-cil.snv.jussieu.fr/ ). Séquençage nouvelle génération à haut débit : exomes Avec les progrès constants des méthodes de séquençage à haut débit [ 30] et la baisse des coûts associés, il est maintenant techniquement et économiquement possible de séquencer directement toutes les régions codantes (exons) du génome d’un individu, ce que désigne le terme exome [ 31] (Figure 4C). La principale difficulté que soulève cette technique est celle de l’interprétation des résultats. En effet, ces méthodes détectent un grand nombre de variations dont il est difficile de déterminer l’effet au niveau clinique. D’une part, beaucoup de ces variations sont des substitutions d’acides aminés dont l’effet au niveau protéique est peu clair. D’autre part, même des variations a priori délétères, comme des substitutions non-sens, ne constituent pas une preuve causale de leur responsabilité dans le phénotype observé. Ainsi, toutes les techniques mentionnées ci-dessus restent importantes, comme l’exploration de l’effet biologique (ciliome), l’analyse correcte de la ségrégation dans les familles étudiées, et la validation dans d’autres familles et à l’aide d’un organisme modèle (souris, poisson zèbre) des altérations identifiées, qui doivent reproduire les signes de la maladie. |
Grâce aux progrès spectaculaires de la génomique et des techniques modernes de séquençage dont le coût est devenu abordable, on obtiendra bientôt une carte détaillée de toutes les variations génétiques d’un individu atteint d’une ciliopathie. Le défi sera l’analyse et l’interprétation de ces données dans la perspective de leur utilisation clinique. La priorité reste l’identification du gène responsable de la maladie chez chaque individu atteint, de manière à offrir aux familles une certitude diagnostique et la possibilité d’un diagnostic prénatal si la famille le souhaite. Malgré les avancées rapides dans ce domaine, même ce premier objectif n’est pas encore atteint, sans doute parce que de nombreux gènes, contribuant chacun à quelques cas seulement, restent à découvrir. De plus, il est probable qu’une partie des mutations causales seront présentes dans des régions régulatrices non codantes, et seront, de ce fait, plus difficiles à identifier et confirmer. Au-delà de l’identification du gène causal chez chaque individu, le prochain défi, encore plus difficile à relever que le premier, sera l’interprétation de l’effet combiné de toutes les variations identifiées chez un individu donné. Cette étape sera obligatoire pour établir un pronostic fiable, condition nécessaire à une application pratique de la médecine personnalisée. Dans cette optique, une bonne compréhension de la biologie ciliaire fournie par de multiples approches complémentaires (génétique et génomique humaine, protéomique, modèles animaux et biologie des systèmes) est incontournable. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Badano JL, Mitsuma N, Beales PL, Katsanis N. The ciliopathies: an emerging class of human genetic disorders . Annu Rev Genom Human Genet. 2006; ; 7 : :125.–148. 2.
Kennedy B, Malicki J. What drives cell morphogenesis: a look inside the vertebrate photoreceptor . Dev Dyn. 2009; ; 238 : :2115.–2138. 3.
Satir P, Pedersen LB, Christensen ST. The primary cilium at a glance . J Cell Sci. 2010; ; 123 : :499.–503. 4.
Goetz SC, Anderson KV. The primary cilium: a signalling centre during vertebrate development . Nat Rev Genet. 2010; ; 11 : :331.–344. 5.
Williams CL, Li C, Kida K, et al. MKS and NPHP modules cooperate to establish basal body/transition zone membrane associations and ciliary gate function during ciliogenesis . J Cell Biol. 2011; ; 192 : :1023.–1041. 6.
Rosenbaum JL, Witman GB. Intraflagellar transport . Nat Rev Mol Cell Biol. 2002; ; 3 : :813.–825. 7.
Zariwala MA, Knowles MR, Omran H. Genetic defects in ciliary structure and function . Annu Rev Physiol. 2007; ; 69 : :423.–450. 8.
Baker K, Beales PL. Making sense of cilia in disease: the human ciliopathies . Am J Med Genet C Semin Med Genet. 2009; ; 151 : :281.–295. 9.
Boon M, Jorissen M, Proesmans M, Boeck K. Primary ciliary dyskinesia, an orphan disease . Eur J Pediatr. 2013; ; 172 : :151.–162. 10.
Beales PL, Elcioglu N, Woolf AS, et al. New criteria for improved diagnosis of Bardet-Biedl syndrome: results of a population survey . J Med Genet. 1999; ; 36 : :437.–446. 11.
Putoux A, Thomas S, Coene KLM, et al. KIF7 mutations cause fetal hydrolethalus and acrocallosal syndromes . Nat Genet. 2011; ; 43 : :601.–606. 12.
Zaki MS, Sattar S, Massoudi RA, Gleeson JG. Co-occurrence of distinct ciliopathy diseases in single families suggests genetic modifiers . Am J Med Genet A. 2011; ; 155 : :3042.–3049. 13.
Mougou-Zerelli S, Thomas S, Szenker E, et al. CC2D2A mutations in Meckel and Joubert syndromes indicate a genotype-phenotype correlation . Hum Mutat. 2009; ; 30 : :1574.–1582. 14.
Sang L, Miller JJ, Corbit KC, et al. Mapping the NPHP-JBTS-MKS protein network reveals ciliopathy disease genes and pathways . Cell. 2011; ; 145 : :513.–528. 15.
Nachury MV, Loktev AV, Zhang Q, et al. A core complex of BBS proteins cooperates with the GTPase Rab8 to promote ciliary membrane biogenesis . Cell. 2007; ; 129 : :1201.–1213. 16.
Van Reeuwijk J, Arts HH, Roepman R., Scrutinizing ciliopathies by unraveling ciliary interaction networks . Hum Mol Genet. 2011; ; 20 : :R149.. 17.
Katsanis N, Ansley SJ, Badano JL, et al. Triallelic inheritance in Bardet-Biedl syndrome, a Mendelian recessive disorder . Science. 2001; ; 293 : :2256.–2259. 18.
Hoefele J, Wolf MTF, O’Toole JF, et al. Evidence of oligogenic inheritance in nephronophthisis . J Am Soc Nephrol. 2007; ; 18 : :2789.–2795. 19.
Louie CM, Caridi G, Lopes VS, et al. AHI1 is required for photoreceptor outer segment development and is a modifier for retinal degeneration in nephronophthisis . Nat Genet. 2010; ; 42 : :175.–180. 20.
Maria BL, Hoang KBN, Tusa RJ, et al. Joubert syndrome revisited: key ocular motor signs with magnetic resonance imaging correlation . J Child Neurol. 1997; ; 12 : :423.–430. 21.
Romani M, Micalizzi A, Valente EM. Joubert syndrome: congenital cerebellar ataxia with the molar tooth . Lancet Neurol. 2013; ; 12 : :894.–905. 22.
Inglis PN, Boroevich KA, Leroux M. Piecing together a ciliome . Trends Genet. 2006; ; 22 : :491.–500. 23.
Lander ES, Botstein D. Homozygosity mapping: a way to map human recessive traits with the DNA of inbred children . Science. 1987; ; 236 : :1567.–1570. 24.
Parisi MA, Bennett CL, Eckert ML, et al. The NPHP1 gene deletion associated with juvenile nephronophthisis is present in a subset of individuals with Joubert syndrome . Am J Hum Genet. 2004; ; 75 : :82.–91. 25.
Baala L, Romano S, Khaddour R, et al. The Meckel-Gruber syndrome gene, MKS3, is mutated in Joubert syndrome . Am J Hum Genet. 2007; ; 80 : :186.–194. 26.
Arts HH, Doherty D, van Beersum SEC, et al. Mutations in the gene encoding the basal body protein RPGRIP1L, a nephrocystin-4 interactor, cause Joubert syndrome . Nat Genet. 2007; ; 39 : :882.–888. 27.
Chang B, Khanna H, Hawes N, et al. In-frame deletion in a novel centrosomal/ciliary protein CEP290/NPHP6 perturbs its interaction with RPGR and results in early-onset retinal degeneration in the rd16 mouse . Hum Mol Genet. 2006; ; 15 : :1847.–1857. 28.
Sayer JA, Otto EA, O’Toole JF, et al. The centrosomal protein nephrocystin-6 is mutated in Joubert syndrome and activates transcription factor ATF4 . Nat Genet. 2006; ; 38 : :674.–681. 29.
Garcia-Gonzalo FR, Corbit KC, Sirerol-Piquer MS, et al. A transition zone complex regulates mammalian ciliogenesis and ciliary membrane composition . Nat Genet. 2011; ; 43 : :776.–784. 30.
Metzker ML. Sequencing technologies: the next generation . Nat Rev Genet. 2010; ; 11 : :31.–46. 31.
Bamshad MJ, Ng SB, Bigham AW, et al. Exome sequencing as a tool for Mendelian disease gene discovery . Nat Rev Genet. 2011; ; 12 : :745.–755. 32.
Fort C, Bastin P. Élongation de l’axonème et dynamique du transport intraflagellaire . Med Sci (Paris). 2014; ; 30 : :955.–961. 33.
Laclef C. Le cil primaire, orchestrateur de la morphogenèse cérébrale . Med Sci (Paris). 2014; ; 30 : :980.–990. 34.
Diguet N, Meilhac SM. Cils et morphogenèse cardiaque . Med Sci (Paris). 2014; ; 30 : :996.–1003. 35.
Chennen K, Scerbo MJ, Dollfus H, et al. BBS: cils et obésité : de la génétique à l’approche intégrative . Med Sci (Paris). 2014; ; 30 : :1034.–1039. 36.
Paces-Fessy M. Cils et kystes rénaux . Med Sci (Paris). 2014; ; 30 : :1024.–1033. |