| |
| Med Sci (Paris). 2015 February; 31(2): 129–131. Published online 2015 March 4. doi: 10.1051/medsci/20153102005.Mutation de STAG3 Une nouvelle cause d’insuffisance ovarienne prématurée Sandrine Caburet1** and Éric Vilain2* 1Institut Jacques Monod, oncologie moléculaire et pathologies ovariennes, UMR7592, CNRS et université Paris Diderot, bâtiment Buffon, 15, rue Hélène Brion, 75205Paris Cedex 13, France 2Center for gender-based biology, Department of Human Genetics, David Geffen school of medicine, UCLA Gonda center, room 5506, 695 Charles Young drive south, CA 90095Los Angeles, États-Unis MeSH keywords: Adulte, Protéines du cycle cellulaire, Protéines chromosomiques nonhistones, Consanguinité, Exons, Femelle, Instabilité du génome, Génotype, Mutation germinale, Humains, Infertilité féminine, Méiose, Tumeurs primitives multiples, Syndromes néoplasiques héréditaires, Protéines nucléaires, Tumeurs de l'ovaire, Pedigree, Insuffisance ovarienne primitive, Délétion de séquence, Complexe synaptonémal, génétique, physiologie, déficit, physiopathologie |
« Un anneau pour les gouverner tous, un anneau pour les trouver, un anneau pour les amener tous, et dans les ténèbres les lier… »
J.R.R. Tolkien (Le Seigneur des Anneaux)
L’insuffisance ovarienne prématurée (IOP) est une cause majeure d’infertilité féminine. Cette pathologie se traduit par un épuisement de la réserve ovarienne en follicules avant l’âge de 40 ans, un arrêt des menstruations et des déséquilibres hormonaux. D’un point de vue médical, de nombreuses causes peuvent expliquer cette atteinte des ovaires, par exemple un traitement de chimiothérapie ou une auto-immunité ciblant les follicules ou les ovocytes. Comme il existe des familles avec plusieurs cas d’insuffisance ovarienne prématurée, on peut également rechercher une composante génétique pour cette maladie. Dans ces familles, on parle d’insuffisance ovarienne prématurée secondaire lorsque les mères ont le temps d’avoir des enfants avant d’être atteintes, ou d’insuffisance ovarienne prématurée primaire si plusieurs sœurs ou cousines sont atteintes dès la puberté. Des familles où l’on rencontre plusieurs cas d’une même pathologie sont très utiles en génétique humaine, car des analyses de liaison peuvent permettre d’identifier le ou les gènes dont les mutations sont responsables de la maladie. C’est une approche de ce type qui a permis d’identifier plusieurs gènes mutés dans des cas familiaux d’insuffisance ovarienne prématurée primaire, comme celui codant pour le récepteur de la FSH (follicle stimulating hormone), une hormone essentielle à la croissance des follicules ovariens [1]. Malgré ces avancées, la cause de la pathologie reste inconnue dans la majorité des cas d’insuffisance ovarienne prématurée, et la recherche de nouveaux gènes impliqués continue activement. Cependant, par définition, une grande famille avec de nombreux cas d’infertilité est rare… Nous avons eu la chance de pouvoir analyser une telle famille et de trouver une mutation dans un gène qui n’avait pas encore été impliqué dans cette maladie. |
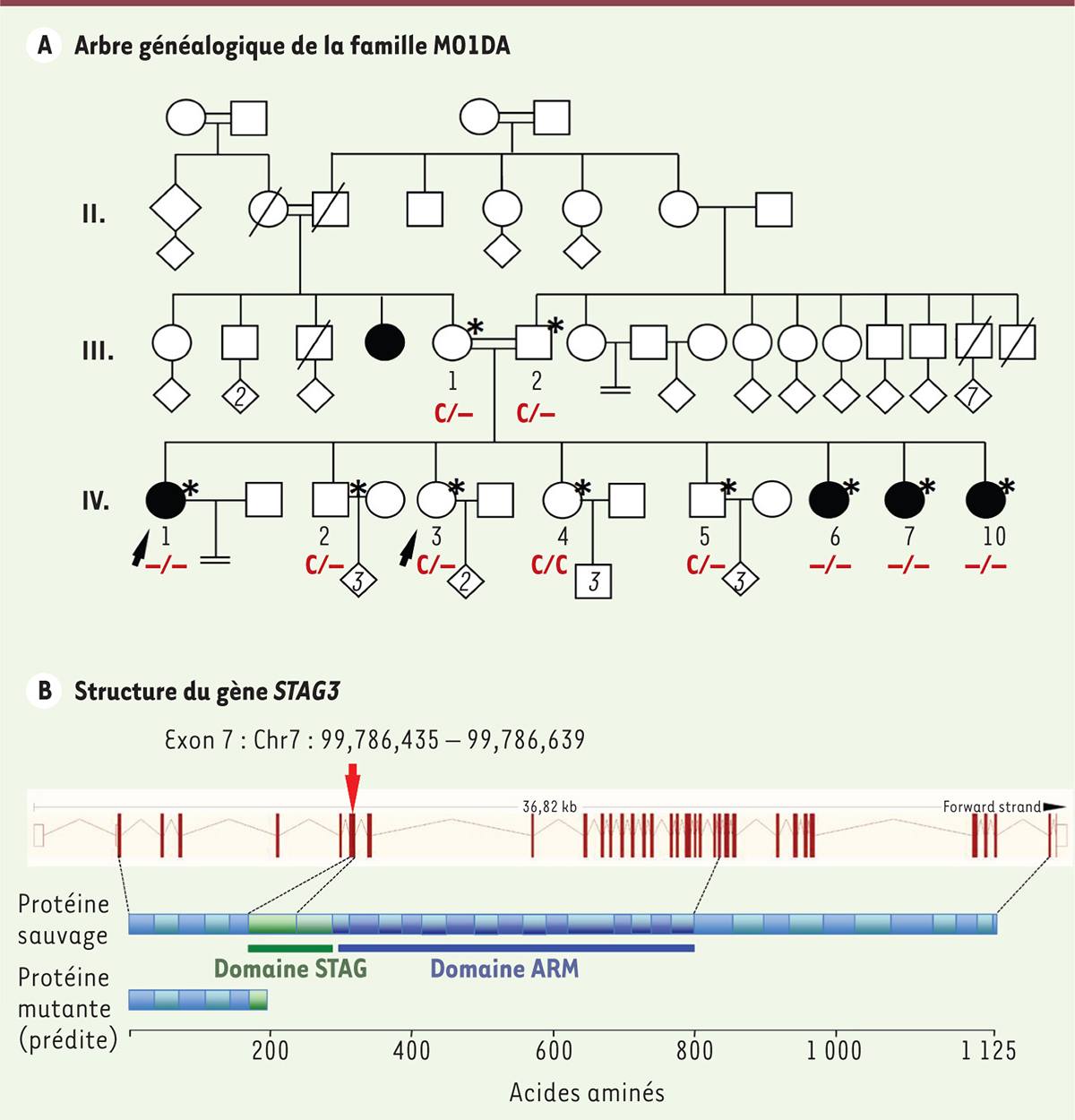
Analyse génétique approfondie d’une grande famille consanguine Dans cette famille, quatre sœurs sur six sont atteintes d’insuffisance ovarienne prématurée primaire, tandis que les frères sont fertiles. Il s’agit d’une famille du Moyen-Orient, et puisque c’est la coutume là-bas de se marier entre cousins, elle a la particularité de présenter un fort taux de consanguinité. Cette consanguinité importante permettait d’envisager une transmission particulière de la mutation responsable de l’infertilité, par homozygotie par descendance (Figure 1A).
 | Figure 1.
Identification d’une mutation du gène STAG3 dans une famille consanguine avec insuffisance ovarienne prématurée. A. Arbre généalogique de la famille MO1DA, dont l’analyse a permis l’identification d’une mutation du gène STAG3 à l’origine de l’insuffisance ovarienne prématurée chez 4 des 6 filles (ronds noirs). Selon le scénario de l’homozygotie par descendance, une mutation apparaît chez un ancêtre, se transmet en un seul exemplaire par deux branches cousines, puis est transmise par chacun des deux cousins qui se marient à leurs enfants, qui héritent donc de 2 exemplaires identiques de la mutation. Les mariages consanguins sont indiqués par une double barre, et le statut vis-à-vis de la délétion dans STAG3 est noté sous chaque individu. La délétion provenant d’un des ancêtres communs aux deux parents est présente chez eux à l’état hétérozygote. Elle a été transmise par chacun à leurs filles atteintes, qui se retrouvent donc homozygotes pour la mutation ; et, par l’un ou l’autre, aux enfants hétérozygotes (porteurs sains fertiles). Une seule sœur est homozygote sauvage. À l’âge de 19 ans, la plus jeune des 4 sœurs atteintes a développé un cancer complexe des ovaires, bilatéral et simultané, avec une origine germinale nette des tumeurs. Une explication possible serait que quelques ovocytes auraient survécu à la dégénérescence ovarienne, mais que la mutation de STAG3 aurait induit une instabilité génomique conduisant à un processus tumoral. Les étoiles indiquent les personnes incluses dans l’analyse de liaison initiale, et les flèches les deux sœurs dont le génome a été analysé par séquençage d’exome. B. Structure du gène STAG3. La mutation est une délétion d’une seule base dans la séquence de l’exon 7, qui induit à un décalage du cadre de lecture. S’il n’est pas dégradé avant son export hors du noyau par les systèmes de contrôle, l’ARN messager sera alors lu lors de la traduction avec un codon stop juste en aval de la délétion. La protéine produite serait alors tronquée à 16 % de sa longueur normale et quasiment dépourvue de ses deux domaines fonctionnels. |
Dans une première étape de génétique, nous avons cartographié les régions du génome susceptibles de contenir la mutation, par analyse de liaison. Cette méthode consiste à analyser des marqueurs génétiques le long des chromosomes, et à repérer ceux dont la transmission est plus systématiquement couplée à celle de la maladie. Nous avions ainsi pu identifier deux régions du chromosome 7 pouvant contenir la mutation [2]. Cependant, ces régions étaient trop grandes et contenaient trop de gènes pour pouvoir séquencer ces derniers un par un. Nous avons donc poursuivi l’analyse du génome de ces patientes en utilisant une technologie plus récente, le séquençage d’exome (whole-exome sequencing). Cette approche, en passe de devenir une forme d’analyse génétique courante, utilise les dernières générations de séquenceurs à haut débit pour obtenir préférentiellement la séquence des exons, c’est-à-dire des portions du génome qui codent principalement pour les protéines ; ces régions ont donc une forte probabilité de contenir une mutation ayant un effet délétère sur la vie de la cellule ou de l’organe. En comparant les variants trouvés par séquençage d’exome chez l’une des filles atteintes avec ceux présents chez sa sœur non atteinte, nous avons identifié un seul variant, contenu dans l’une des régions du chromosome 7 identifiée auparavant, pouvant expliquer la pathologie. La suite logique était de confirmer, par la méthode de séquençage classique de Sanger, que cette mutation était bien présente en deux exemplaires chez toutes les filles atteintes, présente en un seul exemplaire chez les parents, et en un seul exemplaire - ou absente - chez les frères et sœurs fertiles [3]. |
STAG3, un gène essentiel pour la formation des gamètes Le gène touché par la mutation est le gène STAG3 (stromal antigen 3) et, dans cette famille, la pathologie s’explique par l’atteinte des deux copies du gène, ce qui le rend inactif (Figure 1B). STAG3 code pour une protéine de la famille des cohésines, qui fait partie d’un complexe en forme d’anneau, essentiel pour assurer l’appariement des chromosomes et le brassage génétique au cours de la formation des gamètes. En effet, au tout début de la méiose (la division cellulaire particulière qui permet la formation des gamètes haploïdes), les chromosomes homologues se rapprochent physiquement, se collent l’un à l’autre et échangent des portions d’ADN par recombinaison [4, 5]. Par ces échanges, les chromosomes paternels et maternels sont remaniés, ce qui conduit à un brassage de l’information génétique provenant de chacun des parents, et donc à une possibilité de diversité pour la génération suivante. L’anneau protéique contenant STAG3 intervient très tôt lors de ce processus : il entoure les chromosomes de façon à permettre la mise en place d’un autre complexe essentiel, le complexe synaptonémal, sorte de fermeture éclair entre les chromosomes homologues qui maintient un appariement correct et permet les échanges génétiques. Une absence de STAG3 conduit donc à un mésappariement des chromosomes et à un arrêt précoce de la méiose, qui induit la dégénérescence des ovocytes, et, en cascade, celle des follicules et de l’ovaire tout entier. Et, comme cette phase de la méiose a lieu très tôt au cours du développement intra-utérin, les ovaires ont le temps de dégénérer complètement avant l’âge de la puberté, ce qui explique l’insuffisance ovarienne prématurée primaire dans la famille étudiée. Pour confirmer que c’était bien l’inactivation de STAG3 qui induisait l’insuffisance ovarienne primaire dans cette famille, nous avons analysé des souris portant une inactivation du gène orthologue. Nous avons ainsi montré que les souris femelles hétérozygotes pour l’inactivation de Stag3 sont fertiles, mais que les homozygotes sont stériles, et que leurs ovocytes sont très précocement bloqués au début de la méiose, ce qui induit une dégénérescence massive des follicules ovariens dès la première semaine de vie. Dans une partie supplémentaire de l’étude sur des souris mâles, nos collègues espagnols ont montré que ce blocage précoce a également lieu dans les spermatocytes, et conduit à une infertilité par azoospermie (absence totale de spermatozoïdes dans le sperme) [6]. Ces résultats ont été confirmés par trois études indépendantes de souris invalidées pour Stag3, qui montrent aussi un blocage précoce de la méiose, une dégénérescence des ovaires et des testicules, et une infertilité totale des souris mutantes [7–9]. |
Les altérations des cohésines forment un petit groupe de maladies dues aux mutations germinales des gènes codant pour les différentes cohésines. Ces pathologies, comme le syndrome de Cornelia de Lange ou le syndrome de Roberts, se caractérisent par des défauts sévères lors du développement fœtal et post-natal, associant des malformations congénitales, un retard de croissance et un déficit intellectuel plus ou moins important. L’identification d’une mutation germinale de STAG3 permet donc d’élargir le champ de ces cohésinopathies à une infertilité isolée. L’expression purement méiotique de STAG3 explique que l’effet de la mutation ne touche que la formation des gamètes. La sévérité des atteintes dues aux mutations des cohésines souligne le rôle crucial de ces protéines dans la stabilité chromosomique, confirmé par l’identification de mutations somatiques dans différents cancers. En effet, des mutations dans les gènes codant pour diverses cohésines, dont STAG3 et son paralogue STAG2, ont été récemment identifiées comme causales dans des leucémies et diverses tumeurs solides [10, 11]. Ceci est sans doute en lien avec le cancer bilatéral des ovaires développé par l’une des patientes atteinte d’insuffisance ovarienne primaire dans la famille étudiée. Au final, ces résultats mettent en lumière de nouveaux mécanismes responsables de l’insuffisance ovarienne prématurée, et, plus généralement, l’importance de la stabilité génomique dans la mise en place et le maintien de la fertilité. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Cette étude est le fruit d’une collaboration de plus de 10 ans entre une équipe de cliniciens (Ziva Ben-Neriah, Department of Genetics, Hadassah University Hospital, Jerusalem, Israel), trois équipes de généticiens en France (Sandrine Caburet et Reiner Veitia, Institut Jacques Monod, Université Paris Diderot, Paris ; Marc Fellous et Daniel Vaiman, Institut Cochin, Université Paris Descartes, Paris) et aux États-Unis (Valerie Arboleda et Eric Vilain, UCLA, Los Angeles, USA), et deux équipes de biologistes moléculaires aux États-Unis (Kazuhiro Oka et Paul Overbeek, Baylor College of Medicine, Houston) et en Espagne (Elena Llano et Alberto Pendás, Instituto de Biología Molecular y Celular del Cáncer, Salamanque). Tous nos remerciements à l’ensemble des intervenants pour leur fructueuse participation. Et bien sûr, nos remerciements sincères vont à la famille MO1DA, qui a toujours montré un grand intérêt et une grande implication dans nos recherches, tout au long de ces 10 ans.
|
1.
Aittomaki K, Lucena JL, Pakarinen P, et al. Mutation in the follicle-stimulating hormone receptor gene causes hereditary hypergonadotropic ovarian failure . Cell. 1995; ; 82 : :959.–968. 2.
Caburet S, Zavadakova P, Ben-Neriah Z, et al. Genome-wide linkage in a highly consanguineous pedigree reveals two novel loci on chromosome 7 for non-syndromic familial premature ovarian failure . PLoS One. 2012; ; 7 : :e33412.. 3.
Caburet S, Arboleda VA, Llano E, et al. Mutant cohesin in premature ovarian failure . N Engl J Med. 2014; ; 370 : :943.–949. 4.
Terret ME, Wassmann K. Le point faible méiotique : la première division . Med Sci (Paris). 2008; ; 24 : :197.–204. 5.
Baudat F, Buard J, Grey C, de Massy B. Comment sont choisis les sites d’échanges entre chromosomes lors de la méiose ? Med Sci (Paris). 2011; ; 27 : :1053.–1055. 6.
Llano E, Gomez HL, Garcia-Tunon I, et al. STAG3 is a strong candidate gene for male infertility . Hum Mol Genet. 2014; ; 23 : :3421.–3431. 7.
Winters T, McNicoll F, Jessberger R. Meiotic cohesin STAG3 is required for chromosome axis formation and sister chromatid cohesion . EMBO J. 2014; ; 33 : :1256.–1270. 8.
Hopkins J, Hwang G, Jacob J, et al. Meiosis-specific cohesin component, Stag3 is essential for maintaining centromere chromatid cohesion, and required for DNA repair and synapsis between homologous chromosomes . PLoS Genet. 2014; ; 10 : :e1004413.. 9.
Fukuda T, Fukuda N, Agostinho A, et al. STAG3-mediated stabilization of REC8 cohesin complexes promotes chromosome synapsis during meiosis . EMBO J. 2014; ; 33 : :1243.–1255. 10.
Solomon DA, Kim T, Diaz-Martinez LA, et al. Mutational inactivation of STAG2 causes aneuploidy in human cancer . Science. 2011; ; 333 : :1039.–1043. 11.
Kon A, Shih LY, Minamino M, et al. Recurrent mutations in multiple components of the cohesin complex in myeloid neoplasms . Nat Genet. 2013; ; 45 : :1232.–1237. |